Макроциклический стереоконтроль - Википедия - Macrocyclic stereocontrol
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Макроциклический стереоконтроль относится к направленному результату данного межмолекулярный или же внутримолекулярный химическая реакция, обычно органическая реакция, что определяется конформационными или геометрическими предпочтениями карбоциклический или же гетероциклический кольцо, где кольцо, содержащее 8 или более атомы.
Вступление
Стереоконтроль за циклогексан кольца хорошо известны в органической химии, в значительной степени из-за аксиального / экваториального предпочтительного расположения заместителей на кольце. Макроциклический стереоконтроль моделирует замещение и реакции средних и больших колец в органическая химия, с удаленным стереогенный элементы, обеспечивающие достаточное конформационное влияние, чтобы направить исход реакции.
Ранние предположения о макроциклах в синтетической химии считали их слишком гибкими, чтобы обеспечить хоть какую-то степень достоверности. стереохимический или же региохимический контроль в реакции. Эксперименты В. Кларк Стилл в конце 1970-х и 1980-х оспаривали это предположение,[1] в то время как несколько других нашли кристаллографические данные [2] и данные ЯМР [3] это предполагает, что макроциклические кольца не являются гибкими, конформационно неопределенными видами, как многие предполагали.
Степень, в которой макроциклическое кольцо является жестким или гибким, в значительной степени зависит от замещения кольца и общего размера.[4][5] Примечательно, что даже небольшие конформационные предпочтения, такие как те, что предусмотрены в гибких макроциклах, могут глубоко влиять на основное состояние данной реакции, обеспечивая стереоконтроль, такой как синтез мияколида.[6] Вычислительное моделирование может предсказывать конформации средних колец с разумной точностью, поскольку Стилл использовал вычисления моделирования молекулярной механики для предсказания конформаций колец для определения потенциальной реакционной способности и стереохимических результатов.[1]
Классы реакций, используемые в синтезе природных продуктов в рамках модели макроциклического стереоконтроля для получения желаемой стереохимии, включают: гидрирование, такое как неопельтолид [7] и (±) -метинолид,[8] эпоксидирование, такое как (±) -перипланон B[9] и лономицин А,[10] гидроборации, такие как 9-дигидроэритронолид B,[11] енолятные алкилы, такие как (±) -3-дезоксиросаранолид,[12] дигидроксилирование, такое как кладиелл-11-ен-3,6,7-триол,[13] и снижение, например, эвканнабинолида.[14]
Конформационные предпочтения
Макроциклы могут иметь доступ к ряду стабильных конформаций, с предпочтением оставаться в тех, которые минимизируют количество трансаннулярный несвязанные взаимодействия внутри кольца.[5] Средние кольца (8-11 атомов) являются наиболее напряженными с энергией деформации 9-13 (ккал / моль); Таким образом, анализ факторов, важных при рассмотрении более крупных макроциклических конформаций, можно смоделировать, рассматривая конформации среднего кольца.[15][страница нужна ] Конформационный анализ нечетных колец предполагает, что они имеют тенденцию находиться в менее симметричных формах с меньшими энергетическими различиями между стабильными конформациями.[16]
Циклооктан

Конформационный анализ средних колец начинается с исследования циклооктан. Спектроскопическими методами установлено, что циклооктан обладает тремя основными конформациями: кресло-лодка, стул-стул, и лодка-лодка. Циклооктан предпочитает находиться в конформации кресло-лодка, сводя к минимуму количество затмений. этан взаимодействия (показаны синим цветом), а также деформации скручивания.[17] Конформация стул-стул является второй по распространенности конформации при комнатной температуре с наблюдаемым соотношением кресло-лодка: кресло-стул.[1]
Позиционные предпочтения замещения в конформере основного состояния метилциклооктана могут быть аппроксимированы с использованием параметров, аналогичных параметрам для меньших колец. В общем, заместители проявляют предпочтение для экваториального размещения, за исключением самой низкоэнергетической структуры (псевдо-значение -0,3 ккал / моль на рисунке ниже), в которой предпочтительным является осевое замещение. «Псевдо-значение А» лучше всего трактовать как приблизительную разницу энергий между размещением метильного заместителя в экваториальном или аксиальном положениях. Наиболее энергетически невыгодное взаимодействие предполагает осевое замещение в вершине лодочной части кольца (6,1 ккал / моль).

Эти энергетические различия могут помочь рационализировать самые низкие энергетические конформации 8-атомных кольцевых структур, содержащих sp2 центр. В этих структурах кресло-лодка является моделью основного состояния, при этом замещение заставляет структуру принимать такую конформацию, что несвязанные взаимодействия минимизируются по сравнению с родительской структурой.[18] Из приведенного ниже рисунка циклооктена можно заметить, что одно лицо более открыто, чем другое, что предвещает обсуждение привилегированных углов атаки (см. Периферическая атака).

рентгеновский снимок анализ функционализированный циклооктаны подтвердили конформационные предпочтения этих средних колец. Примечательно, что расчетные модели соответствовали полученным рентгеновским данным, указывая на то, что компьютерное моделирование этих систем могло в некоторых случаях довольно точно предсказать конформации. Повышенная зр.2 Характер циклопропановых колец способствует тому, что они должны быть размещены подобным образом, чтобы они ослабляли несвязанные взаимодействия.[19]

Циклодекан

Подобно циклооктану, циклодекановое кольцо демонстрирует несколько конформаций с двумя конформациями с более низкой энергией. Конформация лодка-кресло-лодка энергетически минимизирована, в то время как конформация кресло-кресло-кресло имеет значительные затмевающие взаимодействия.
Эти конформационные предпочтения в основном состоянии являются полезными аналогиями с более высоко функционализированными макроциклическими кольцевыми системами, где локальные эффекты все еще могут управляться в первом приближении с помощью минимизированных по энергии конформаций, даже несмотря на то, что больший размер кольца обеспечивает большую конформационную гибкость всей структуры. Например, в метилциклодекане можно ожидать, что кольцо примет минимизированную форму лодочки-кресла-лодки. На рисунке ниже показан энергетический штраф между размещением метильной группы в определенных местах в структуре лодка-кресло-лодка. В отличие от канонических малых кольцевых систем, циклодекановая система с метильной группой, помещенной в «углы» структуры, не проявляет предпочтения аксиальному и экваториальному расположению из-за наличия неизбежного гош-бутан взаимодействие в обеих конформациях. Значительно более интенсивные взаимодействия развиваются, когда метильная группа размещается в аксиальном положении на других участках конформации лодка-кресло-лодка.[1]

Кольцевые системы большего размера
Подобные принципы определяют конформации более крупных кольцевых систем с наименьшей энергией. Наряду с принципами ациклического стереоконтроля, изложенными ниже, тонкие взаимодействия между удаленными заместителями в больших кольцах, аналогичные тем, которые наблюдаются для 8-10-членных колец, могут влиять на конформационные предпочтения молекулы. В сочетании с эффектами удаленных заместителей локальные ациклические взаимодействия также могут играть важную роль в определении исхода макроциклических реакций.[20] Конформационная гибкость более крупных колец потенциально позволяет сочетать ациклический и макроциклический стереоконтроль для прямых реакций.[20]

Реакционная способность и конформационные предпочтения
Стереохимический результат данной реакции в макроцикле, способном принимать несколько конформаций, может быть смоделирован с помощью сценария Куртина-Хэммета. На диаграмме ниже две конформации основного состояния существуют в состоянии равновесия с некоторой разницей в их энергиях основного состояния. Конформация B имеет более низкую энергию, чем конформация A, и, обладая подобным энергетическим барьером для ее переходного состояния в гипотетической реакции, таким образом, образовавшийся продукт является преимущественно продуктом B (P B), возникающим из конформации B через переходное состояние B (TS B). Врожденное предпочтение кольца существовать в одной конформации перед другой предоставляет инструмент для стереоселективный управление реакциями путем смещения кольца в заданную конфигурацию в основном состоянии. Энергетические разности ΔΔG‡ и ΔG0 являются важными соображениями в этом сценарии. Предпочтение одной конформации перед другой можно охарактеризовать величиной ΔG0, разность свободной энергии, которую на некотором уровне можно оценить с помощью конформационного анализа. Разность свободной энергии между двумя переходными состояниями каждой конформации на ее пути к образованию продукта определяется как ΔΔG‡. Значение ΔG0 между не только одной, но и многими доступными конформациями является основным энергетическим стимулом для реакций, происходящих из наиболее стабильной конформации основного состояния, и составляет суть модели периферической атаки, описанной ниже.[21]

Модель периферической атаки
Макроциклические кольца, содержащие sp2 центры демонстрируют конформационное предпочтение sp2 центры, чтобы избежать трансаннулярных несвязанных взаимодействий, ориентируясь перпендикулярно плану кольца. Кларк В. Стилл предположил, что основные состояния макроциклических колец, содержащие минимизированную по энергии ориентацию sp2 в центре, отобразите одну грань олефина наружу от кольца.[1][9][12] Таким образом, добавление реагентов с внешней стороны олефиновой поверхности и кольца (периферическая атака) является предпочтительным, в то время как атака через кольцо на внутреннюю диастерическую поверхность нежелательна. Конформации основного состояния диктуют открытую поверхность реактивного сайта макроцикла, поэтому необходимо учитывать как локальные, так и удаленные элементы стереоконтроля. Модель периферийной атаки хорошо работает для нескольких классов макроциклов, хотя и основывается на предположении, что геометрия основного состояния остается невозмущенной в соответствующем переходном состоянии реакции.
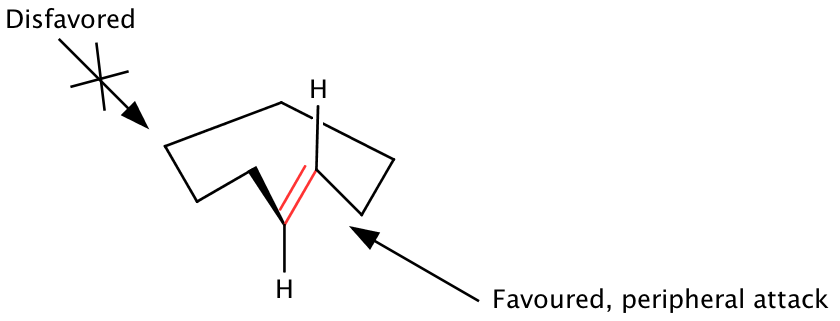
Межмолекулярные реакции
Ранние исследования макроциклического стереоконтроля изучали алкилирование 8-членных циклических кетонов с различным замещением.[1] В приведенном ниже примере происходит алкилирование 2-метилциклооктанона с образованием преимущественно транс-продукта. Исходя из конформации 2-метилциклоктанона с наименьшей энергией, периферическая атака наблюдается от любой из низкоэнергетических (энергетическая разница 0,5 (ккал / моль)) енолятных конформаций, что приводит к транс-продукту любой из двух изображенных конформаций переходного состояния. .[22]

В отличие от случая с циклооктаноном, алкилирование 2-циклодеканоновых колец не проявляет значительной диастереоселективности.[1]

Однако 10-членные циклические лактоны проявляют значительную диастереоселективность.[1] Близость метильной группы к сложноэфирной связи напрямую коррелировала с диастереомерным соотношением продуктов реакции, при этом размещение в положении 9 (ниже) давало наивысшую селективность. Напротив, когда метильная группа была помещена в положение 7, была получена смесь диастереомеров 1: 1. Размещение метильной группы в 9-положении в аксиальном положении дает наиболее стабильную конформацию основного состояния 10-членного кольца, ведущую к высокой диастереоселективности.

Добавление конъюгата к Е-енону, приведенному ниже, также следует модели ожидаемой периферической атаки с получением преимущественно транс-продукта.[22] Высокая избирательность в этой добавке может быть объяснена размещением зр.2 такие центры, что трансаннулярные несвязанные взаимодействия сводятся к минимуму, а также помещают метильное замещение в более энергетически выгодное положение для циклодекановых колец. Эта конформация в основном состоянии сильно смещает добавление конъюгата к менее затрудненному диастереофазу.

Внутримолекулярные реакции
Подобно межмолекулярным реакциям, внутримолекулярные реакции могут проявлять значительную стереоселективность в зависимости от конформации основного состояния молекулы. Во внутримолекулярной реакции Дильса-Альдера, изображенной ниже, конформация с наименьшей энергией дает наблюдаемый продукт.[23] Структура, минимизирующая отталкивающие стерические взаимодействия, обеспечивает наблюдаемый продукт, имея самый низкий барьер для переходного состояния для реакции. Хотя никакой внешней атаки со стороны реагента не происходит, эту реакцию можно рассматривать аналогично тем, которые моделируются с периферической атакой; конформация с наименьшей энергией с наибольшей вероятностью отреагирует на данную реакцию.

Конформации макроциклов с наименьшей энергией также влияют на внутримолекулярные реакции с образованием трансаннулярных связей. Во внутримолекулярной последовательности присоединения Михаэля ниже конформация основного состояния минимизирует трансаннулярные взаимодействия, помещая sp2 центрируется в соответствующих вершинах, а также сводится к минимуму диаксиальные взаимодействия.[24]

Выдающиеся примеры в синтезе
Эти принципы были применены к множеству мишеней из натуральных продуктов, содержащих средние и большие кольца. Синтезы кладиелл-11-ен-3,6,7-триола,[13] (±) -перипланон B,[9] эуканнабинолид,[14] и неопельтолид[7] все они важны в использовании макроциклического стереоконтроля на пути к достижению желаемых структурных целей.
Cladiell-11-ен-3,6,7-триол
Семейство кладиеллинов морских природных продуктов обладает интересной молекулярной архитектурой, обычно содержащей 9-членное кольцо среднего размера. Синтез (-) - кладиелла-6,11-диен-3-ола позволил получить доступ к множеству других членов семейства кладиеллинов. Примечательно, что преобразование в кладиелл-11-ен-3,6,7-триол использует макроциклический стереоконтроль в дигидроксилировании тризамещенного олефина. Ниже показана стадия синтеза, контролируемая конформацией основного состояния макроцикла, позволяющая стереоселективное дигидроксилирование без использования асимметричного реагента. Этот пример контролируемого добавления субстрата является примером модели периферической атаки, в которой два центра молекулы добавляются сразу двумя согласованным образом.

(±) -Перипланон В
Синтез (±) -перипланона B является ярким примером макроциклического стереоконтроля.[9] Перипланон B - это половой феромон американских самок тараканов, который был целью нескольких попыток синтеза. Примечательно, что две реакции на макроциклический предшественник (±) -перипланона B были направлены с использованием только конформационных предпочтений основного состояния и модели периферической атаки. Реагируя из наиболее стабильной конформации «лодка-кресло-лодка», асимметричное эпоксидирование цис-внутреннего олефина может быть достигнуто без использования метода эпоксидирования, управляемого реагентами, или направленного эпоксидирования аллиловым спиртом.

Эпоксидирование кетона, что может быть смоделировано периферической атакой илида серы на карбонильную группу в реакции Джонсона-Кори-Чайковского с получением защищенной формы (±) -перипланона B. Снятие защиты спирта с последующим окислением дает желаемый натуральный продукт.

Эвканнабинолид
В синтезе цитотоксического гермакранолида сесквитерпен-эвканнабинолида Стилл демонстрирует применение модели периферической атаки к восстановлению кетона, чтобы установить новый стереоцентр с использованием NaBH.4. Примечательно, что синтез эвканнабинолида основывался на использовании вычислительного моделирования молекулярной механики (MM2) для прогнозирования конформации макроцикла с наименьшей энергией для разработки стереохимических реакций, контролируемых субстратом.

Неопельтолид
Первоначально неопельтолид был выделен из губок у побережья Ямайки и проявляет наномолярную цитотоксическую активность против нескольких линий раковых клеток. Синтез макроциклического ядра неопельтолида демонстрирует гидрирование, контролируемое конформацией основного состояния макроцикла.

Критика
Модель периферийной атаки основана на предсказании низкоэнергетических конформаций изначально сложной системы, в которой тонкие возмущения могут вызвать огромные стереодифференцирующие последствия. Путем моделирования периферийной атаки с использованием сценария Куртина-Хэммета, описанного выше, переходное состояние исключается из этого анализа конформации, предполагая, что барьер для каждого переходного состояния из данной конформации одинаков, и, таким образом, конформации основного состояния являются единственным определяющим фактором продукта. . Существенная критика - отображение конформаций кольца среднего размера и влияний на более крупные кольцевые системы. Макроциклы могут обладать различной степенью жесткости в своей структуре, что затрудняет применение единой периферийной модели атаки ко всем системам. Различные классы реакций могут не соответствовать модели периферической атаки, поскольку такие реакции, как эпоксидирование, гидроксилирование, алкилирование и восстановление, все протекают через разные переходные состояния.[нужна цитата ]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час Тем не менее, W. C .; Галинкер, И. Тетраэдр 1981, 37, 3981-3996.
- ^ Дж. Д. Дуниц. Перспективы структурной химии (под редакцией Дж. Д. Дуница и Дж. А. Иберса), Vol. 2. С. 1–70; Уайли, Нью-Йорк (1968)
- ^ Anet, F. A. L .; Degen, P.J .; Явари. Я. J. Org. Chem. 1978, 43, 3021-3023.
- ^ Casarini, D .; Lunazzi, L .; Маццанти, А. Евро. J. Org. Chem. 2010, 2035-2056.
- ^ а б Каменик, Анна С .; Лессель, Ута; Fuchs, Julian E .; Фокс, Томас; Лидл, Клаус Р. (2018). «Пептидные макроциклы - конформационный отбор проб и термодинамическая характеристика». Журнал химической информации и моделирования. 58 (5): 982–992. Дои:10.1021 / acs.jcim.8b00097. ЧВК 5974701. PMID 29652495.
- ^ Эванс, Д. А .; Ripin, D.H.B .; Halstead, D.P .; Кампос, К. Варенье. Chem. Soc. 1999, 121, 6816-6826.
- ^ а б Вт, Вт .; Флорианциг, П.Э. Энгью. Chem. Int. Эд. 2009, 48, 4567-4571.
- ^ Ведейс, Э .; Buchanan, R.A .; Ватанабэ, Ю. Варенье. Chem. Soc. 1989, 111, 8430-8438.
- ^ а б c d Тем не менее, W.C. Варенье. Chem. Soc. 1979, 101, 2493-2495.
- ^ Evans, D.A .; Ratz, A.M .; Huff, B.E .; и Шеппард, Г.С. Варенье. Chem. Soc. 1995, 117, 3448-3467.
- ^ Mulzer, J .; Кирштейн, H.M .; Buschmann, J .; Lehmann, C .; Люгер, П. Варенье. Chem. Soc. 1991, 113, 910-923.
- ^ а б Тем не менее, W.C .; Новак, В. Варенье. Chem. Soc. 1984, 106, 1148-1149.
- ^ а б Kim, H .; Lee, H .; Kim, J .; Kim, S .; Ким, Д. Варенье. Chem. Soc. 2006, 128, 15851-15855.
- ^ а б Тем не менее, W.C .; Murata, S .; Revial, G .; Йошихара, К. Варенье. Chem. Soc. 1983, 105, 625-627.
- ^ Элиэль, Э.Л., Вилен, С.Х. и Мандер, Л. (1994) Стереохимия органических соединений, John Wiley and Sons, Inc., Нью-Йорк.[страница нужна ]
- ^ Anet, F.A.L .; Сен-Жак, М .; Хенрикс, П.М.; Cheng, A.K .; Krane, J .; Вонг, Л. Тетраэдр 1974, 30, 1629-1637.
- ^ Petasis, N.A .; Патане, М.А. Тетраэдр 1992, 48, 5757-5821.
- ^ Pawar, D.M .; Moody, E.M .; Ной, Э.А. J. Org. Chem. 1999, 64, 4586-4589.
- ^ Schreiber, S.L .; Smith, D. B .; Шульте, Г. J. Org. Chem. 1989, 54, 5994-5996.
- ^ а б Деслоншам, П. Pure Appl. Chem. 1992, 64, 1831-1847.
- ^ Симан, Дж. И. Chem. Ред. 1983, 83, 83-134.
- ^ а б «Классика в стереоселективном синтезе». Каррейра, Эрик М .; Кваэрно, Лисбет. Вайнхайм: Wiley-VCH, 2009. С. 1-16.
- ^ Деслоншам, П. Варенье. Chem. Soc. 2008,130, 13989-13995.
- ^ Scheerer, J.R .; Lawrence, J.F .; Wang, G.C .; Эванс, Д.А. Варенье. Chem. Soc. 2007, 129, 8968-8969.
