Нитрофенол - Nitrophenol
Нитрофенолы являются соединениями формулы HOC6ЧАС5-х(НЕТ2)Икс. Конъюгированные основания называются нитрофенолятами. Нитрофенолы более кислые, чем фенол сам.[1]
Мононитрофенолы
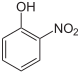 2-нитрофенол (о-) | |
 3-нитрофенол (м-) | |
4-нитрофенол (п-) | |
| Идентификаторы | |
|---|---|
| |
3D модель (JSmol ) | |
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| DrugBank |
|
| КЕГГ |
|
PubChem CID | |
| UNII |
|
| |
| |
| Характеристики | |
| C6ЧАС5NО3 | |
| Молярная масса | 139.110 г · моль−1 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
с формула HOC6ЧАС4НЕТ2. Три изомерный нитрофенолы существуют:
- о-Нитрофенол (2-нитрофенол; ОН и NO2 группы соседствуют; Номер CAS: 88-75-5), желтое кристаллическое твердое вещество (т.пл. 46 ° C).
- м-Нитрофенол (3-нитрофенол, номер CAS: 554-84-7), твердое вещество желтого цвета (точка плавления 97 ° C) и предшественник лекарственного средства. месалазин (5-аминосалициловая кислота).
- п-Нитрофенол (4-нитрофенол, номер CAS: 100-02-7), желтые кристаллы (т.пл. 114 ° C). Это предшественник рис гербицид фтордифен, пестицид паратион, и человеческий анальгетик парацетамол (также известный как ацетаминофен).
Мононитрированные фенолы часто гидрогенизированный к соответствующему аминофенолы которые также используются в промышленности.[1]
Ди- и тринитрофенолы

2,4-динитрофенол

пикриновая кислота
- 2,4-динитрофенол (т.пл. 83 ° C) представляет собой умеренно сильную кислоту (pKа = 4.89).
- 2,4,6-Тринитрофенол более известен как пикриновая кислота, имеющий хорошо развитую химию.
Безопасность
Нитрофенолы ядовиты. Иногда нитрофенолы загрязняют почву вблизи бывших фабрик по производству взрывчатых веществ, тканей и военных заводов, и текущие исследования направлены на восстановление.[2]
Рекомендации
- ^ а б Джеральд Бут (2007). «Нитросоединения ароматические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a17_411. ISBN 978-3527306732.
- ^ Информационный бюллетень на atsdr.cdc.gov
