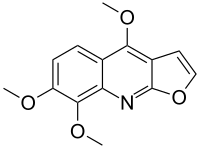
Скиммианин - Skimmianine
 | |
| Имена | |
|---|---|
| Название ИЮПАК 4,7,8-триметоксифуро [2,3-б] хинолин | |
| Другие имена Скиммианин; β-фагарин; Хлороксилонин | |
| Идентификаторы | |
3D модель (JSmol ) | |
PubChem CID | |
| UNII | |
| |
| Характеристики | |
| C14ЧАС13NО4 | |
| Молярная масса | 259.261 г · моль−1 |
| Температура плавления | 177 ° С (351 ° F, 450 К)[1] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Скиммианин это фурохинолиновый алкалоид нашел в Skimmia japonica, цветущее растение в семье Rutaceae родом из Японии и Китая. Это также сильный ацетилхолинэстераза (AChE) ингибитор.[2]
Биосинтез
Биосинтез скиммианина начинается с антраниловая кислота,[3] который очень распространен в семействе Rutaceae. Комбинируя ацетат антраниловой кислоты, антранилоил-КоА образуется в качестве исходного звена и может удлинять боковую цепь за счет добавления малонил-КоА посредством Клейзеновская конденсация. Затем в результате циклизации образуется лактам и образуется гетероциклическая система, в результате чего диенольный таутомер принимает таутомер 4-гидроксихинолона, который представляет собой 4-гидрокси-2-хинолон.
При образовании хинолона алкилирование происходит в положении C-3 путем введения диметилаллилдифосфата. Другой ключевой шаг - это циклизация боковой цепи диметилаллила с образованием нового гетероциклического пятичленного кольца.[4] Платидесмин затем образует промежуточное соединение в результате реакции окислительного расщепления.[5] теряя изопропильную группу с образованием диктамина. Наконец, скиммианин образуется в результате гидроксилирования диктамина.

Рекомендации
- ^ «Химическая панель». comptox.epa.gov. Получено 2019-06-10.
- ^ Ян, Чжун-дуэт; Чжан, Дун-бо; Рен, Джин; Ян, Мин-цзюнь (2012). «Скиммианин, алкалоид фурохинолина из Zanthoxylum nitidum как потенциальный ингибитор ацетилхолинэстеразы». Медицинские химические исследования. 21 (6): 722–725. Дои:10.1007 / s00044-011-9581-9.
- ^ «Соединения, полученные из антраниловой кислоты». Алкалоиды. 2015. С. 163–180. Дои:10.1016 / B978-0-12-417302-6.00009-X. ISBN 9780124173026.
- ^ Манске, Р. Х. (1960). Алкалоиды: химия и физиология. Нью-Йорк: Academic Press.
- ^ Guengerich, F. Peter; Ёсимото, Фрэнсис К. (2018). «Образование и расщепление связей C – C с помощью ферментативных реакций окисления – восстановления». Химические обзоры. 118 (14): 6573–6655. Дои:10.1021 / acs.chemrev.8b00031. ЧВК 6339258.
