Ультрасонография опухолей печени - Википедия - Ultrasonography of liver tumors
Эта статья нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Август 2020 г.) |
| Ультрасонография опухолей печени | |
|---|---|
| Цель | обнаружение и характеристика опухолей печени |
Ультрасонография опухолей печени включает два этапа: обнаружение и определение характеристик.[нужна цитата ]
Обнаружение опухоли основано на характеристиках метода и должно включать морфометрическую информацию (измерения по трем осям, объем) и топографическую информацию (число, местоположение, определяющее сегмент печени и долю / доли). Уточнение этих данных важно для определения стадии опухолей печени и прогноза.[нужна цитата ]
Характеристика опухоли - это сложный процесс, основанный на совокупности критериев, ведущих к определению природы опухоли. Часто в других диагностических процедурах, особенно интервенционных, отпадает необходимость. Характеристика опухоли с помощью УЗИ метод будет основан на следующих элементах: консистенция (твердое, жидкое, смешанное), эхогенность, внешний вид структуры (однородный или неоднородный), разграничение от прилегающей паренхимы печени (капсульная, неточная), эластичность, задний акустический усиливающий эффект, связь с соседними органами или структурами (смещение, инвазия), сосудистая сеть (наличие и характеристики на Допплерография и УЗИ с контрастным усилением (CEUS).[нужна цитата ]
Также добавляются субстрат, на котором развивается опухолевое состояние (если печень в норме или есть признаки диффузного заболевания печени) и развивающийся контекст (онкология, сепсис). Особое внимание стоит уделить анализу кровеносного русла. Исследование микроциркуляции позволяет различать доброкачественные и злокачественные опухоли. Характерными элементами злокачественного кровообращения являются плотность сосудов, наличие сосудов с неправильным ходом и размером, некоторые из них сообщаются между собой, некоторые другие блокируются, в конце концов, с появлением «пальца перчатки», наличие артерио-артериальных и артериовенозных шунтов, отсутствие или несостоятельность артериальный прекапиллярный сфинктер, состоящий из гладкой мускулатуры.[нужна цитата ]Диагностика и характеристика опухолей печени требуют индивидуального подхода к каждой группе состояний с использованием доступных процедур, описанных выше для каждого из них. Корреляция с историей болезни, клиническим и функциональным (биохимическим и гематологическим) статусом пациента являются важными элементами, которые также следует учитывать.[нужна цитата ]
Доброкачественные опухоли печени
Доброкачественный опухоли печени обычно развиваются на нормальной или жировой печени, являются одиночными или множественными (как правило, околоплазматическими), имеют четкие очертания, с повышенной эхогенностью (гемангиомы, доброкачественные узловые гиперплазии) или отсутствуют, с эффектом усиления заднего слуха (кисты), имеют отчетливые очертания (эхинококковая киста), отсутствие васкуляризации или характерный паттерн кровообращения, смещение нормальных структур печени и даже соседних органов (в случае больших размеров), достаточно эластичны и не проникают в сосуды печени. Общий статус у пациента хороший, опухоли часто протекают бессимптомно, случайно обнаруживаются.[нужна цитата ]
Кисты печени
Они могут быть одиночными или множественными, различного размера, как правило, менее 20 мм (врожденные). В редких случаях размеры могут достигать нескольких сантиметров, что приводит к замещению всей доли печени (приобретенное, паразитарное). Они могут быть связаны с кистами почек; в этом случае заболевание передается по наследственному аутосомно-доминантному типу (болезнь фон Гиппеля-Линдау).[нужна цитата ]
Ультразвуковое исследование представляет собой четко очерченное поражение с очень тонкими, почти незаметными стенками, без сигнала кровообращения при допплеровском исследовании или исследовании CEUS. Контрастное содержание предполагает состав жидкости. Наличие мембран, обильных осадочных кист внутри свидетельствует о паразитарном эхинококкозе. Сзади от поражения наблюдается феномен усиления звука, который усиливает подозрение на флюидмассу. Обычно они замещают нормальные сосуды печени, но не инвазии сосудов или желчных путей.[нужна цитата ]
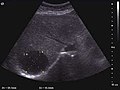
Киста печени[нужна цитата ]
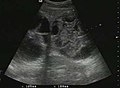
Эхинококковая киста печени. Диагностические критерии - наличие плодных оболочек и осадка внутри.[нужна цитата ]
Гемангиома


Это самая распространенная опухоль печени с распространенностью 0,4-7,4%. Обычно он протекает бессимптомно, но также может быть связан с жалобами на боль или цитопенией и / илиранемией, если он очень объемный. Он уникальный или полупрозрачный. Это может быть связано с другими типами доброкачественных опухолей печени. Характерным проявлением 2D-ультразвука является появление очень четко очерченного очага размером 2–3 см или менее, демонстрирующего повышенную эхогенность и, когда оно находится в контакте с диафрагмой, можно увидеть явление «зеркального отображения». При пальпации печени датчиком гемангиома сжимается, что приводит к обратному развитию. Доплеровское исследование не выявляет циркуляционного сигнала из-за очень низкой скорости потока. Исследование CEUS имеет реальную диагностическую ценность из-за типичного поведения прогрессирующего усиления CA опухоли от периферии к центру. Улучшение происходит медленно, в течение нескольких минут, в зависимости от размера гемангиомы и наличия (или отсутствия) внутреннего тромбоза. Во время поздней (синусоидальной) фазы, если она полностью «заполнена» КА, гемангиома кажется изоэхогенной печени. Отклонения от описанного выше поведения могут возникать при артериальных гемангиомах или гемангиомах, содержащих артериовенозные шунты. В этих случаях дифференциация от злокачественной опухоли затруднена и требует других процедур визуализации, наблюдения и измерения опухоли в короткие промежутки времени.[1]
Очаговая узловая гиперплазия

Это опухоль, развивающаяся вторично по отношению к нарушению кровообращения с обильными артериальными сосудами, имеющими характерное расположение в центре опухоли, внутри фиброзного рубца. С этого уровня развивается сеть арадиальных сосудов с периферической ориентацией. Кровеносное русло опухоли богато элементами микроциркуляции и воротной вены. Заболеваемость выше у молодых женщин, и развитие опухоли ускоряется при приеме оральных контрацептивов. Ультразвуковой 2D-вид представляет собой довольно четко определенную массу с переменными размерами, обычно цельную твердую консистенцию с неоднородной структурой. Редко можно выделить центральный рубец. Спектральная допплерография выявляет центральные артериальные сосуды, а CFM-исследование выявляет их радиальное положение. Обследование CEUS показывает центральное наполнение кровеносного русла опухолью во время артериальной фазы и полное усиление во время фазы воротной вены. Во время этой фазы центр поражения становится гипоэхогенным, увеличивая опухоль. На поздней стадии опухоль остается изоэхогенной печени, что усиливает диагноз доброкачественного поражения.[нужна цитата ]
Аденома
Это доброкачественная опухоль, состоящая из нормальных или атипичных гепатоцитов. Заболеваемость составляет 0,03%. Его развитие индуцируется приемом анаболических гормонов и оральных контрацептивов. Опухоль бессимптомна, но может быть связана с болью в правом подреберье в случае внутреннего кровотечения. 2D-УЗИ показывает четко выраженную твердую массу без капсулы. При внутриопухолевом кровотечении он может иметь неоднородную структуру. При допплеровском обследовании нет сигнала кровообращения. Исследование CEUS довольно неоднозначно и не всегда может установить дифференциальный диагноз с гепатоцеллюлярной карциномой. Таким образом, во время артериальной фазы происходит центростремительное и неоднородное усиление. Во время фазы воротной вены происходит умеренное вымывание. На поздней стадии вид является изоэхогенным или гипоэхогенным из-за отсутствия клеток Купфера.[нужна цитата ]
Злокачественные опухоли печени
Злокачественные опухоли печени развиваются при циррозе печени (гепатоцеллюлярная карцинома, ГЦК) или нормальной печени (метастазы). Они бывают единичными или множественными (особенно метастазы), имеют различные, как правило, неточные очертания, могут иметь очень выраженный циркуляторный сигнал (гепатоцеллюлярная карцинома и некоторые типы метастазов), иметь гетерогенную структуру (результат внутриопухолевых нарушений кровообращения, последствие кровотечения или некроз) и твердые на ощупь, даже жесткие. Общее состояние пациента коррелирует с основным заболеванием (сосудистая и паренхиматозная декомпенсация цирроза печени, потеря веса, отсутствие аппетита и анемия с раком).[нужна цитата ]
Гепатоцеллюлярная карцинома (ГЦК)
Это наиболее распространенное злокачественное новообразование печени. У него развивается вторичный тоцирроз, поэтому ультразвуковое исследование каждые 6 месяцев в сочетании с определением альфа-фетопротеина (AFP) является эффективным методом раннего выявления и мониторинга лечения этого типа опухоли. Клинически ГЦК частично совпадает с прогрессирующим циррозом печени (длительное развитие, повторяющаяся сосудистая и паренхиматозная декомпенсация, иногда кровотечение из-за утечки из варикозно расширенных вен) в дополнение к ускоренной потере веса в недавнем прошлом и отсутствию аппетита.[нужна цитата ]

ГЦР на 2D-УЗИ выглядит как солидная опухоль с неточными очертаниями, с гетерогенной структурой, одно- или многоячеистой (энцефалоидной формы). Описан также «инфильтративный» тип, который трудно отличить от узловой реконструкции печени при циррозе. Обычно ГЦК поражает сосуды печени, в первую очередь воротные вены, но также и печеночные вены. Допплеровское исследование обнаруживает высокую скорость артериального кровотока и низкий индекс импеданса (коррелирует с описанными изменениями в ангиогенезе опухоли). Пространственное расположение сосудов неправильное, беспорядочное. Обследование CEUS показывает усиление очага поражения во время артериальной фазы. Во время фазы воротной вены происходит специфическое «вымывание» ультразвукового контрастного вещества (UCA), и опухоль кажется гипоэхогенной на поздней стадии. Плохо дифференцированные опухоли могут иметь более сильный вымывание, что приводит к изоэхогенному виду паренхимы печени во время фазы воротной вены. Этот внешний вид был обнаружен ок. 30% случаев. Описанные изменения имеют диагностическое значение при узелках печени размером более 2 см.[нужна цитата ]
Ультразвук полезен для обнаружения, стадиализации и оценки терапевтической эффективности ГЦК. Что касается стадийности, связанной с эффективностью терапии, используется Барселонская классификация, которая выделяет пять стадий ГЦК. Лечебная терапия показана на ранних стадиях, которые включают очень раннюю стадию (одиночный узелок <2 см), излечимую хирургической резекцией (выживаемость 50-70% через пять лет после хирургической резекции) и раннюю стадию (единичный узелок 2-5 см или больше). до 3 узелков <3 см), которые можно лечить с помощью радиочастотной абляции (РЧА) и трансплантации печени. На промежуточной стадии (полинодулярная, без портальной инвазии) и на продвинутой стадии (N1, M1, с портальной инвазией) проводится паллиативная терапия (ТАСЕ и системная терапия сорафенибом), а на конечной стадии применяется только симптоматическая терапия.[нужна цитата ]
Холангиокарцинома
Развивается на нецирротической печени. На УЗИ 2D вид нехарактерен - сплошная масса с неоднородной структурой, плохо очерченная, часто с периферическим расположением и слабым сигналом допплеровской циркуляции. Обследование CEUS выявляет умеренное усиление периферии опухоли во время артериальной фазы с последующим вымыванием во время фазы воротной вены и гипоэхогенным проявлением в поздней фазе.[нужна цитата ]
Метастазы в печени
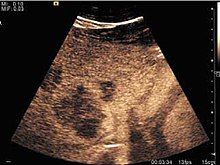

УЗИ необходимо для выявления метастазов в печени у пациентов с онкологическим анамнезом. Кроме того, метод может случайно обнаружить метастазы у бессимптомных пациентов. Раннее выявление (небольшие размеры, небольшое количество) важно для выбора оптимального курса лечения, который может быть сложным (химиотерапия, радиочастотная абляция, хирургическое вмешательство), но приветствуется. Кроме того, различение синхронных поражений, имеющих различную природу, также важно, зная, что до 25–50% поражений печени менее 2 см, обнаруженных у онкологических больных, могут быть доброкачественными. Чувствительность УЗИ для выявления метастазов варьируется в зависимости от опыта врача и используемого оборудования и составляет от 40 до 80%. Чувствительность определяется размером и акустическим сопротивлением узелков. Для диаметра поражения менее 10 мм точность УЗИ значительно снижается, достигая прибл. 20%. Другими элементами, способствующими снижению эффективности УЗИ, являются: чрезмерное ожирение, жировая болезнь печени, гипомобильность диафрагмы и определенные паттерны гиперэхогенных или изоэхогенных метастазов, которые можно не заметить или которые могут имитировать доброкачественные состояния. При обычном УЗИ появление метастазов нехарактерно, они состоят из очерченных очагов поражения с четкими, неточными или «ореоловыми» очертаниями, с однородной или гетерогенной эхосигналом. Они могут быть единичными (часто метастазы в печень из новообразования толстой кишки) или множественными. Эхогенность вариабельна. При увеличении они могут сдавливать желчевыводящие пути (которые могут быть расширены) и сосуды печени. Поражение печени может быть сегментарным, долевым или генерализованным. В этой ситуации возникает выраженная гепатомегалия. Как правило, метастазы имеют не характерный допплеровский сосудистый рисунок, за редким исключением (карциноидные метастазы). Метастазы кисты-аденокарциномы из-за полужидкого содержимого могут иметь атранзональный вид. При увеличении они могут привести к центральному некрозу. Исследование CEUS - это настоящий прорыв в обнаружении и характеристике метастазов в печени.[нужна цитата ]
Повышенная производительность основана на выявлении специфических сосудистых паттернов во время артериальной фазы и обнаружении метастазов в отличие от нормальной паренхимы печени во время синусоидальной фазы. Повышенная точность CEUS обусловлена различным поведением нормальной паренхимы печени (захват CA в клетках Куппфера) в отношении паренхимы опухоли (не содержит клеток Куппфера, поэтому вид CEUS является гипоэхогенным). К этому добавляются особенности внутриопухолевой циркуляции, представленные уменьшенным артериальным руслом по сравнению с окружающей нормальной печенью и отсутствием портальных сосудов. С точки зрения васкулярности метастазы могут быть гиповаскулярными (в аденокарциномах желудка, толстой кишки, поджелудочной железы или яичников) с гипоэхогенным характером во время артериальной фазы и подобными во время портальной и поздней фаз, соответственно, гиперваскулярными (нейроэндокринные опухоли, злокачественная меланома, саркомы, опухоли почек, груди или щитовидной железы). с гиперэхогенным проявлением во время артериальной фазы, с вымыванием во время фазы воротной вены и гипоэхогенным характером через 30 секунд после инъекции.[нужна цитата ]
Используя исследование CEUS для обнаружения метастазов, достигается чувствительность 80–95%, аналогичная чувствительности контрастной КТ и МРТ. Интраоперационное использование процедуры увеличивает ее эффективность, даже если она не имеет решающего значения для изменения терапевтического поведения. Ограничения метода связаны с проникновением в УЗИ (выраженная жировая болезнь печени, глубокие поражения, чрезмерное ожирение) и с опытом исследователя. К этому добавляется риск путаницы между гиперваскулярными метастазами, гепатоцеллюлярной карциномой и гемангиомой, а также путаница между гиповаскулярными метастазами и небольшими кистами печени. Регулярное использование CEUS для выявления метастазов в печени рекомендуется, когда обычное УЗИ не дает окончательных результатов, когда необходима точная информация о некоторых травмах (количество, расположение) в сочетании с контрастной КТ / МРТ, а также для оценки эффективности лечения при использовании антиангиогенной терапии гиперваскулярной терапии. метастазы. Метод не может заменить обследования КТ / МРТ, у которых есть устоявшиеся показания в онкологии.
Псевдоопухоли и воспалительные образования печени
Помимо перечисленных выше образований, могут возникать воспалительные образования или даже псевдо-образования. Их диагноз довольно сложен, а критерии, используемые для дифференциации, часто недостаточны, требуя морфологических диагностических процедур, использования других методов диагностической визуализации или время от времени переоценки пациента. Сюда входят поражения, возникшие при реконструкции печени и паренхимы, как это происходит при циррозе, накоплении стеатоза или в случае острых или хронических воспалительных заболеваний.[нужна цитата ]
Фокальный стеатоз
Он состоит из локального скопления богатых жиром клеток печени. В некоторых случаях это скопление может имитировать опухоль печени. Иногда наблюдается обратное явление - «островок» нормальной паренхимы в «сияющей» печени. В обоих случаях ультразвуковое исследование выявляет хорошо очерченную, неинкапсулированную область с эхоструктурой и сосудистой сетью, аналогичными нормальным паренхимам печени. Поражение может иметь разные формы, в большинстве случаев овальные и расположенные в IV сегменте кпереди от ворот печени. Это происходит у пациентов с дислипидемией или алкоголем с нормальным физическим и биологическим статусом. Доброкачественный диагноз подтверждается с помощью исследования CEUS, которое подтверждает нормальное кровеносное русло, аналогичное прилегающей паренхиме печени на всех трех этапах исследования.[нужна цитата ]
Абсцесс печени

Абсцесс печени имеет гетероморфный ультразвуковой вид, наиболее типичным является абсцесс неправильной формы, бахромчатый, с жидким или полужидким содержимым, с воздухом внутри или без него. Допплеровское исследование показывает отсутствие сосудов внутри поражения. Исследование CEUS показывает усиление артериальной фазы рядом с поражением, что указывает на гиперемию печени и паренхимы. Во время венозной и синусоидальной фаз картина гипоэхогенная, а центральная жидкость усилена контрастом. Исследование CEUS полезно, поскольку оно подтверждает клиническое подозрение на абсцесс. Кроме того, он позволяет точно измерить размер скопления и определить его топографию внутри печени (доля, сегмент).[нужна цитата ]
Пренеопластический статус. Мониторинг цирроза печени
Цирротическая печень характеризуется наличием узелков разного размера и степени развития, поэтому регенеративные узелки, диспластические узелки и даже ранняя гепатоцеллюлярная карцинома могут сосуществовать в какой-то момент во время прогрессирования заболевания. Существуют исследования, показывающие, что от 59 до 94% вновь диагностированных узелков в печени у пациентов с циррозом имеют злокачественную гистологию и до 50% гиперэхогенных поражений с ультразвуковым проявлением гемангиомы, в конечном итоге, оказывается гепатоцеллюлярной карциномой. Таким образом, современная практика во многих центрах считает, что любое новое поражение, обнаруженное у пациента с циррозом печени, следует рассматривать как злокачественное, пока не будет доказано иное. Выделяют три категории узловых узлов цирроза печени: регенеративные, диспластические (рассматриваемые как предраковые состояния) и опухолевые (ГЦК).[нужна цитата ]
Регенеративные узелки (РН)

Эти поражения четко очерчены, имеют изоэхогенный или гипоэхогенный вид и имеют размер менее 1 см. Они многочисленны и имеют более или менее равномерное распределение, охватывая все сегменты печени. Они могут скапливаться, приводя к большим псевдоопухолям. При допплеровском исследовании эти узелки не имеют сигнала кровообращения. Исследование CEUS показано, когда узелок отличается от общей картины реструктурированной печени либо по разной эхогенности, либо по размеру, чем большинство узелков. Во время артериальной фазы сигнал слабый или отсутствует. Во время портальной венозной и поздней фазы внешний вид постоянно изоэхогенный.[нужна цитата ]
Обычно РН неотличима от окружающей паренхимы. Обследование CEUS полезно для исключения активного поражения в момент обследования, но не имеет абсолютной прогностической ценности; поэтому пациента следует периодически осматривать через короткие промежутки времени. Требуется корреляция с клиническим статусом и измерениями АФП.[нужна цитата ]
Диспластические узелки (DN)

Эти поражения имеют различную структуру (гипо- или гиперэхогенную) и имеют диаметр не менее 1 см. Это гепатоциты с диспластическими изменениями, но без четких формальных гистологических критериев. Они подразделяются на диспластические узелки низкой степени, где клеточная атипия - это легкая, и диспластические узелки высокой степени с умеренной или тяжелой клеточной атипией, но без каких-либо установленных признаков злокачественности. Иногда хорошо дифференцированные очаги ГЦК можно идентифицировать в диспластических узлах высокой степени (внешний вид называется «узелок в узелке»). Большинство авторов принимают процесс канцерогенеза как прогрессирующую трансформацию DN от низкой степени злокачественности к высокой и в HCC. Сосудистая сеть узелка прогрессивно изменяется, что коррелирует со степенью злокачественности, и характеризуется уменьшением до отсутствия входа в воротную вену и увеличением артериального входа в опухоль. Новообразование сосудов происходит при нарастании степени дисплазии. Артериальная неоваскуляризация усиливается хаотическим и взрывным образом, в то время как нормальная, артериальная и портальная сосудистая сеть продолжает снижаться. Диспластические узелки высокой степени гиповаскуляризированы как в артериальной, так и в портальной фазах, в то время как ранние узелки ГЦК могут иметь сходный артериальный паттерн с окружающей паренхимой или обостряться, а также портальная гиповаскуляризация. При умеренном или низкодифференцированном ГЦК (классический ГЦК) питание опухоли осуществляется только за счет сосудов новообразования (обильные ), нормальная артериальная и портальная сеть полностью исчезают. Такое поведение внутриопухолевой васкуляризации типично для ГЦК и является ключом к диагностике с помощью изображений.[нужна цитата ]
Ультрасонография в B-режиме не позволяет различить регенеративные узелки и пограничные поражения, такие как диспластические узелки и даже ранний ГЦК. Допплерография также имеет низкую чувствительность в дифференциации диспластических узлов от ранней стадии ГЦК. Доплеросигнал может отсутствовать как в регенеративных, так и в диспластических узлах. Некоторые авторы указывают на наличие допплеровского потока венозного типа, который отражает питание воротной вены узла, как характерную черту диспластических узелков и раннего ГЦК (Minami & Kudo, 2010). Другие авторы отметили наличие артериального кровотока с небольшими вариациями частоты и нормальным индексом удельного сопротивления. При исследовании CEUS и RN, и DN могут иметь довольно вариабельный характер усиления. Как правило, оба узелка усиливаются идентично окружающей паренхиме печени после инъекции УКА. Диспластические узелки гиповаскулярны в артериальной фазе. В случае высокоградиентного диспластического узелка иногда может быть обнаружена гиперваскуляризация, но без ассоциированного «вымывания» во время портальной и поздней фаз CEUS. В этих случаях биопсия может уточнить диагноз.[нужна цитата ]
Ранняя гепатоцеллюлярная карцинома (Ранняя ГЦК)
При двумерном ультразвуковом исследовании можно предположить, что ранняя стадия ГЦК представляет собой гипоэхогенный узелок с отчетливым рисунком, развивающийся на циррозе печени. Гипоэхогенный вид характерен для умеренного / низкодифференцированного ГЦК с низкими жировыми изменениями или их отсутствием. В редких случаях ГЦК может выглядеть изоэхогенным, состоять из опухоли с более высокой степенью дифференцировки и, следовательно, с более медленным развитием. Другой распространенный аспект - это появление «светлой петли» или «узелка в узелке», гипоэхогенных узелков в гиперэхогенной опухоли.[нужна цитата ]
Спектральные допплеровские характеристики раннего ГЦК перекрывают характеристики диспластического узла, поскольку они представлены наличием типа сигнала портальной вены или артериального типа с нормальным RI (хорошо дифференцированный HCC) или повышенным RI (умеренно или плохо дифференцированный HCC). Исследование CFM выявляет хаотический узор сосудов.[нужна цитата ]
При исследовании CEUS ранний ГЦК имеет изо- или гиперваскулярный вид во время артериальной фазы с последующим вымыванием во время портальной венозной и поздней фазы. Есть исследования, показывающие, что процесс вымывания напрямую коррелирует с размером и особенностями кровеносного русла опухоли. Таким образом, высокодифференцированный ГЦК иллюстрирует феномен позднего или даже очень позднего «вымывания», в то время как низкодифференцированный ГЦК имеет ускоренное вымывание в конце артериальной фазы. Поэтому обязательно проанализировать все эти три фазы исследования CEUS для правильной характеристики узелков печени. Промывание опухоли в конце артериальной фазы позволяет поставить диагноз ГЦК с предсказуемостью 89,5%. Некоторые авторы считают, что раннее выраженное усиление контраста узелка в пределах 1-2 см, образовавшегося на циррозе печени, является достаточным для диагностики ГЦК. Эти результаты доказывают, что для правильной характеристики поражений необходимо продлить время исследования до 5 минут или даже дольше.[нужна цитата ]
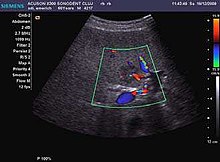

Значение ультразвука в «скрининге» ГЦК
Базовое 2D УЗИ играет важную роль в программах наблюдения за пациентами с риском развития ГЦК. Обследование имеет приемлемую чувствительность, которая увеличивается с увеличением размера опухоли. Чувствительность варьируется от 42% для очагов <1 см до 95% для опухолей размером более 1 см, а специфичность может достигать 90%. Оптимальный интервал времени для ультразвукового скрининга популяции «из группы риска» составляет 6 месяцев, поскольку он является результатом клинических испытаний, в которых изучали время удвоения размера опухоли (Bruix, 2005; Maruyama et al., 2008). Для недавно развившегося узелка будут приняты во внимание критерии размеров. Таким образом, для узелка размером менее 10 мм пациент будет повторно оцениваться с помощью ультразвука каждые 3 месяца, так как тенденция роста является показанием для завершения исследований с другими диагностическими методами. процедуры; при размере от 10 до 20 мм необходимы две согласованные процедуры визуализации, при необходимости дополняемые биопсией под ультразвуковым контролем; при размере более 20 мм для положительной диагностики достаточно одного метода динамической визуализации с характерным внешним видом. В неопределенных случаях следует выполнить дополнительные методы динамической визуализации или биопсию. Когда доплеровского исследования недостаточно, проводится CEUS-исследование.Всегда следует помнить о риске получения ложноположительных результатов при ГЦК в случае холангиокарциномы, поэтому следует рассмотреть возможность дополнительных диагностических процедур.[нужна цитата ]
Эффективность программ скрининга подтверждается увеличением частоты выявления ГЦК <2 см (с <5% в 90-е годы в Европе до> 30% сегодня в Японии) с помощью вариантов лечебной терапии. Основная проблема ультразвукового скрининга заключается в том, что для обеспечения рентабельности его следует применять к населению в целом, а не в больницах третичного уровня. Это повышает важность части ультразвукового обследования, зависящей от оператора и оборудования. Эффективность такой программы связана с функциональной паренхимой всего тела пациента с циррозом печени. Поэтому некоторые авторы утверждают, что скрининг должен быть исключен у пациентов с этиологией, препятствующей лечению, или у пациентов с запущенным заболеванием печени (класс C по шкале Чайлд-Пью).[нужна цитата ]
После лечебных процедур (хирургическая резекция, местная абляционная терапия) рекомендуется продолжить ультразвуковой скрининг сначала через 1 месяц, а затем через 3 месяца после терапии для оценки эффективности терапии и выявления других узелков.[нужна цитата ]
Противоопухолевые методы лечения
Ультразвуковое исследование может быть эффективной процедурой для оценки реакции опухоли печени на лечение. На протяжении многих лет рассматривались разные критерии оценки эффективности лечебной или паллиативной терапии. Теперь доказано, что степень некроза опухоли не коррелирует с диаметром опухоли, поэтому простого измерения диаметра опухоли (критерии RECIST) недостаточно для оценки терапии.[нужна цитата ]
В настоящее время местный ответ на лечение сосредоточен на некрозе опухоли, диагностированном с помощью методов контрастной динамической визуализации и распознаваемом по наличию внутриопухолевых неусиленных участков. Местный ответ на лечение определяется как:[нужна цитата ]а. полный ответ, определяемый как полное исчезновение всех известных поражений (отсутствие участков с повышенной опухолью, что отражает общий некроз опухоли) и отсутствие других новых поражений, определяемое двумя наблюдениями с интервалом не менее 4 недель; b. частичный ответ, определяемый как уменьшение общего увеличения опухоли более чем на 50% во всех поддающихся измерению поражениях, определяемый двумя наблюдениями с интервалом не менее 4 недельc. стабильное заболевание (не описывается буквами a, b или d) d. прогрессирующее заболевание, определяемое как увеличение на 25% размера одного или нескольких поддающихся измерению очагов или появление новых очагов поражения.
Методики оценки эффективности терапии
Эффективность 2D-ультразвука при оценке эффектов ГЦК или терапии метастазов низка, так как он не может отличить жизнеспособную опухолевую ткань от посттерапевтического некроза опухоли.[нужна цитата ]
Тем не менее, он способен обнаруживать появление новых поражений и оценивать возникновение любых осложнений прогрессирования заболевания (асцит или тромбоз воротной вены). Цветной допплеровский ультразвук может быть полезен иногда, поскольку он может показать наличие внутриопухолевого сосудистого русла как признак неполного лечения или внутриопухолевого рецидива. Отсутствие допплеровского сигнала не исключает наличия жизнеспособной опухолевой ткани. Исследование CEUS, благодаря своей способности усиливать микроциркуляцию внутри очага поражения, доказало свою полезность для мониторинга терапевтической эффективности. Его показания определены для абляционного лечения ГЦК (до, во время и после терапии), в то время как мониторинг системного лечения ГЦК и метастазов в настоящее время не является подтвержденным показанием, но с доказанной эффективностью в обширных клинических испытаниях (Claudon et al., 2008). Исследование CEUS не может полностью заменить другие методы визуализации и диагностики, используемые в настоящее время из-за известных ограничений ультразвукового метода (зависит от оператора / оборудования, ограничения ультразвукового исследования). Помимо вздутия живота, у онкологических больных возникает стеатоз после лечения, который препятствует глубокой видимости. Спиральная компьютерная томография остается методом выбора при мониторинге терапии рака, поскольку она обеспечивает обзор распространения опухоли и не ограничивается вздутием живота или стеатозом.[нужна цитата ]
МРТ с гадолинием - процедура, которая используется все чаще и чаще, и ее преимущества заключаются в отсутствии облучения и высокой чувствительности при обнаружении сосудистой сети опухоли, особенно в небольших опухолях. Однако это остается дорогой и не очень доступной процедурой, хотя и имеет высокую специфичность. В настоящее время CEUS и МРТ считаются дополнительными методами к компьютерной томографии.[нужна цитата ]
Абляционная терапия с ультразвуковым контролем (алкоголизация - PEI, радиочастотная абляция - RFA)
Абляционная терапия считается лечебным лечением ГЦК вместе с хирургическим рассечением и трансплантацией печени и показана на ранних стадиях опухоли у пациентов с хорошей функцией печени. Также они успешно применяются при лечении метастазов в печень, где хирургическая резекция противопоказана. Они бывают химическими (внутриопухолевое введение этанола) или термическими (радиочастотная, лазерная или микроволновая абляция). Их применяют для получения полноценного терапевтического эффекта, не влияя на функцию печени. Полный ответ локально подтверждается полным некрозом опухоли с запасом прочности вокруг опухоли.[нужна цитата ]
2D-ультразвук, допплеровский ультразвук и особенно CEUS могут играть важную роль в предтерапевтических стадиях, особенно когда исследования с использованием секционных изображений (КТ, МРТ) дают неопределенные результаты или противопоказаны. Во время интервенционной процедуры ультразвук позволяет ввести иглу в опухоль. CEUS позволяет направлять в области жизнеспособных тканей и избегать участков некроза внутри опухоли. CEUS также позволяет оценить терапевтический эффект сразу после процедуры (с возможностью повторного вмешательства в случае частичного ответа). Для точной оценки эффективности лечения обязательно перед терапией сравнить диаметр опухоли с площадью абляции. Объем поврежденной ткани должен быть больше исходного объема опухоли. Внешний вид CEUS - это центральная неусиленная область, показывающая периферический однородный гиперусиленный край из-за постоперационного воспаления. Через 24 часа после процедуры воспалительный периферический край истончается, а некротическая область кажется больше, чем при предыдущем обследовании. Таким образом, возможная остаточная опухоль может казаться более очевидной. Остаточная опухоль имеет плохо очерченные края, неправильную форму, диаметр опухоли не изменился. Остаточная ткань опухоли проявляется на периферии опухоли в виде эксцентрической области, которая ведет себя как исходная опухоль при обследовании CEUS, с усилением артериального давления, воротной и поздней промывкой. Ультразвуковое исследование через 24 часа после процедуры, включая КЭУЗИ, может выявить, помимо характера поражения, любые возможные постоперационные осложнения (например, активное кровотечение).[нужна цитата ]
В первые дни после РЧА как CEUS, так и спиральная компьютерная томография имеют низкую чувствительность при оценке терапевтической эффективности. Сообщается, что чувствительность КТ через 24 часа после терапии даже ниже, чем у CEUS. Трудности при исследовании CEUS возникают из-за гиперемии после поражения, наличия внутриопухолевого воздуха, ограничений ультразвукового исследования (слишком глубокое поражение или наличие жировой ткани печени) или отсутствия сотрудничества со стороны пациента (сразу после терапии). По этой причине контроль контрастной визуализации (КТ или CEUS) следует проводить через месяц после абляции, чтобы подтвердить результат терапии.[нужна цитата ]
Местный рецидив определяется как рецидив гиперэкстенсивной области на периферии опухоли в артериальной фазе с портальным и поздним вымыванием. Иногда, особенно при ГЦК, леченном алкоголизацией (ПЭИ), внутри очага поражения могут быть видны гиперусиленные перегородки или сосуды.[нужна цитата ]
В случае успешного лечения УЗИ с помощью CEUS проводится каждые три месяца. Хотя КЭ-КТ и / или МРТ считаются методом выбора в посттерапевтическом мониторинге, КЭУЗИ может использоваться в протоколах последующего наблюдения, его диагностическая точность эквивалентна КЭ-КТ или МРТ.[нужна цитата ]

Ультразвуковой мониторинг терапии ТАСЕ (трансартериальная химиоэмболизация)
Трансартериальная химиоэмболизация (ТАХЭ) является частью паллиативной терапии ГЦК, применяемой на промежуточных стадиях заболевания. Он состоит из селективной ангиографической катетеризации печеночной артерии и инъекции химиотерапевтических агентов (обычно адриамицина, но другие молекулы в настоящее время проходят клинические испытания) с последующей эмболизацией печеночной артерии гелевой пеной, спиртом или металлическими кольцами. Аналогичная процедура - трансартериальная эмболизация, но без инъекции химиотерапевтических агентов, используется при лечении гиперваскулярных метастазов в печени. Эти методы лечения основаны на преимущественно артериальной сосудистой сети ГЦК и гиперваскулярных метастазах, в то время как оставшаяся паренхима печени имеет двойной сосудистый приток, преимущественно портальный. Их эффективность высока только для поражений, которые сильно усиливаются во время артериальной фазы. Роль УЗИ ограничена в первые несколько дней после процедуры и относится только к ее осложнениям, так как задержка липиодола в основном внутриопухолевая, но также диффузно внутрипеченочная. На УЗИ липиодол выглядит сильно гиперэхогенным внутри опухоли со значительным задним ослаблением, что затрудняет УЗИ. С другой стороны, CE-CT также ограничивается присутствием липиодола (йодного масла), поэтому оценка терапевтической эффективности в настоящее время производится путем косвенной оценки связывания липиодола с опухолью с использованием неусиленной CT. Присутствие липиодола не влияет на CE-MRI, но это дорогостоящий метод и до сих пор труднодоступный. Несколько исследований доказали аналогичную эффективность, даже лучшую, CEUS по сравнению с CE-CT и CE-MRI для оценки результатов лечения после TACE, в то время как другие исследования показали ограничения CEUS, особенно при глубоких или небольших поражениях. Учитывая ограничения CEUS, в настоящее время некоторые авторы рассматривают CT как стандартный метод оценки TACE и местной абляционной терапии, а CEUS и CE-MRI как дополнительные методы. Мониторинг терапевтических результатов ТАСЕ с помощью методов контрастной визуализации выполняется так же, как и при абляционной терапии, сначала через один месяц, а затем через каждые 3 месяца после ТАСЕ.[нужна цитата ]
Учитывая, что ТАСЕ показан только при гипер-усиленных поражениях во время артериальной фазы, CEUS играет очень важную роль в мониторинге диспластических узелков, чтобы определить момент, когда происходят изменения в артериальной сосудистой сети, имея возможность раннего терапевтического вмешательства для ограничения прогрессирования опухоли и увеличения числа пациентов. выживаемость, и тем самым создать мост к трансплантации печени.[нужна цитата ]
Ультразвуковой мониторинг системных терапий
Системная терапия - это процедуры, основанные на сродстве определенных молекул к подавлению репликации опухолевых клеток или размножения опухолевой сосудистой сети (антиангиогенная терапия).[нужна цитата ]
Они вводятся внутривенно и показаны на поздних стадиях опухолевых заболеваний печени, когда нет других эффективных терапевтических решений. Среди ультразвуковых методов CEUS принес значительную пользу не только за счет повышения чувствительности и специфичности ультразвука при обнаружении метастазов в печени, но и за счет оценки эффективности системной терапии ГЦК и метастазов. Этот метод был принят онкологами с 2003 года, поскольку он не требует облучения и не токсичен для печени или почек, и в настоящее время он используется для терапевтической оценки опухолей. В настоящее время он используется в крупных клинических испытаниях, направленных на определение эффективности различных типов антиангиогенных молекул путем количественного определения внутриопухолевой перфузии на основе статистического анализа, выполненного с использованием специального программного обеспечения во время постобработки, чтобы как можно раньше оценить терапевтическую эффективность.[нужна цитата ]
Рекомендации
- ^ Стреба, Костин Теодор; Ионеску, Михаэла; Геонеа, Дэн Ионут; Сандулеску, Лариса; Чуреа, Тудорел; Сафтою, Адриан; Вере, Кристин Константин; Роговяну, Ион (28 августа 2012 г.). «Параметры ультрасонографии с контрастным усилением в нейросетевой диагностике опухолей печени». Всемирный журнал гастроэнтерологии. 18 (32): 4427–4434. Дои:10.3748 / wjg.v18.i32.4427. ISSN 1007-9327. ЧВК 3436061. PMID 22969209.


