Белок гексон - Википедия - Hexon protein
| Adeno_hexon | |||||||||
|---|---|---|---|---|---|---|---|---|---|
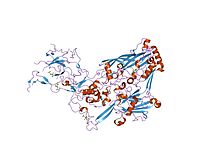 уточнение гексона аденовируса 2 типа с помощью cns | |||||||||
| Идентификаторы | |||||||||
| Символ | Adeno_hexon | ||||||||
| Pfam | PF01065 | ||||||||
| ИнтерПро | IPR016107 | ||||||||
| SCOP2 | 1dhx / Объем / СУПФАМ | ||||||||
| |||||||||
| Адено_гексон_С | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 квазиатомная модель капсида аденовируса человека 5 типа (часть 2) | |||||||||
| Идентификаторы | |||||||||
| Символ | Адено_гексон_С | ||||||||
| Pfam | PF03678 | ||||||||
| ИнтерПро | IPR016108 | ||||||||
| SCOP2 | 1dhx / Объем / СУПФАМ | ||||||||
| |||||||||
В молекулярной биологии гексоновый белок это основное пальто белок нашел в Аденовирусы. Пальто Hexon белки синтезируются в поздних инфекционное заболевание и образуют гомотримеры. 240 копий гексона тример которые производятся, организованы так, что 12 лежат на каждой из 20 граней. Центральные 9 шестиугольников в грани скреплены 12 копиями полипептид IX. Пентонный комплекс, образованный перипентональными гексонами и основанием пентона (удерживающим на месте волокно), лежит в каждой из 12 вершин.[1] Белок гексоновой оболочки представляет собой дупликацию, состоящую из двух домены с аналогичным складывать упакованы вместе, как нуклеоплазмин подразделения. Внутри гексонового тримера домены расположены вокруг оси псевдошестого порядка. В домены есть бета-бутерброд структура состоящий из 8 прядей по две листы с топологией желе-ролла; каждый домен сильно украшен множеством вставок.[2] Некоторые гексоновые белки содержат отдельный С-концевой домен.
Hexon напрямую задействует моторный белок клетки. динеин в зависимости от pH.[3] Белок, регулирующий динеин, динактин, было обнаружено, что он играет очевидную роль в регуляции транспорта динеин-аденовирусного комплекса к ядру.
Рекомендации
- ^ Athappilly FK, Murali R, Rux JJ, Cai Z, Burnett RM (сентябрь 1994 г.). «Уточненная кристаллическая структура гексона, основного белка оболочки аденовируса типа 2, с разрешением 2,9 A». Журнал молекулярной биологии. 242 (4): 430–55. Дои:10.1006 / jmbi.1994.1593. PMID 7932702.
- ^ Rux JJ, Kuser PR, Burnett RM (сентябрь 2003 г.). «Структурный и филогенетический анализ гексонов аденовирусов с использованием рентгеноструктурных методов высокого разрешения, молекулярного моделирования и методов на основе последовательностей». Журнал вирусологии. 77 (17): 9553–66. Дои:10.1128 / jvi.77.17.9553-9566.2003. ЧВК 187380. PMID 12915569.
- ^ Бремнер К.Х., Шерер Дж., Йи Дж., Вершинин М., Гросс С.П., Валле РБ (декабрь 2009 г.). «Транспорт аденовируса посредством прямого взаимодействия цитоплазматического динеина с гексоновой субъединицей вирусного капсида». Клеточный хозяин и микроб. 6 (6): 523–35. Дои:10.1016 / j.chom.2009.11.006. ЧВК 2810746. PMID 20006841.
