Реакция Яппа – Клингеманна - Japp–Klingemann reaction
| Реакция Яппа – Клингеманна | |
|---|---|
| Названный в честь | Фрэнсис Роберт Джепп Феликс Клингеманн |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000158 |
В Реакция Яппа – Клингеманна это химическая реакция используется для синтеза гидразоны из β-кетокислот (или β-кетоэфиров) и арил соли диазония.[1][2][3][4][5][6] Реакция названа в честь химиков Фрэнсис Роберт Джепп и Феликс Клингеманн.
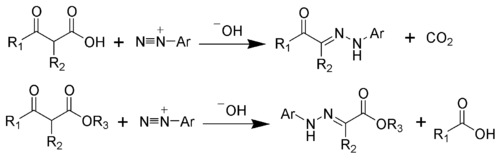
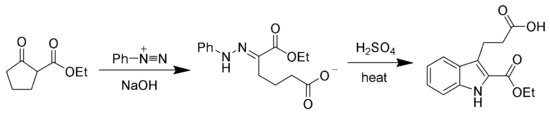
Гидразоновые продукты реакции Яппа – Клингеманна чаще всего используются в качестве промежуточных продуктов в синтезирует более сложных органических молекул. Например, продукт фенилгидразона можно нагреть в присутствии сильной кислоты для получения индол через Синтез индола по Фишеру.[7][8]
Механизм реакции
Чтобы проиллюстрировать механизм, рассмотрим вариант сложного эфира Яппа-Клингеманна. Первый шаг - это депротонирование β-кетоэфира. В нуклеофильное присоединение из энолировать анион 2 к соль диазония производит азосоединение 3. Средний 3 был изолирован в редких случаях. Однако в большинстве случаев гидролиз промежуточного 3 производит четырехгранный средний 4, который быстро разлагается с выделением карбоновой кислоты 6. После водород обмен, конечный гидразон 7 производится.

Рекомендации
- ^ Фрэнсис Роберт Джепп, Феликс Клингеманн (1887). "Ueber Benzolazo- und Benzolhydrazofettsäuren". Berichte der deutschen chemischen Gesellschaft. 20 (2): 2942–2944. Дои:10.1002 / cber.188702002165.
- ^ Ф. Р. Джепп; Ф. Клингеманн (1887). "Zur Kenntniss der Benzolazo- und Benzolhydrazopropionsäuren (стр. 3284-3286)". Berichte der Deutschen Chemischen Gesellschaft. 20 (2): 3284–3286. Дои:10.1002 / cber.188702002234.
- ^ Ф. Р. Джепп; Ф. Клингеманн (1887). "Ueber sogenannte» gemischte Azoverbindungen ". Berichte der deutschen chemischen Gesellschaft. 20 (2): 3398–3401. Дои:10.1002 / cber.188702002268.
- ^ Ф. Р. Джепп; Ф. Клингеманн (1888). "Ueber die Construction einiger sogenannten gemischten Azoverbindungen". Liebigs Annalen der Chemie. 247 (2): 190–225. Дои:10.1002 / jlac.18882470208.
- ^ Филлипс, Р. Орг. Реагировать. 1959, 10, 143.
- ^ Рейнольдс, Г. А .; ВанАллан, Дж. А. Орг. Synth., Сб. Vol. 4, с. 633 (1963); Vol. 32, стр.84 (1952) (Статья В архиве 2012-07-16 в Wayback Machine )
- ^ Bowman, R.E .; Goodburn, T. G .; Рейнольдс А.А. (1972). «1,3,4,5-Тетрагидробенз [cd] индолы и родственные соединения. Часть I. Новый синтез 3,4-дигидробенз [cd] индол-5 (1H) -она (кетон Уле)». J. Chem. Soc. Perkin Trans. 1: 1121. Дои:10.1039 / P19720001121.
- ^ Meyer, M.D .; Круз, Л. И. (1984). «Эрголиновые синтоны: синтез 3,4-дигидро-6-метоксибенз [cd] индол-5 (1H) -она (6-метокси-кетон Уле) и 3,4-дигидробенз [cd] индол-5 (1H) - один (кетон Уле) посредством нового декарбоксилирования индол-2-карбоксилатов ». J. Org. Chem. 49 (17): 3195–3199. Дои:10.1021 / jo00191a028.
