Биосовместимость титана - Titanium biocompatibility

Титана впервые был использован в хирургии в 1950-х годах после того, как десять лет назад использовался в стоматологии. В настоящее время это металл, который выбирают для протезирования, внутренней фиксации, внутренних устройств и инструментов. Титан используется с головы до ног в биомедицинских имплантатах. Титан можно найти в нейрохирургии, слуховых аппаратах с костной проводимостью, имплантатах ложных глаз, спондилодез клетки, кардиостимуляторы, имплантаты пальцев стопы и замены плеча / локтя / бедра / колена, а также многое другое. Основная причина, по которой титан часто используется в организме, связана с его биосовместимость и, с модификациями поверхности, биоактивная поверхность. Характеристики поверхности, влияющие на биосовместимость: текстура поверхности, стерические препятствия, сайты связывания и гидрофобность (смачивание). Эти характеристики оптимизированы для создания идеального клеточного ответа. Некоторые медицинские имплантаты, а также части хирургических инструментов покрыты нитрид титана (Банка).
Биосовместимость
Титан считается самым биосовместимый металл из-за его устойчивости к коррозии из-за биологических жидкостей, биоинертности, способности к остеоинтеграции и высокого предела усталости. Способность титана противостоять суровым условиям окружающей среды является результатом защитной оксидной пленки, которая образуется естественным образом в присутствии кислорода. Оксидная пленка прочно сцепляется, нерастворима и химически непроницаема, предотвращая реакции между металлом и окружающей средой.
Остеоинтеграционное взаимодействие и распространение
Поверхности с высокой энергией вызывают ангиогенез во время остеоинтеграции
Было высказано предположение, что способность титана к остеоинтеграция происходит из-за высокой диэлектрической проницаемости его поверхностного оксида, который не денатурирует белки (например, тантал, и кобальт сплавы ).[1] Его способность физически связываться с костью дает титану преимущество перед другими материалами, которые требуют использования адгезива, чтобы оставаться прикрепленным. Титановые имплантаты служат дольше, и для разрыва связей, соединяющих их с телом, требуются гораздо более высокие усилия по сравнению с их альтернативами.[2]
Свойства поверхности определяют остеоинтеграцию
Поверхностные свойства биоматериала играют важную роль в определении клеточного ответа (клеточной адгезии и пролиферации) на материал. Микроструктура титана и высокая поверхностная энергия позволяют ему вызывать ангиогенез, что способствует процессу остеоинтеграции.[3]
Поверхностная энергия
Окислительно-восстановительный потенциал
Титан может иметь много различных стандартных электродных потенциалов в зависимости от степени окисления. Твердый титан имеет стандартный электродный потенциал -1,63 В. Материалы с более высоким стандартным электродным потенциалом легче восстанавливаются, что делает их лучшими окислителями.[4] Как видно из приведенной ниже таблицы, твердый титан предпочитает подвергаться окислению, что делает его лучшим восстановителем.
| Половина реакции | Стандартный электронный потенциал (В) |
|---|---|
| Ti2+ + 2 е− → Ti (с) | -1.63[4] |
| Ti3+ + 3 е− → Ti (с) | -1.21[5] |
| TiO2+ + 2 часа+ + 4 е− → Ti (s) + H2О | -0.86[6] |
| 2 TiO2(s) + 2 H+ + 2 е− → Ti2О3(s) + H2О | -0.56[6] |
| Ti2+(водн.) / M3+(водн.) | -0.36[5] |
Покрытие поверхности

Титан естественным образом пассивируется, образуя оксидную пленку, которая становится неоднородной и поляризованной в зависимости от времени воздействия окружающей среды.[7] Это приводит со временем к повышенной адсорбции гидроксильных групп, липопротеинов и гликолипидов.[7] Адсорбция этих соединений изменяет способ взаимодействия материала с телом и может улучшить биосовместимость. В титановых сплавах, таких как Ti-Zr и Ti-Nb, ионы циркония и ниобия, которые высвобождаются из-за коррозии, не попадают в тело пациента, а, скорее, добавляются в пассивирующий слой.[8] Легирующие элементы в пассивном слое добавляют степень биосовместимости и коррозионной стойкости в зависимости от исходного состава сплава основного металла до коррозии.
Поверхностная концентрация белка, (), определяется уравнением
где QОБЪЯВЛЕНИЯ - плотность поверхностного заряда в Кл · см−2, M - молярная масса белка в г · моль−1, n - число перенесенных электронов (в данном случае один электрон на каждую протонированную аминогруппу в белке), а F - константа Фарадея в C моль−1.
Уравнение для частоты столкновений выглядит следующим образом:
где D = 8,83 × 10−7 см2 s−1 - коэффициент диффузии молекулы БСА при 310 К, d = 7,2 нм - «диаметр» белка, который эквивалентен удвоенному радиусу Стокса, NA = 6,023 × 1023 моль−1 - число Авогадро, а c * = 0,23 г л−1 (3,3 мкМ) - критическая концентрация объемного пересыщения.
Смачивающая и твердая поверхность
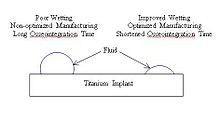
Смачивание происходит как функция двух параметров: шероховатости поверхности и доли поверхности.[10] Увеличивая смачивание, имплантаты могут сократить время, необходимое для остеоинтеграции, позволяя клеткам более легко связываться с поверхностью имплантата.[2] Смачивание титана можно изменить путем оптимизации параметров процесса, таких как температура, время и давление (показано в таблице ниже). Титан со стабильными оксидными слоями, преимущественно состоящими из TiO2, приводит к улучшенному смачиванию имплантата при контакте с физиологической жидкостью.[11]
| Поверхность | Угол смачивания (градусы) | Давление (мбар) во время обработки | Температура (градусы C) во время обработки | Другая обработка поверхности |
|---|---|---|---|---|
| Голая Ti | ~50[9] | - | - | Никто |
| TiO2 TiO Ti4О7 TiO4 (Планарный) | ~33[11] | 2.2 | 700 | Окисление |
| TiO2 TiO Ti4О7 (Планарный) | ~45[11] | 4 | 700 | Окисление |
| TiO2 TiO Ti4О7 TiO4 (Пустой) | ~32[11] | 2.2 | 400 | Окисление |
| TiO2 TiO Ti4О7 (Пустой) | ~25[11] | 2.6 | 500 | Окисление |
| TiO2 TiO Ti4О7 (Пустой) | ~8[11] | 4 | 400 | Окисление |
| TiO2 TiO Ti4О7 (Пустой) | ~20[11] | 4 | 500 | Окисление |
| Ti с шероховатой поверхностью | 79.5 ± 4.6[12] | - | - | Обработанная поверхность |
| Ti с обработанной щелочью поверхностью | 27.2 ± 6.9[12] | - | - | Био-поверхность |
Адсорбция
Коррозия
Механическое истирание пленки оксида титана приводит к увеличению скорости коррозия.[13]
Титан и его сплавы не защищены от коррозии в организме человека. Титановые сплавы чувствительны к абсорбции водорода, что может вызвать осаждение гидридов и вызвать охрупчивание, что приведет к разрушению материала.[13] «Водородное охрупчивание наблюдалось как механизм разрушения in vivo в условиях фреттинг-щелевой коррозии, приводящей к образованию TiH, поверхностной реакции и растрескиванию внутри конусов модульного тела Ti / Ti».[13] Изучение и тестирование поведения титана в организме позволяет нам избежать злоупотреблений, которые могут привести к фатальному разрушению имплантата, таких как использование стоматологических продуктов с высокой концентрацией фтора или веществ, способных снизить pH среды вокруг имплантата.[14]
Адгезия
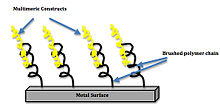
Клетки на границе имплантата очень чувствительны к посторонним предметам. Когда имплантаты устанавливаются в тело, клетки вызывают воспалительную реакцию, которая может привести к инкапсуляции, нарушая функционирование имплантированного устройства.[15]
Идеальный клеточный ответ на биоактивную поверхность характеризуется стабилизацией и интеграцией биоматериала, а также сокращением потенциальных участков бактериальной инфекции на поверхности. Одним из примеров интеграции биоматериала является титановый имплант с инженерной биоинтерфейс покрыт биомиметик мотивы. Было показано, что поверхности с этими биомиметическими мотивами усиливают связывание интегрина, передачу сигналов и дифференцировку стволовых клеток. Увеличение плотности кластеризации лигандов также увеличивает связывание интегрина. Покрытие, состоящее из тримеров и пентамеров, увеличивало площадь контакта кости с имплантатом на 75% по сравнению с текущим клиническим стандартом титана без покрытия.[16] Это увеличение площади позволяет увеличить клеточную интеграцию и уменьшить отторжение имплантированного устройства. В Изотерма Ленгмюра:
,[9]
где c - концентрация адсорбата - максимальное количество адсорбированного белка, BОБЪЯВЛЕНИЯ - сродство молекул адсорбата к центрам адсорбции. Изотерма Ленгмюра может быть линеаризована путем преобразования уравнения в
Это моделирование является хорошим приближением адсорбции на поверхности по сравнению с экспериментальными значениями.[9] Изотерма Ленгмюра адсорбции элементов на поверхности титана может быть определена путем построения известных параметров. Эксперимент фибриноген адсорбция на поверхности титана «подтвердила применимость изотермы Ленгмюра для описания адсорбции фибриногена на поверхности Ti».[9]
Смотрите также
Рекомендации
- ^ Блэк Дж. (1994) Биологические свойства тантала. Clin Mater 16: 167–173.
- ^ а б Рейнс, Эндрю Л .; Оливарес-Наваррете, Рене; Виланд, Марко; Кокран, Дэвид Л .; Шварц, Цви; Боян, Барбара Д. (2010). «Регулирование ангиогенеза во время остеоинтеграции за счет микроструктуры и энергии поверхности титана». Биоматериалы. 31 (18): 4909–17. Дои:10.1016 / j.biomaterials.2010.02.071. ЧВК 2896824. PMID 20356623.
- ^ http://titaniumthemetal.org/Resources/DataSheetMedical.pdf
- ^ а б «Стандартный восстановительный потенциал (25oC)».
- ^ а б Браун, док. «Химия титана».
- ^ а б Зима, Марк. «Соединения титана».
- ^ а б Хили, Кевин Э .; Дюшейн, Пол (1991). «Физическая модель границы раздела титан-ткань». Транзакции ASAIO. 37 (3): M150–1. PMID 1751087.
- ^ Лонг, Марк; Стойка, H.J (1998). «Титановые сплавы в полной замене швов - перспективы материаловедения». Биоматериалы. 19 (18): 1621–39. Дои:10.1016 / S0142-9612 (97) 00146-4. PMID 9839998.
- ^ а б c d е ж грамм Джексон, Дуглас Р .; Оманович, Саша; Роско, Шарон Г. (2000). «Электрохимические исследования адсорбционного поведения белков сыворотки крови на титане». Langmuir. 16 (12): 5449–57. Дои:10.1021 / la991497x.
- ^ Бико, Хосе; Тиле, Уве; Кере, Дэвид (2002). «Смачивание текстурированных поверхностей». Коллоиды и поверхности A: физико-химические и технические аспекты. 206 (1–3): 41–6. Дои:10.1016 / S0927-7757 (02) 00061-4.
- ^ а б c d е ж грамм Silva, M.A.M .; Martinelli, A.E .; Alves, C .; Nascimento, R.M .; Távora, M.P .; Вилар, К. (2006). «Модификация поверхности Ti-имплантатов плазменным окислением в разряде с полым катодом». Технология поверхностей и покрытий. 200 (8): 2618–26. Дои:10.1016 / j.surfcoat.2004.12.027.
- ^ а б Стрнад, Якуб; Стрнад, Зденек; Шестак, Ярослав; Урбан, Карел; Повышил, Ctibor (2007). «Биоактивированная титановая поверхность, используемая для имитации имплантации кости в стоматологии - Часть III: Характеристики поверхности и формирование контакта кость-имплантат». Журнал физики и химии твердого тела. 68 (5–6): 841–5. Bibcode:2007JPCS ... 68..841S. Дои:10.1016 / j.jpcs.2007.02.040.
- ^ а б c Rodrigues, Danieli C .; Урбан, Роберт М .; Джейкобс, Джошуа Дж .; Гилберт, Джереми Л. (2009). "В естественных условиях сильная коррозия и водородная хрупкость извлеченных тазобедренных имплантатов модульного корпуса из титанового сплава ». Журнал исследований биомедицинских материалов, часть B: Прикладные биоматериалы. 88 (1): 206–19. Дои:10.1002 / jbm.b.31171. ЧВК 2667129. PMID 18683224.
- ^ http://www.dynadental.com/editor/download-121/091102%20Nakagawa%20M%20-%20Effect%20of%20Fluoride%20and%20pH%20on%20Titanium%20-%20ENG.pdf
- ^ Франц, Сандра; Раммельт, Стефан; Шарнвебер, Дитер; Саймон, Ян К. (2011). «Иммунные ответы на имплантаты - обзор последствий для дизайна иммуномодулирующих биоматериалов». Биоматериалы. 32 (28): 6692–709. Дои:10.1016 / j.biomaterials.2011.05.078. PMID 21715002.
- ^ Petrie, T. A .; Raynor, J. E .; Dumbauld, D.W .; Lee, T. T .; Jagtap, S .; Templeman, K. L .; Collard, D. M .; Гарсия, А. Дж. (2010). «Поливалентные интегрин-специфические лиганды улучшают заживление тканей и интеграцию биоматериалов». Научная трансляционная медицина. 2 (45): 45ra60. Дои:10.1126 / scitranslmed.3001002. ЧВК 3128787. PMID 20720217.





