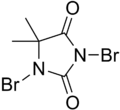
DBDMH - DBDMH
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 1,3-дибром-5,5-диметилгидантоин | |||
| Другие имена DBDMH, дибромантин, дибромодиметилгидантоин | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.938 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C5ЧАС6Br2N2О2 | |||
| Молярная масса | 285.923 г · моль−1 | ||
| Внешность | Белое твердое вещество | ||
| Плотность | 1,36 г / см3 | ||
| Температура плавления | От 197 до 203 ° C (от 387 до 397 ° F, от 470 до 476 K) | ||
| 0,1 г / 100 мл (20 ° С) | |||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H301, H302, H314, H317, H319, H400, H410 | |||
| P260, P261, P264, P270, P272, P273, P280, P301 + 310, P301 + 312, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P330, P333 + 313, P337 + 313, P363, P391, P405, P501 | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
DBDMH (также известен как 1,3-дибром-5,5-диметилгидантоин) представляет собой органическое соединение, полученное из гетероцикл называется диметилгидантоин. Это белое кристаллическое соединение с легким бром запах широко используется как дезинфицирующее средство используется для питья очистка воды, рекреационная очистка воды, в качестве отбеливателя на целлюлозно-бумажных комбинатах и для обработки промышленных / коммерческих систем водяного охлаждения. [1] Его действие не предполагает использования хлорноватистая кислота.
Механизм действия
1,3-Дибром-5,5-Диметилгидантоин является источником брома, который эквивалентен бромистоводородной кислоте (HOBr).
- Br2X + 2 H2О → 2 HOBr + H2Икс
(Где H2X - 5,5-диметилгидантоин)
С пKа 8,6 гипобромистая кислота частично диссоциирует в воде:
- HOBr ⇌ H+ + BrO−
Бромистоводородная кислота служит источником Br+, "который производит ионы бромида в процессе дезинфекции:
- HOBr + живые патогены → Br− + мертвые патогены
Образующиеся бромид-ионы могут затем подвергаться окислению до бромистоводородной кислоты в присутствии окислителя достаточной силы, например озон, хлорноватистая кислота, моно калияперсульфат. Этот процесс повторного окисления обычно называют «активацией» бромид-иона:
- Br− + HOCl → HOBr + Cl−
Рекомендации
- ^ Дэвид Иоффе, Арье Кампф «Бром, органические соединения» в Энциклопедия химической технологии Кирка-Отмера, 2002, автор John Wiley & Sons. Дои: 10.1002 / 0471238961.0218151325150606.a01