Дихлор (1,3-бис (дифенилфосфино) пропан) никель - Dichloro(1,3-bis(diphenylphosphino)propane)nickel
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК Дихлор [1,3-пропандиилбис (дифенилфосфанид-κP)] никель | |
| Другие имена 1,3-бис (дифенилфосфино) пропаненикель (II) хлорид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.132.628 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C27ЧАС26Cl2Niп2 | |
| Молярная масса | 542.05 г · моль−1 |
| Внешность | Оранжевый до красно-оранжевого порошка |
| Температура плавления | 213 ° С (415 ° F, 486 К) |
| Нерастворимый | |
| Опасности | |
| Паспорт безопасности | Внешний SDS |
| Пиктограммы GHS |   [1] [1] |
| Сигнальное слово GHS | Опасность[1] |
| H315, H317, H319, H334, H335, H350[1] | |
| P201, P261, P280, P305 + 351 + 338, P308 + 313[1] | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дихлор [1,3-бис (дифенилфосфино) пропан] никель а координационный комплекс с формулой NiCl2(dppp); где dppp - это дифосфин 1,3-бис (дифенилфосфино) пропан. Он используется как катализатор в органическом синтезе. Соединение представляет собой ярко-оранжево-красный кристаллический порошок.
Структура и свойства
Хотя электронная и твердотельная структура хлоридного конгенера неизвестна (из-за низкой растворимости в обычных аналитических растворителях), было проведено несколько исследований бром- и йодпроизводных.[2] Комплексы демонстрируют зависимое от температуры взаимное превращение между квадратно-плоской и тетраэдрической геометриями (диамагнитной и парамагнитной) в полярных органических растворителях (Keq между 1-3,68, в зависимости от растворителя и температуры). В отличие, дихлор (1,2-бис (дифенилфосфино) этан) никель принимает статическую квадратно-плоскую (диамагнитную) структуру в растворе.
Подготовка
NiCl2(dppp) получают путем объединения равных молярных частей хлорид никеля (II) гексагидрат с 1,3-бис (дифенилфосфино) пропан в 2-пропаноле.[3]
- Национальные институты здравоохранения США2O)6Cl2 + dppp → NiCl2(dppp) + 6 часов2О
Реакции
NiCl2(dppp) в эффективном катализаторе реакции сочетания такой как Муфта Кумада[3] и Сузуки реакции (пример ниже).[4] Он также катализирует другие реакции, которые преобразуют енольные эфиры, дитиоацетали, и винилсульфиды до олефины.[5][6]
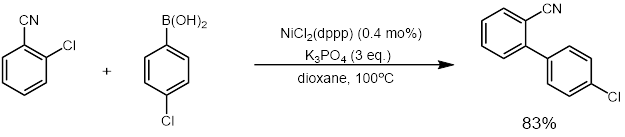
Рекомендации
- ^ а б c d «1,3-Бис (дифенилфосфино) пропан-никель (II) хлорид». Американские элементы. Получено 6 сентября, 2018.
- ^ Ван Хек, Джеральд Р .; Хоррокс-младший, Уильям ДеВ. (1966). "Дитерциальные фосфиновые комплексы никеля. Исследования спектрального, магнитного и протонного резонанса. Планарно-тетраэдрическое равновесие". Неорганическая химия. 5 (11): 1968–1974. Дои:10.1021 / ic50045a029.
- ^ а б Кумада, Макота; Тамао, Кохей; Сумитани, Кодзи (1978). «Фосфин-никелевый комплекс, катализируемый перекрестным взаимодействием реагентов Гриньяра с арил- и алкенилгалогенидами: 1,2-дибутилбензолом». Орг. Синтезатор. 58: 127. Дои:10.15227 / orgsyn.058.0127.
- ^ Чжао, Юй-Лун; Ли, ты; Ли, Шуй-Мин; Чжоу И-Го; Сунь, Фэн-И; Гао, Лянь-Сюнь; Хан, Фу-Шэ (1 июня 2011 г.). «Практичный и надежный никелевый катализатор для взаимодействия Сузуки-Мияура арилгалогенидов». Расширенный синтез и катализ. 353 (9): 1543–1550. Дои:10.1002 / adsc.201100101.
- ^ Тянь-Яу Лух; Тянь-Минь Юань. «Реакции перекрестной связи». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rd100.pub2.
- ^ Юнгдал, Томас; Беннур, Тимманна; Даллас, Андреа; Emtenaes, Hans; Маартенссон, Джеркер (2008). "Два конкурирующих механизма реакции перекрестного связывания Соногашира без меди". Металлоорганические соединения. 27 (11): 2490–2498. Дои:10.1021 / om800251s.
