Быстрый параллельный протеолиз - Википедия - Fast parallel proteolysis
Быстрый параллельный протеолиз (FASTpp) - метод определения термостойкость из белки путем измерения того, какая фракция белка сопротивляется быстрому протеолитическому перевариванию.[1]
История и предыстория
Протеолиз широко используется в биохимия и клеточная биология чтобы исследовать структура белка.[2][3] При «ограниченном протеолизе трипсина» низкие количества протеаза переварить оба сложенный и развернутый белок, но в значительной степени с разной скоростью: неструктурированные белки разрезаются быстрее, а структурированные белки разрезаются медленнее (иногда на порядки). Недавно было предложено несколько других анализов стабильности белков, основанных на протеолизе, с использованием других протеаз с высокой специфичностью для расщепления развернутых белков. К ним относятся протеолиз пульса,[4] Протеолитическая сканирующая калориметрия [5] и FASTpp.
Как это устроено
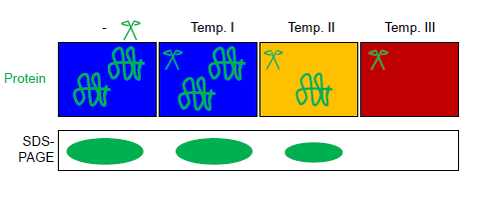
FASTpp измеряет количество белка, который сопротивляется перевариванию в различных условиях. Для этого используется термостабильная протеаза, которая расщепляет специфически при воздействии гидрофобный остатки. Анализ FASTpp сочетает в себе термическое разворачивание, специфичность термостабильной протеазы для развернутой фракции с разделяющей способностью SDS-СТРАНИЦА.[6] Благодаря этой комбинации FASTpp может обнаруживать изменения фракции, свернутой в большом физико-химическом диапазоне условий, включая температуры до 85 ° C, pH 6-9, наличие или отсутствие целого протеом. Диапазон приложений от биотехнология изучать точечные мутации и анализы связывания лиганда.
Приложения
FASTpp использовался для проверки:[1]
- Влияние лизата на стабильность белка
- Термическая стабильность протеома [7]
- Парное фальцовка и переплет [8]
- Влияние лиганда на свертывание и стабильность фракции [9]
- Влияние мутаций на свертывание и стабильность фракций (например, точечная мутация /миссенс-мутации[9][10])
- Кинетическая стабильность белка [11]
Технологии
Во-первых, клеточный лизат генерируется путем измельчения стеклянных шариков, гомогенизации под давлением или методами химического или физического лизиса, которые не денатурируют интересующий белок (белки). (Необязательно для целевого анализа) интересующий белок очищают из этого лизата методами аффинности, основанными на изначально неупорядоченных метках. [12] или другие подходящие стратегии очистки, часто включающие несколько стадий ортогональной хроматографии.
Этот (общий или очищенный) раствор белка аликвотируют в несколько пробирок ПЦР-стрипа. Все аликвоты подвергаются параллельному воздействию в термостабильном цикле ПЦР с различными максимальными температурами в присутствии термостабильной протеазы термолизина (см. Рисунок). Автоматическое регулирование температуры достигается в цикле температурного градиента (обычно используется для ПЦР ). Продукты реакции можно разделить по SDS-СТРАНИЦА или же вестерн-блот.[6] Термолизин протеазы может быть полностью инактивирован EDTA. Эта особенность термолизин делает FASTpp совместимым с последующими трипсин пищеварение например за масс-спектрометрии.[13][14][7]
Рекомендации
- ^ а б Минде, Д. П .; Морис, М. М .; Рюдигер, С. Г. Д. (2012). Уверский Владимир Н (ред.). «Определение биофизической стабильности белков в лизатах с помощью анализа быстрого протеолиза, FASTpp». PLOS ONE. 7 (10): e46147. Дои:10.1371 / journal.pone.0046147. ЧВК 3463568. PMID 23056252.
- ^ Johnson, D.E .; Сюэ, В .; Sickmeier, M.D .; Meng, J .; Cortese, M. S .; Oldfield, C.J .; Le Gall, T .; Дункер, А. К .; Уверский, В. Н. (2012). «Высокопроизводительная характеристика внутреннего нарушения в белках от Protein Structure Initiative». Журнал структурной биологии. 180 (1): 201–215. Дои:10.1016 / j.jsb.2012.05.013. ЧВК 3578346. PMID 22651963.
- ^ Hoelen, H .; Kleizen, B .; Schmidt, A .; Richardson, J .; Charitou, P .; Thomas, P.J .; Браакман И. (2010). Уверский Владимир Н (ред.). «Первичный дефект сворачивания и спасение ΔF508 CFTR, возникающее во время трансляции мутантного домена». PLOS ONE. 5 (11): e15458. Дои:10.1371 / journal.pone.0015458. ЧВК 2994901. PMID 21152102.
- ^ Парк, Ц .; Маркиз, С. (2005). «Импульсный протеолиз: простой метод количественного определения стабильности белка и связывания лиганда». Методы природы. 2 (3): 207–212. Дои:10.1038 / nmeth740. PMID 15782190.
- ^ Tur-Arlandis, G .; Rodriguez-Larrea, D .; Ибарра-Молеро, В .; Санчес-Руис, Дж. М. (2010). «Протеолитическая сканирующая калориметрия: новая методология, которая исследует фундаментальные особенности кинетической стабильности белков». Биофизический журнал. 98 (6): L12 – L14. Дои:10.1016 / j.bpj.2009.11.028. ЧВК 2849053. PMID 20303845.
- ^ а б Лэммли, У.К. (1970). «Расщепление структурных белков при сборке головки бактериофага Т4». Природа. 227 (5259): 680–685. Дои:10.1038 / 227680a0. PMID 5432063.
- ^ а б Leuenberger, P; Ганша, S; Кахраман, А (2017). «Общеклеточный анализ теплового разворачивания белков выявляет детерминанты термостабильности». Наука. 355 (6327): eaai7825. Дои:10.1126 / science.aai7825. PMID 28232526.
- ^ Демарест, С. Дж .; Martinez-Yamout, M .; Chung, J .; Chen, H .; Xu, W .; Дайсон, Х. Дж.; Evans, R.M .; Райт, П. Э. (2002). «Взаимное синергетическое сворачивание в рекрутировании CBP / p300 коактиваторами ядерных рецепторов p160». Природа. 415 (6871): 549–553. Дои:10.1038 / 415549a. PMID 11823864.
- ^ а б Robaszkiewicz, K .; Островская, З .; Cyranka-Czaja, A .; Морачевска, Дж. (2015). «Нарушение взаимодействия тропомиозин-тропонин снижает активацию тонкой нити актина». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1854 (5): 381–390. Дои:10.1016 / j.bbapap.2015.01.004. PMID 25603119.
- ^ Минде, Д. П .; Анвариан, З .; Rüdiger, S.G .; Морис, М. М. (2011). «Беспорядок с ошибками: как миссенс-мутации в белке-супрессоре опухолей APC приводят к раку?». Молекулярный рак. 10: 101. Дои:10.1186/1476-4598-10-101. ЧВК 3170638. PMID 21859464.
- ^ Tur-Arlandis, G .; Rodriguez-Larrea, D .; Ибарра-Молеро, В .; Санчес-Руис, Дж. М. (2010). «Протеолитическая сканирующая калориметрия: новая методология, которая исследует фундаментальные особенности кинетической стабильности белков». Биофизический журнал. 98 (6): L12 – L14. Дои:10.1016 / j.bpj.2009.11.028. ЧВК 2849053. PMID 20303845.
- ^ Минде, Д.П .; Halff, EF; Танс, SJ (2013). «Дизайн беспорядка: сказки о неожиданных хвостах». Внутренне нарушенные белки. 1 (1): e26790. Дои:10.4161 / idp.26790. ЧВК 5424805. PMID 28516025.
- ^ Чанг, Y; Schlebach, JP; Verheul, RA; Парк, C (2012). «Упрощенный подход протеомики для обнаружения взаимодействий белок-лиганд». Белковая наука. 21 (9): 1280–7. Дои:10.1002 / pro.2112. ЧВК 3631357. PMID 22733688.
- ^ Парк, Ц; Marqusee, S (2005). «Импульсный протеолиз: простой метод количественного определения стабильности белка и связывания лиганда». Методы природы. 2 (3): 207–12. Дои:10.1038 / nmeth740. PMID 15782190.
