Многократное усиление смещения - Multiple displacement amplification
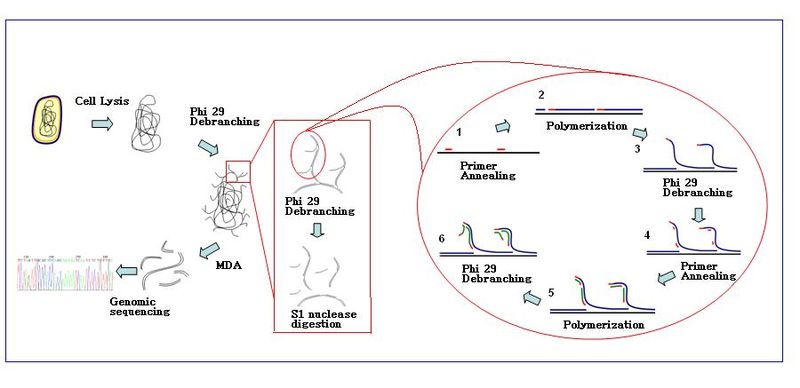
Множественное усиление смещения (MDA) это ДНК техника усиления. Этот метод может быстро увеличить незначительное количество образцов ДНК до разумного количества для геномного анализа. Реакция начинается с отжига случайного гексамера. грунтовки к шаблону: синтез ДНК осуществляется с высокой точностью фермент, предпочтительно ДНК-полимераза Φ29. По сравнению с обычным ПЦР При использовании методов амплификации MDA не использует праймеры, специфичные для последовательности, но амплифицирует всю ДНК, генерирует продукты большего размера с более низкой частотой ошибок и работает при постоянной температуре. MDA активно использовался в амплификация всего генома (WGA) и является многообещающим методом для применения в секвенирование генома одной клетки и генетические исследования на основе секвенирования.
Фон
Многие биологические и судебно-медицинский дела с участием генетический Анализ требует секвенирования ДНК из мельчайших количеств образца, например ДНК из некультивируемых отдельных клеток или следовых количеств ткани, взятых с мест преступления. Обычная полимеразная цепная реакция (ПЦР Для методов амплификации ДНК на основе последовательности требуются специфичные для последовательности олигонуклеотидные праймеры и термостабильные (обычно Taq) полимераза, и может использоваться для создания значительных количеств ДНК из незначительных количеств ДНК. Однако этого недостаточно для современных методов, использующих анализ ДНК на основе секвенирования. Следовательно, необходим более эффективный метод амплификации незначительных количеств ДНК, не связанный с последовательностью, особенно в геномных исследованиях отдельных клеток.
Материалы
ДНК-полимераза Phi 29
Бактериофаг ДНК-полимераза Φ29 высокопроизводительный фермент которые могут производить ампликоны ДНК размером более 70 тысяч пар оснований.[1] Его высокая точность и активность корректуры 3’ – 5 'снижают частоту ошибок амплификации до 1 из 10.6−107 базы по сравнению с обычными Taq полимераза с сообщенной частотой ошибок 1 из 9000.[2] Реакция может быть проведена при умеренных изотермических условиях 30 ° C и, следовательно, не требует термоциклер. Он активно используется в бесклеточном клонировании, которое представляет собой ферментативный метод амплификации ДНК. in vitro без культивирования клеток и Извлечение ДНК. Большой фрагмент Bst ДНК-полимераза также используется в MDA, но, как правило, предпочтительнее использовать Ф29 из-за его достаточного выхода продукта и активности проверки.[3]
Праймеры гексамерные
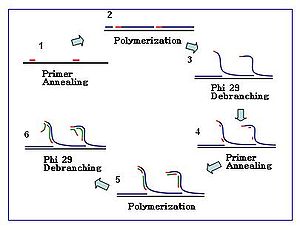
Праймеры гексамера представляют собой последовательности, состоящие из шести случайных нуклеотиды. Для применения MDA эти праймеры обычно модифицированы тиофосфатом на их 3 ’конце, чтобы обеспечить устойчивость к 3’ – 5’ экзонуклеаза активность ДНК Ф29 полимераза. Реакции MDA начинаются с отжига таких праймеров на матрице ДНК с последующим удлинением цепи, опосредованным полимеразой. Во время реакции амплификации происходит увеличение числа событий отжига праймеров.
Реакция
Реакция амплификации начинается, когда несколько гексамеров праймеров отжигаются с матрицей. Когда синтез ДНК переходит к следующему стартовому сайту, полимераза вытесняет вновь образованную цепь ДНК и продолжает ее удлинение. Смещение цепи генерирует недавно синтезированную матрицу одноцепочечной ДНК для большего количества праймеров для отжига. Дальнейший отжиг праймеров и смещение цепи на вновь синтезированной матрице приводит к гиперразветвленной сети ДНК. Разветвление последовательности во время амплификации приводит к высокому выходу продуктов. Чтобы отделить разветвленную сеть ДНК, Нуклеазы S1 используются для расщепления фрагментов в местах смещения. Порезы на полученных фрагментах ДНК ремонтируются с помощью ДНК-полимераза I.
Качество продукции
MDA может генерировать 1-2 мкг ДНК из одной клетки с охватом генома до 99%.[4] Продукты также имеют меньшую частоту ошибок и больший размер по сравнению с продуктами на основе ПЦР. Taq усиление.[4][5]
Общий рабочий процесс MDA:[6]
- Базовые приготовления: Образцы собираются и разводятся в соответствующем реакционном буфере (Ca2+ и Mg2+ свободный). Клетки лизируются щелочной буфер.
- Условие: Реакция MDA с полимеразой Ф29 проводится при 30 ° C. Обычно реакция занимает около 2,5–3 часов.
- Конец реакции: Инактивировать ферменты при 65 ° C перед сбором продуктов амплифицированной ДНК.
- Продукты ДНК можно очистить с помощью коммерческого набора для очистки.
Преимущества
MDA производит достаточный выход продуктов ДНК. Это мощный инструмент для амплификации молекул ДНК из образцов, таких как некультивируемые микроорганизмы или отдельные клетки, до количества, достаточного для последовательность действий исследования. Большой размер продуктов ДНК, амплифицированных MDA, также обеспечивает желаемое качество образца для определения размера аллелей полиморфных повторов. Его высокая точность также делает его надежным для использования в однонуклеотидный полиморфизм (SNP) обнаружение аллелей. Из-за смещения цепи во время амплификации амплифицированная ДНК имеет достаточный охват молекул исходной ДНК, что обеспечивает высококачественный продукт для геномного анализа. Продукты смещенных цепей можно впоследствии клонировать в векторы для создания библиотеки для последующего последовательность действий реакции.
Ограничения
Аллельный выпад (ADO)
ADO определяется как случайное отсутствие усиления одного из аллели присутствует в гетерозиготный образец. Некоторые исследования сообщают, что уровень ADO продуктов MDA составляет 0–60%.[7] Этот недостаток снижает точность генотипирование одного образца и ошибочный диагноз в других приложениях, связанных с MDA. ADO, по-видимому, не зависит от размеров фрагментов и, как сообщается, имеет аналогичную скорость в других одноклеточных методах. Возможные решения - использование различных условий лизиса или проведение нескольких раундов амплификаций из разбавленных продуктов MDA, поскольку ПЦР Сообщалось, что опосредованная амплификация из культивируемых клеток дает более низкие показатели ADO.
Предпочтительное усиление
«Предпочтительное усиление» - это чрезмерное усиление одного из аллелей по сравнению с другим. Большинство исследований MDA сообщают об этой проблеме. В настоящее время наблюдается случайная ошибка амплификации. Это может повлиять на анализ небольших участков геномной ДНК при идентификации аллелей коротких тандемных повторов (STR).
Праймер-праймерные взаимодействия
Эндогенное независимое от матрицы взаимодействие праймер-праймер обусловлено случайным дизайном гексамерных праймеров. Одним из возможных решений является создание ограниченно-рандомизированных гексануклеотидных праймеров, которые не подвергаются перекрестной гибридизации.
Приложения
Секвенирование генома одной клетки
Единичные клетки некультивируемых бактерий, архей и протистов, а также отдельные вирусные частицы и одиночные грибковый споры секвенированы с помощью MDA.[8][9][10][11][12][13][14][15][16][17][18]
Способность секвенировать отдельные клетки также полезна в борьбе с болезнями человека. Геномы отдельных эмбриональных клеток человека были успешно амплифицированы для секвенирования с использованием MDA, что позволило предимплантационная генетическая диагностика (PGD): скрининг на генетические проблемы со здоровьем на ранней стадии эмбрион перед имплантация.[19] Заболевания с неоднородный свойства, такие как рак, также извлекают выгоду из способности секвенирования генома на основе MDA изучать мутации в отдельных клетках.
Продукты MDA из одной клетки также успешно использовались в сравнительная геномная гибридизация эксперименты, которые обычно требуют относительно большого количества амплифицированной ДНК.
Иммунопреципитация хроматина
Иммунопреципитация хроматина приводит к получению сложных смесей относительно коротких фрагментов ДНК, которые сложно амплифицировать с помощью MDA, не вызывая смещения в представлении фрагментов. Был предложен способ обхода этой проблемы, который основан на превращении этих смесей в кольцевые конкатемеры с использованием лигирования с последующим применением MDA, опосредованного ДНК-полимеразой Ф29.[20]
Криминалистический анализ
Количество следов образцов, взятых с мест преступления, может быть увеличено с помощью MDA до количества, достаточного для судебно-медицинского анализа ДНК, который обычно используется для идентификации жертв и подозреваемых.
Смотрите также
Рекомендации
- ^ Бланко Л., Бернад А., Ласаро Дж. М., Мартин Дж., Гармендиа С., Салас М. (1989). «Высокоэффективный синтез ДНК ДНК-полимеразой фага phi 29. Симметричный режим репликации ДНК». Журнал биологической химии. 264 (15): 8935–40. PMID 2498321.
- ^ Тиндалл К.Р., Кункель Т.А. (1988). «Верность синтеза ДНК ДНК-полимеразой Thermus aquaticus». Биохимия. 27 (16): 6008–13. Дои:10.1021 / bi00416a027. PMID 2847780.
- ^ Hutchison, C.A .; Смит, Х.о .; Pfannkoch, C; Вентер, JC (2005). «Бесклеточное клонирование с использованием ДНК-полимеразы φ29». Труды Национальной академии наук. 102 (48): 17332–6. Bibcode:2005PNAS..10217332H. Дои:10.1073 / pnas.0508809102. ЧВК 1283157. PMID 16286637.
- ^ а б Паез Дж. Г., Лин М., Бероухим Р., Ли Дж. К., Чжао Х, Рихтер Д. Д., Габриэль С., Герман П., Сасаки Г., Альтшулер Д., Ли С., Мейерсон М., Продавцы В. Р. (2004). «Покрытие генома и точность последовательности полногеномной амплификации на основе полимеразы phi29». Исследования нуклеиновых кислот. 32 (9): e71. Дои:10.1093 / nar / gnh069. ЧВК 419624. PMID 15150323.
- ^ Эстебан Дж. А., Салас М., Бланко Л. (1993). «Верность ДНК-полимеразы phi 29. Сравнение инициации, примированной белком, и полимеризации ДНК». Журнал биологической химии. 268 (4): 2719–26. PMID 8428945.
- ^ Вертел; Le Caignec, C; Де Рик, М; Ван Хот, Л; Ван Штайртегем, А; Либаерс, I; Проповедь, К. (2006). «Полногеномная амплификация множественного смещения из отдельных клеток». Протоколы природы. 1 (4): 1965–70. Дои:10.1038 / nprot.2006.326. PMID 17487184. S2CID 33346321.
- ^ Брэдли, Уорд, Ярборо (2012). «Показатели выпадения аллелей при усилении множественного смещения». Прикладные биомолекулярные методы. 84 (51): 341–362.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Чжан; Мартини, AC; Реппас, Н.Б .; Барри, кВт; Малек, Дж; Чисхолм, ЮЗ; Церковь, GM (2006). «Секвенирование геномов отдельных клеток путем клонирования полимеразы». Природа Биотехнологии. 24 (6): 680–6. Дои:10.1038 / nbt1214. PMID 16732271. S2CID 2994579.
- ^ Степанаускас, Рамунас; Серацки, Майкл Э. (22 мая 2007 г.). «Соответствие филогении и метаболизма некультивируемых морских бактерий, по одной клетке за раз». Труды Национальной академии наук. 104 (21): 9052–9057. Bibcode:2007PNAS..104.9052S. Дои:10.1073 / pnas.0700496104. ISSN 0027-8424. ЧВК 1885626. PMID 17502618.
- ^ Юн, Хван Су; Прайс, Дана С .; Степанаускас, Рамунас; Rajah, Veeran D .; Sieracki, Michael E .; Уилсон, Уильям Х .; Ян, Ын Чан; Даффи, Сиобейн; Бхаттачарья, Дебашиш (06.05.2011). «Одноклеточная геномика выявляет органические взаимодействия у некультивируемых морских протистов». Наука. 332 (6030): 714–717. Bibcode:2011Научный ... 332..714Y. Дои:10.1126 / science.1203163. ISSN 0036-8075. PMID 21551060. S2CID 34343205.
- ^ Свон, Брэндон К .; Мартинес-Гарсия, Мануэль; Престон, Кристина М .; Щирба, Александр; Войке, Таня; Лами, Доминик; Рейнталер, Томас; Поултон, Николь Дж .; Масланд, Э. Дашиелл П. (02.09.2011). «Возможность хемолитоавтотрофии среди повсеместных линий бактерий в Темном океане». Наука. 333 (6047): 1296–1300. Bibcode:2011Научный ... 333.1296S. Дои:10.1126 / science.1203690. ISSN 0036-8075. PMID 21885783. S2CID 206533092.
- ^ Войке, Таня; Се, Гэри; Коупленд, Алекс; González, José M .; Хан, Клифф; Поцелуй, Хайналка; Пила, Джимми Х .; Сенин, Павел; Ян, Чи (2009-04-23). «Сборка морского метагенома, по одной клетке за раз». PLOS ONE. 4 (4): e5299. Bibcode:2009PLoSO ... 4.5299 Вт. Дои:10.1371 / journal.pone.0005299. ISSN 1932-6203. ЧВК 2668756. PMID 19390573.
- ^ Свон, Брэндон К .; Таппер, Бен; Щирба, Александр; Lauro, Federico M .; Мартинес-Гарсия, Мануэль; González, José M .; Ло, Хайвэй; Райт, Джоди Дж .; Лэндри, Захари К. (09.07.2013). «Преобладающая оптимизация генома и широтная дивергенция планктонных бактерий на поверхности океана». Труды Национальной академии наук. 110 (28): 11463–11468. Bibcode:2013ПНАС..11011463С. Дои:10.1073 / pnas.1304246110. ISSN 0027-8424. ЧВК 3710821. PMID 23801761.
- ^ Ринке, Кристиан; Швентек, Патрик; Щирба, Александр; Иванова Наталья Н .; Андерсон, Иэн Дж .; Ченг, Ян-Фанг; Дорогой, Аарон; Малфатти, Стефани; Свон, Брэндон К. (июль 2013 г.). «Понимание филогении и кодирующего потенциала микробной темной материи». Природа. 499 (7459): 431–437. Bibcode:2013Натура.499..431р. Дои:10.1038 / природа12352. ISSN 0028-0836. PMID 23851394.
- ^ Каштан, Надав; Roggensack, Sara E .; Родриг, Себастьен; Томпсон, Джесси В .; Биллер, Стивен Дж .; Коу, Эллисон; Дин, Хуйминь; Марттинен, Пекка; Мальмстрем, Рекс Р. (25 апреля 2014 г.). «Одноклеточная геномика выявляет сотни сосуществующих субпопуляций дикого прохлорококка». Наука. 344 (6182): 416–420. Bibcode:2014Наука ... 344..416K. Дои:10.1126 / science.1248575. HDL:1721.1/92763. ISSN 0036-8075. PMID 24763590. S2CID 13659345.
- ^ Уилсон, Уильям H; Гилг, Илана С; Монируззаман, Мохаммад; Филд, Эрин К. Корень, Сергей; LeCleir, Gary R; Мартинес Мартинес, Хоакин; Поултон, Николь Дж; Свон, Брэндон К. (2017-05-12). «Геномное исследование отдельных гигантских океанических вирусов». Журнал ISME. 11 (8): 1736–1745. Дои:10.1038 / ismej.2017.61. ISSN 1751-7362. ЧВК 5520044. PMID 28498373.
- ^ Степанаускас, Рамунас; Fergusson, Elizabeth A .; Браун, Джозеф; Поултон, Николь Дж .; Таппер, Бен; Лабонте, Джессика М .; Бекрафт, Эрик Д .; Браун, Юлия М .; Пачиадаки, Мария Г. (2017-07-20). «Улучшенное восстановление генома и интегрированный анализ размера отдельных некультивируемых микробных клеток и вирусных частиц». Nature Communications. 8 (1): 84. Bibcode:2017НатКо ... 8 ... 84S. Дои:10.1038 / s41467-017-00128-z. ISSN 2041-1723. ЧВК 5519541. PMID 28729688.
- ^ Пачиадаки, Мария Г .; Синтес, Ева; Бергауэр, Кристин; Браун, Юлия М .; Запись, Николай Р .; Свон, Брэндон К .; Мэтье, Мэри Элизабет; Hallam, Стивен Дж .; Лопес-Гарсия, Purificacion (24 ноября 2017 г.). «Основная роль нитритокисляющих бактерий в фиксации углерода темного океана». Наука. 358 (6366): 1046–1051. Bibcode:2017Научный ... 358.1046P. Дои:10.1126 / science.aan8260. ISSN 0036-8075. PMID 29170234.
- ^ Coskun; Алсмади, О. (2007). «Амплификация всего генома из одной клетки: новая эра для преимплантационной генетической диагностики». Пренатальная диагностика. 27 (4): 297–302. Дои:10.1002 / pd.1667. PMID 17278176.
- ^ Шоаиб; Baconnais, S; Mechold, U; Le Cam, E; Липинский, М; Огрызко, В (2008). «Множественная амплификация замещения сложных смесей фрагментов ДНК». BMC Genomics. 9: 415. Дои:10.1186/1471-2164-9-415. ЧВК 2553422. PMID 18793430.
