Трис (этилендиамин) хлорид кобальта (III) - Tris(ethylenediamine)cobalt(III) chloride
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК трис (этилендиамин) хлорид кобальта | |||
| Другие имена трис (этилендиамин) хлорид кобальта (III) | |||
| Идентификаторы | |||
| Характеристики | |||
| C6ЧАС24N6Cl3Co | |||
| Молярная масса | 345.59 | ||
| Внешность | желто-оранжевое твердое вещество | ||
| Температура плавления | 275 ° С (527 ° F, 548 К) (разлагается) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Трис (этилендиамин) хлорид кобальта (III) является неорганическое соединение с формулой [Co (en)3] Cl3 (где "en" - сокращение от этилендиамин ). Это хлоридная соль координационный комплекс [Co (en)3]3+. Эта трикация была важна в истории координационной химии из-за ее стабильности и стереохимия. Было описано много различных солей. Впервые комплекс описал Альфред Вернер который выделил эту соль в виде игольчатых кристаллов желтого золота.[1]
Синтез и структура
Соединение получают из водного раствора этилендиамина и практически любой соли кобальта (II), такой как хлорид кобальта (II). Раствор продувают воздухом, чтобы окислить комплексы кобальт (II) -этилендиамин до кобальта (III). Реакция протекает с выходом 95%, и трикатион могут быть изолированы с помощью различных анионов. Подробный анализ продуктов крупномасштабного синтеза показал, что одним второстепенным побочным продуктом был [Co (en)2Cl (H2NCH2CH2NH3)] Cl3, который содержит редкий монодентатный этилендиаминный лиганд (протонированный).[2]
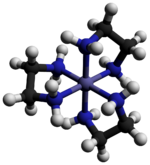
Катион [Co (en)3]3+ является восьмигранный с расстояниями Co-N в диапазоне 1,947–1,981 Å. Углы N-Co-N составляют 85 ° внутри хелатных колец и 90 ° между атомами азота на соседних кольцах.[3]
Стереохимия

Точечная группа этого комплекса - это D3. Комплекс можно разделить на энантиомеры которые обозначаются как Δ и Λ. Обычно разрешение влечет за собой использование тартрат соли.[4] Оптическое разрешение - стандартная составляющая курсов неорганического синтеза.[5] Из-за непланарности MN2C2 кольца могут принимать одно из двух конформации, которые обозначаются символами λ и δ. Регистр между этими кольцевыми конформациями и абсолютной конфигурацией металлических центров описывается номенклатурой lel (когда основная цепь en лежит параллельно C3 ось симметрии) или ob (когда позвоночник en находится напротив того же C3 ось). Таким образом, следующие диастереомерный конформации можно идентифицировать: Δ- (лель)3, Δ- (lel)2(об), Δ- (lel) (об)2, а Δ- (ob)3. Разумеется, существуют и зеркальные изображения этих видов.[6]
Увлажняет
Катионные координационные комплексы аммиак и алкил амины обычно кристаллизуются с водой в решетка, а стехиометрия может зависеть от условий кристаллизации и, в случае хиральных комплексов, от оптической чистоты катиона. Рацемический [Co (en)3] Cl3 чаще всего получают в виде ди- или тригидрата. Для оптически чистой соли (+) - [Co (en)3] Cl3· 1,5 ч2О, (+) - [Co (en)3] Cl3· 0,5NaCl · 3H2O и (+) - [Co (en)3] Cl3·ЧАС2O также известны.[3]
Рекомендации
- ^ А. Вернер (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte. 45 (1): 121–130. Дои:10.1002 / cber.19120450116.
- ^ Джек М. Харроуфилд; Марк И. Огден; Брайан В. Скелтон; Аллан Х. Уайт (2005). «Еще раз к Альфреду Вернеру: некоторые тонкости синтеза и изомерии сложных ионов». Comptes Rendus Chimie. 8 (2): 121–128. Дои:10.1016 / j.crci.2004.10.013. HDL:20.500.11937/8231.
- ^ а б Д. Витяк, Дж. К. Кларди и Д. С. Мартин, мл. (1972). «Кристаллическая структура (+) - D-трис (этилендиамин) нитрата кобальта (III)». Acta Crystallographica. B28 (9): 2694–2699. Дои:10.1107 / S056774087200679X.CS1 maint: несколько имен: список авторов (связь)
- ^ Дж. А. Брумхед, Ф. П. Дуайер, Дж. У. Хогарт (1960). Разрешение иона трис (этилендиамин) кобальта (III). Неорганические синтезы. VI. С. 183–186. Дои:10.1002/9780470132371. ISBN 9780470132371.CS1 maint: использует параметр авторов (связь)
- ^ Girolami, G.S .; Раухфус, Т. Б. и Анджеличи, Р. Дж., Синтез и техника в неорганической химии, Университетские научные книги: Милл-Вэлли, Калифорния, 1999 ISBN 0-935702-48-2
- ^ фон Зелевский, А. "Стереохимия координационных соединений" Джон Вили: Чичестер, 1995 ISBN 047195599X.