Газовый пузырек - Википедия - Gas vesicle
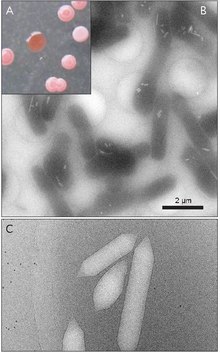
Газовые пузырьки, также известный как газовые вакуоли, являются нанокомплексами в определенных прокариотический организмы, которые помогают в плавучести.[1] Газовые пузырьки полностью состоят из белок; липидов и углеводов не обнаружено.
Функция
Газовые везикулы встречаются в основном у водных организмов, поскольку они используются для модуляции клеточного плавучесть и изменить положение ячейки в толще воды, чтобы ее можно было оптимально расположить для фотосинтез или переместитесь в места с большим или меньшим количеством кислорода.[1] Организмы, которые могут плавать к границе раздела воздух-жидкость, конкурируют с другими аэробами, которые не могут подняться в толще воды, за счет использования кислорода в верхнем слое.
Кроме того, газовые пузырьки можно использовать для поддержания оптимальной солености путем размещения организма в определенных местах в многослойном водоеме для предотвращения осмотический шок.[2] Высокая концентрация растворенного вещества приведет к тому, что вода будет вытягиваться из ячейки осмос, вызывая лизис клеток. Способность синтезировать газовые везикулы - одна из многих стратегий, которые позволяют галофильным организмам переносить среду с высоким содержанием соли.
Эволюция
Газовые везикулы, вероятно, являются одним из самых ранних механизмов подвижности микроскопических организмов из-за того, что это наиболее распространенная форма подвижности, сохраняющаяся в геноме прокариот, некоторые из которых возникли около 3 миллиардов лет назад.[3][4]Режимы активной подвижности, такие как движение жгутиков, требуют механизма, который мог бы преобразовывать химическую энергию в механическую, и, следовательно, намного более сложен и развился бы позже. Функции газовых пузырьков также в значительной степени сохраняются у разных видов, хотя способ регуляции может отличаться, что указывает на важность газовых пузырьков как формы подвижности. В определенных организмах, таких как энтеробактерии Серратия sp. Подвижность на основе жгутиков и образование газовых пузырьков регулируются противоположным образом одним РНК-связывающим белком, RsmA, что указывает на альтернативные способы адаптации к окружающей среде, которые развились бы в разные таксоны посредством регулирования развития между подвижностью и флотацией.[5]
Хотя есть доказательства, указывающие на раннюю эволюцию газовых везикул, перенос плазмиды служит альтернативным объяснением широко распространенной и консервативной природы органелл.[4] Расщепление плазмиды в Галобактерии галобиум привело к потере способности биосинтезировать газовые везикулы, что указывает на возможность горизонтальный перенос генов, что может привести к передаче способности продуцировать газовые пузырьки между разными штаммами бактерий.[6]
Структура

Газовые везикулы обычно представляют собой полые белковые трубочки лимонной или цилиндрической формы с коническими крышками на обоих концах. Везикулы больше всего различаются по диаметру. Везикулы большего размера могут удерживать больше воздуха и использовать меньше белка, что делает их наиболее экономичными с точки зрения использования ресурсов, однако, чем больше везикула, тем структурно слабее она находится под давлением и тем меньшее давление требуется, прежде чем везикула схлопнется. Организмы эволюционировали, чтобы быть наиболее эффективными в использовании белка и использовать везикулы самого большого максимального диаметра, которые выдерживают давление, которому может подвергаться организм. Чтобы естественный отбор повлиял на газовые везикулы, диаметр пузырьков должен контролироваться генетикой, хотя гены, кодирующие газовые везикулы, обнаружены у многих видов животных. галоархеи, только несколько видов производят их. Первый ген газового пузырька галоархей, GvpA был клонирован из Halobacterium sp. NRC-1.[7] 14 генов участвуют в формировании газовых пузырьков у галоархей.[8]
Первый ген газовых везикул, GvpA, был идентифицирован у Calothrix.[9] Есть по крайней мере два белка, которые составляют газовую везикулу цианобактерий: GvpA и GvpC. GvpA образует ребра и большую часть массы (до 90%) основной структуры. GvpA сильно гидрофобен и может быть одним из наиболее известных гидрофобных белков. GvpC является гидрофильным и помогает стабилизировать структуру за счет периодических включений в ребра GvpA. GvpC способен вымываться из везикулы и, как следствие, уменьшать прочность везикулы. Толщина стенки везикулы может составлять от 1,8 до 2,8 нм. Ребристая структура пузырька заметна как на внутренней, так и на внешней поверхности с расстоянием между ребрами 4–5 нм. Везикулы могут иметь длину 100–1400 нм и диаметр 45–120 нм.
Размеры газовых пузырьков внутри одного вида относительно однородны со стандартным отклонением ± 4%.
Рост
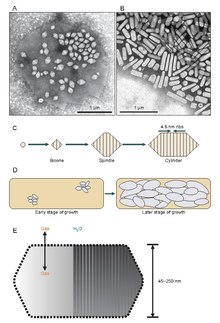
Похоже, что газовые везикулы начинают свое существование как небольшие биконические (два конуса с соединенными вместе плоскими основаниями) структуры, которые увеличиваются до определенного диаметра, чем увеличиваются и увеличиваются в длину. Точно неизвестно, что контролирует диаметр, но это может быть молекула, которая мешает GvpA, или форма GvpA может измениться.
Регулирование
Формирование газовых пузырьков регулируется двумя белками Gvp: GvpD, который подавляет экспрессию белков GvpA и GvpC, и GvpE, который индуцирует экспрессию.[10] Внеклеточные факторы окружающей среды также влияют на образование везикул, либо регулируя продукцию белка Gvp, либо напрямую нарушая структуру везикул.[8][11]
Интенсивность света
Было обнаружено, что интенсивность света по-разному влияет на образование и поддержание газовых пузырьков у разных бактерий и архей. За Anabaena flos-aquae, более высокая интенсивность света приводит к коллапсу пузырьков из-за повышения тургорного давления и большего накопления продуктов фотосинтеза. У цианобактерий образование пузырьков снижается при высокой интенсивности света из-за воздействия на бактериальную поверхность УФ-излучения, которое может повредить бактериальный геном.[11]
Углеводов
Накопление глюкозы, мальтозы или сахарозы в Haloferax mediterranei и Haloferax volcanii было обнаружено, что они ингибируют экспрессию белков GvpA и, следовательно, снижение продукции газовых пузырьков. Однако это происходило только на ранней стадии экспоненциального роста клетки. Образование пузырьков также может быть вызвано снижением внеклеточной концентрации глюкозы.[12]
Кислород
Было обнаружено, что недостаток кислорода отрицательно влияет на образование газовых пузырьков у галофильных архей. Halobacterium salinarum в анаэробных условиях продуцируют мало или не образуют везикул из-за снижения синтеза транскриптов мРНК, кодирующих белки Gvp. H. mediterranei и H. volcanii не образуют везикул в условиях аноксии из-за уменьшения синтезированных транскриптов, кодирующих GvpA, и усеченных транскриптов, экспрессирующих GvpD.[12]
pH
Было обнаружено, что повышенные уровни внеклеточного pH увеличивают образование пузырьков у видов Microcytis. При повышенном pH уровень gvpA и gvpC количество транскриптов увеличивается, что позволяет более активно взаимодействовать с рибосомами для экспрессии и приводит к усилению регуляции белков Gvp. Это может быть связано с большей транскрипцией этих генов, уменьшением распада синтезированных транскриптов или более высокой стабильностью мРНК.[13]
Ультразвуковое облучение
Было обнаружено, что ультразвуковое облучение с определенной частотой разрушает пузырьки газа у цианобактерий. Spirulina platensis, не давая им зацвести.[14]
Проверка кворума
В энтеробактерии; Serratia sp. штамм ATCC39006газовая везикула образуется только при достаточной концентрации сигнальной молекулы, N-ацилгомосеринлактон. В этом случае проверка кворума Молекула N-ацилгомосеринлактон действует как морфоген, инициирующий развитие органелл.[5] Это выгодно для организма, поскольку ресурсы для производства газовых пузырьков используются только тогда, когда существует ограничение по кислороду, вызванное увеличением бактериальной популяции.
Роль в разработке вакцины
Ген газовых пузырьков gvpC от Halobacterium sp. используется в качестве системы доставки для исследований вакцин.
Некоторые характеристики белка, кодируемого геном газовых везикул gvpC позволяют использовать его в качестве носителя и адъюванта для антигенов: он стабилен, устойчив к биологической деградации, выдерживает относительно высокие температуры (до 50 ° C) и непатоген для человека.[15] Несколько антигенов от различных патогенов человека были рекомбинированы в gvpГен C для создания субъединичных вакцин с длительным иммунологическим ответом.[16]
Различные сегменты генома, кодирующие несколько Хламидия трахоматис белки патогена, включая MOMP, OmcB и PompD, присоединяются к gvpC ген Галобактерии. В пробирке оценки клеток показывают экспрессию генов Chlamydia на поверхности клеток с помощью методов воображения и показывают характерные иммунологические ответы, такие как активность TLR и продукция провоспалительных цитокинов.[17] Ген газовых везикул можно использовать в качестве средства доставки для создания потенциальной вакцины против хламидиоза. Ограничения этого метода включают необходимость минимизировать повреждение самого белка GvpC, включая при этом как можно больше целевого гена вакцины в gvpСегмент гена.[17]
В аналогичном эксперименте используется тот же ген газового пузырька и Salmonella enterica патогенами секретируемый инозинфосфатный эффекторный белок SopB4 и SopB5 для создания потенциального вектора для вакцины. Иммунизированные мыши секретируют провоспалительные цитокины IFN-γ, IL-2 и IL-9. Также обнаруживаются антитела IgG. После заражения инфекцией в собранных органах, таких как селезенка и печень, не было обнаружено никаких бактерий или было обнаружено значительно меньшее количество бактерий. Потенциальные вакцины, использующие газовые везикулы в качестве демонстрации антигена, можно вводить через слизистую оболочку в качестве альтернативного пути введения, увеличивая их доступность для большего числа людей и вызывая более широкий диапазон иммунных ответов в организме.[15]

Роль как контрастных агентов и репортерных генов
Газовые везикулы обладают несколькими физическими свойствами, которые делают их видимыми на различных медицинская визуализация модальности.[18] Способность газовых пузырьков рассеивать свет десятилетиями использовалась для оценки их концентрации и измерения давления их коллапса. Оптический контраст газовых везикул также позволяет им служить контрастными агентами в оптической когерентной томографии, с приложениями в офтальмология.[19] Разница в акустический импеданс между газом в их ядрах и окружающей жидкостью образует газовые пузырьки, надежные акустический контраст.[20] Более того, способность оболочек некоторых газовых пузырьков изгибаться генерирует гармонические ультразвуковые эхо, которые улучшают соотношение контрастности и ткани.[21] Наконец, газовые везикулы можно использовать в качестве контрастных агентов для магнитно-резонансная томография (МРТ), полагаясь на разницу между магнитная восприимчивость воздуха и воды.[22] Возможность неинвазивного коллапса газовых пузырьков с помощью волн давления обеспечивает механизм стирания их сигнала и улучшения их контраста. Вычитание изображений до и после акустического коллапса может устранить фоновые сигналы, улучшая обнаружение газовых пузырьков.
Гетерологичная экспрессия газовых пузырьков у бактериальных[23] и млекопитающие[24] ячейки позволили использовать их в качестве первого семейства акустических репортерные гены.[25] Пока флуоресцентный репортерные гены, такие как зеленый флуоресцентный белок (GFP) широко использовались в биологии, их in vivo приложения ограничены Глубина проникновения света в ткани, обычно несколько миллиметров. Люминесценция могут быть обнаружены глубже в ткани, но имеют низкое пространственное разрешение. Гены акустического репортера обеспечивают субмиллиметровую Пространственное разрешение и глубина проникновения в несколько сантиметров, что позволяет in vivo изучение биологических процессов глубоко внутри ткани.
Рекомендации
- ^ а б Уолсби А.Е. (март 1994 г.). «Газовые пузырьки». Микробиологические обзоры. 58 (1): 94–144. Дои:10.1128 / ммбр.58.1.94-144.1994. ЧВК 372955. PMID 8177173.
- ^ Speth DR, Lagkouvardos I, Wang Y, Qian PY, Dutilh BE, Jetten MS (июль 2017 г.). «Проект генома Scalindua rubra, полученный на границе раздела над глубоководным рассолом Discovery в Красном море, проливает свет на возможные стратегии адаптации бактерий Anammox к соли». Микробная экология. 74 (1): 1–5. Дои:10.1007 / s00248-017-0929-7. ЧВК 5486813. PMID 28074246.
- ^ Шварц RM, Dayhoff MO (январь 1978 г.). «Происхождение прокариот, эукариот, митохондрий и хлоропластов». Наука. 199 (4327): 395–403. Bibcode:1978Sci ... 199..395S. Дои:10.1126 / наука.202030. PMID 202030.
- ^ а б Стейли Дж. Т. (июнь 1980 г.). «Газовая вакуоль: ранняя органелла подвижности прокариот?». Истоки Жизни. 10 (2): 111–116. Bibcode:1980OrLi ... 10..111S. Дои:10.1007 / BF00928662. S2CID 30889661.
- ^ а б Рамзи Дж. П., Уильямсон Н. Р., Весна Д. Р., Салмонд Гран-при (сентябрь 2011 г.). «Молекула, чувствительная к кворуму, действует как морфоген, контролирующий биогенез органелл газовых пузырьков и адаптивную флотацию в энтеробактериях». Труды Национальной академии наук Соединенных Штатов Америки. 108 (36): 14932–7. Bibcode:2011PNAS..10814932R. Дои:10.1073 / pnas.1109169108. ЧВК 3169117. PMID 21873216.
- ^ Weidinger G, Klotz G, Goebel W (июль 1979 г.). «Большая плазмида из Halobacterium halobium, несущая генетическую информацию для образования газовой вакуоли». Плазмида. 2 (3): 377–86. Дои:10.1016 / 0147-619x (79) 90021-0. PMID 482428.
- ^ DasSarma S, Damerval T, Jones JG, Tandeau de Marsac N (ноябрь 1987 г.). «Кодируемый плазмидой ген белка газовых везикул в галофильных архебактериях». Молекулярная микробиология. 1 (3): 365–70. Дои:10.1111 / j.1365-2958.1987.tb01943.x. PMID 3448465.
- ^ а б Пфейфер Ф (февраль 2015 г.). «Галоархеи и образование газовых пузырьков». Жизнь. 5 (1): 385–402. Дои:10.3390 / life5010385. ЧВК 4390858. PMID 25648404.
- ^ Тандо де Марсак Н., Мазель Д., Брайант Д.А., Хумар Дж. (Октябрь 1985 г.). «Молекулярное клонирование и нуклеотидная последовательность гена, регулируемого развитием, из цианобактерии Calothrix PCC 7601: ген белка газовых везикул». Исследования нуклеиновых кислот. 13 (20): 7223–36. Дои:10.1093 / nar / 13.20.7223. ЧВК 322040. PMID 2997744.
- ^ Крюгер К., Пфейфер Ф (июль 1996 г.). «Транскрипционный анализ области c-vac и дифференциальный синтез двух регуляторных белков газовых везикул GvpD и GvpE в Halobacterium salinarium PHH4». Журнал бактериологии. 178 (14): 4012–9. Дои:10.1128 / jb.178.14.4012-4019.1996. ЧВК 178154. PMID 8763925.
- ^ а б Оливер Р.Л., Уолсби А.Е. (1 июля 1984 г.). «Прямые доказательства роли опосредованного светом коллапса газовых пузырьков в регуляции плавучести Anabaena flos-aquae (цианобактерии) 1». Лимнология и океанография. 29 (4): 879–886. Bibcode:1984LimOc..29..879O. Дои:10.4319 / lo.1984.29.4.0879. ISSN 1939-5590.
- ^ а б Hechler T, Pfeifer F (январь 2009 г.). «Анаэробиоз подавляет образование газовых пузырьков у галофильных архей». Молекулярная микробиология. 71 (1): 132–45. Дои:10.1111 / j.1365-2958.2008.06517.x. PMID 19007418.
- ^ Гао Х, Чжу Т., Сюй М., Ван С., Сюй Х, Конг Р. (сентябрь 2016 г.). «pH-зависимое образование газовых пузырьков у Microcystis». Письма FEBS. 590 (18): 3195–201. Дои:10.1002/1873-3468.12370. PMID 27543911.
- ^ Хао Х, Ву М, Чен И, Тан Дж, Ву Ку (2004-12-27). «Контроль цветения цианобактерий с помощью ультразвукового облучения при 20 кГц и 1,7 МГц». Журнал экологической науки и здоровья. Часть A, Токсичные / опасные вещества и экологическая инженерия. 39 (6): 1435–46. Дои:10.1081 / ESE-120037844. PMID 15244327. S2CID 41996617.
- ^ а б ДасСарма П., Неги В.Д., Балакришнан А., Ким Дж. М., Каран Р., Чакравортти Д., ДасСарма С. (01.01.2015). «Антигены сальмонелл как новый подход к разработке вакцины». Процедуры в вакцинологии. Процедура 8-го Конгресса по вакцинам и независимым вирусам, Филадельфия, США, 2015 г. 9 (Дополнение C): 16–23. Дои:10.1016 / j.provac.2015.05.003. ЧВК 4758358. PMID 26900411.
- ^ Стюарт Е.С., Моршед Ф., Сремак М., ДасСарма С. (июнь 2001 г.). «Презентация антигена с использованием новых органелл в виде частиц из галофильных архей». Журнал биотехнологии. 88 (2): 119–28. Дои:10.1016 / с0168-1656 (01) 00267-х. PMID 11403846.
- ^ а б Чайлдс Т.С., Уэбли В.К. (сентябрь 2012 г.). «Оценка in vitro пузырьков газа галобактерий как средства отображения и доставки вакцины против хламидии». Вакцина. 30 (41): 5942–8. Дои:10.1016 / j.vaccine.2012.07.038. PMID 22846397.
- ^ Мареска Д., Лакшманан А., Абеди М., Бар-Зион А., Фархади А., Лу Г. Дж. И др. (Июнь 2018). «Биомолекулярный ультразвук и соногенетика». Ежегодный обзор химической и биомолекулярной инженерии. 9 (1): 229–252. Дои:10.1146 / annurev-chembioeng-060817-084034. ЧВК 6086606. PMID 29579400.
- ^ Лу Г.Дж., Чжоу Л.Д., Малунда Д., Патель А.К., Велсби Д.С., Чао Д.Л., Рамалингам Т., Шапиро М.Г. (31.03.2019). «Биомолекулярные контрастные агенты для оптической когерентной томографии». bioRxiv. Дои:10.1101/595157. S2CID 133072739.
- ^ Шапиро М.Г., Гудвилл П.В., Неоги А., Инь М., Фостер Ф.С., Шаффер Д.В., Конолли С.М. (апрель 2014 г.). «Биогенные газовые наноструктуры как ультразвуковые молекулярные репортеры». Природа Нанотехнологии. 9 (4): 311–6. Bibcode:2014НатНа ... 9..311С. Дои:10.1038 / nnano.2014.32. ЧВК 4023545. PMID 24633522.
- ^ Maresca D, Lakshmanan A, Lee-Gosselin A, Melis JM, Ni YL, Bourdeau RW и др. (Февраль 2017). «Нелинейное ультразвуковое изображение наноразмерных акустических биомолекул». Письма по прикладной физике. 110 (7): 073704. Bibcode:2017АпФЛ.110г3704М. Дои:10.1063/1.4976105. ЧВК 5315666. PMID 28289314.
- ^ Лу Г.Дж., Фархади А., Сабловски Дж.О., Ли-Госселин А., Барнс С.Р., Лакшманан А. и др. (Май 2018). «Акустически модулированная магнитно-резонансная томография газонаполненных белковых наноструктур». Материалы Природы. 17 (5): 456–463. Bibcode:2018НатМа..17..456Л. Дои:10.1038 / s41563-018-0023-7. ЧВК 6015773. PMID 29483636.
- ^ Бурдо Р.В., Ли-Госселин А., Лакшманан А., Фархади А., Кумар С.Р., Нети С.П., Шапиро М.Г. (январь 2018 г.). «Акустические репортерные гены для неинвазивной визуализации микроорганизмов у млекопитающих-хозяев». Природа. 553 (7686): 86–90. Bibcode:2018Натура 553 ... 86Б. Дои:10.1038 / природа25021. ЧВК 5920530. PMID 29300010.
- ^ Фархади А., Хо Г. Х., Сойер Д. П., Бурдо Р. В., Шапиро М. Г. (сентябрь 2019 г.). «Ультразвуковая визуализация экспрессии генов в клетках млекопитающих». Наука. 365 (6460): 1469–1475. Bibcode:2019Научный ... 365.1469F. Дои:10.1126 / science.aax4804. ЧВК 6860372. PMID 31604277.
- ^ Hill AM, Salmond GP (апрель 2020 г.). «Микробные газовые везикулы как инструменты нанотехнологии: использование внутриклеточных органелл для использования в биотехнологиях, медицине и окружающей среде». Микробиология. 166 (6): 501–509. Дои:10.1099 / мик. 0.000912. ЧВК 7376271. PMID 32324529.
