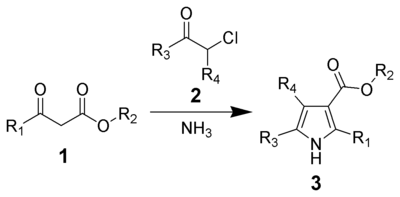
Синтез пиррола по Ганцу - Hantzsch pyrrole synthesis
В Синтез пиррола по Ганче, названный в честь Артур Рудольф Ганч, это химическая реакция β-кетоэфиров (1) с аммиак (или первичный амины ) и α-галокетоны (2) дать замененный пирролы (3).[1][2] Пирролы встречаются во множестве натуральные продукты с биологической активностью, поэтому синтез замещенных пирролов имеет важные применения в медицинской химии.[3][4] Существуют альтернативные методы синтеза пирролов, такие как Синтез пиррола Knorr и Синтез Паала-Кнорра.
Механизм
Ниже приведен один опубликованный механизм реакции:[5]

Механизм начинается с амина (1) атакующий β-углерод β-кетоэфиров (2), и в конечном итоге формируя енамин (3). Затем енамин атакует карбонил углерод α-галогенкетона (4). Затем следует потеря H2О, давая я добываю (5). Этот интермедиат подвергается внутримолекулярной нуклеофильной атаке, образуя 5-членное кольцо (6). Наконец, водород удаляется, а пи-связи перестраиваются в кольце, давая конечный продукт (7).
Был предложен альтернативный механизм, в котором енамин (3) атакует α-углерод α-галогенкетона (4) как часть нуклеофильного замещения вместо атаки на карбонильный углерод.[6]
Обобщенная реакция в механохимических условиях.
Обобщение синтеза пиррола по Ганче было разработано Эстевесом и др.[7] В этой реакции высокозамещенные пирролы могут быть синтезированы в однореакторной реакции с относительно высокими выходами (60% - 97%). Эта реакция включает высокоскоростное вибрационное измельчение (HSVM) кетонов с N-иодосукцинимид (NIS) и п-толуолсульфоновая кислота, с образованием α-иодокетона на месте. За этим следует добавление первичного амина, β-дикарбонильного соединения, нитрат церия (IV) и аммония (CAN) и нитрат серебра, как показано на схеме ниже:

Приложения
2,3-дикарбонилированные пирролы
2,3-дикарбонилированные пирролы могут быть синтезированы с помощью одного из вариантов синтеза пиррола по Ганцу.[8] Эти пирролы особенно полезны для полного синтеза, поскольку карбонильные группы могут быть превращены во множество других функциональных групп.

Замещенные индолы
Реакция также может происходить между енамином и α-галогенкетоном с образованием замещенного индолы, которые также имеют биологическое значение.[6][9]

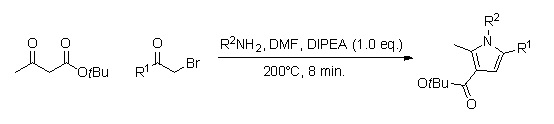
Химия непрерывного потока
Библиотеку замещенных аналогов пиррола можно быстро получить, используя химия непрерывного потока (время реакции около 8 мин.).[10] Преимущество использования этого метода по сравнению с синтезом в колбе состоит в том, что он не требует обработки и очистки нескольких промежуточных продуктов и, следовательно, может привести к более высокому процентному выходу.
Смотрите также
Рекомендации
- ^ Гантч, А. Бер. 1890, 23, 1474.
- ^ Файст, Ф. Бер. 1902, 35, 1538.
- ^ Ферстнер, А. Энгью. Chem. Int. Эд. 2003, 42¸ 3582-3603.
- ^ Леонарди, Марко; Эстевес, Вероника; Вильякампа, Мерседес; Менендес, Дж. (Февраль 2019 г.). «Синтез пиррола по Ганче: нетрадиционные варианты и приложения забытой классической реакции». Синтез. 51 (4): 816–828. Дои:10.1055 / с-0037-1610320. ISSN 0039-7881.
- ^ Ли, Дж. Дж. Название Реакции; 4-е изд .; Springer-Verlag: Берлин, Германия, 2009 г .; п. 276.
- ^ а б Ван, Зеронг. Комплексные реакции на органические названия и реагенты, набор из 3 объемов; John Wiley & Sons, Хобокен, Нью-Джерси, 2009 г .; С. 1326-1327.
- ^ Эстевес, В .; Villacampa, M .; Менендес, Дж. Chem. Commun. 2012, 49, 591-593.
- ^ Moss, T.A .; Новак, Т. Tetrahedron Lett. 2012, 53, 3056-3060.
- ^ Джонс, К.Д .; Суарес, Т. J. Org. Chem. 1972, 37, 3622-3623.
- ^ Herath, A .; Cosford, N.D.P. Орг. Lett. 2010, 12, 5182-5185.
