Синтез пиррола Knorr - Knorr pyrrole synthesis
| Синтез пиррола Knorr | |
|---|---|
| Названный в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000497 |
В Синтез пиррола Knorr широко используется химическая реакция который синтезирует замещенный пирролы (3).[1][2][3] Метод включает реакцию α-амино- -кетон (1) и соединение, содержащее электроноакцепторную группу (например, сложный эфир, как показано) от α до карбонильная группа (2).[4]

Метод
Механизм требует цинка и уксусной кислоты в качестве катализаторов. Это будет происходить при комнатной температуре. Поскольку α-амино-кетоны очень легко самоконденсируются, их необходимо приготовить. на месте. Обычный способ сделать это из соответствующего оксим, через Перестановка Небера.[5][6]
В исходном синтезе Кнорра использовались два эквивалента этилацетоацетат, один из которых был преобразован в этил 2-оксиминоацетоацетат путем растворения его в ледяная уксусная кислота, и медленно добавляя один эквивалент насыщенного водного нитрат натрия, при внешнем охлаждении. Цинк затем примешивали пыль, уменьшая оксим группу к амину. Это восстановление потребляет два эквивалента цинка и четыре эквивалента уксусной кислоты.
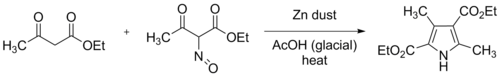
Современная практика заключается в постепенном добавлении раствора оксима, полученного в результате нитрозирования, и цинковой пыли к хорошо перемешанному раствору этилацетоацетата в ледяной уксусной кислоте. Реакция экзотермический, и смесь может достичь точки кипения, если не применять внешнее охлаждение. Полученный продукт, диэтил-3,5-диметилпиррол-2,4-дикарбоксилат, был назван Пиррол Кнорра с тех пор. На схеме выше R2 = COOEt, а R1 = R3 = Меня представляют эту оригинальную реакцию.
Пиррол Кнорра может быть получен различными способами. Один эквивалент едкий натр будет селективно омылять 2-эфир. Растворение пиррола Кнорра в концентрированном серная кислота, а затем выливание полученного раствора в воду будет селективно гидролизовать 4-эфирную группу. 5-метильная группа может быть по-разному окислена до хлорметильной, альдегидной или карбоновой кислоты с использованием стехиометрической сульфурилхлорид в ледяной уксусной кислоте.[7] Альтернативно атом азота может быть алкилирован. Две позиции сложного эфира можно более плавно дифференцировать, добавив бензил или же терт-бутил групп через соответствующие эфиры ацетоацетата. Бензильные группы можно удалить каталитическим методом. гидрогенолиз над палладий на углероде, и трет-бутильные группы могут быть удалены обработкой трифторуксусная кислота, или кипящей водной уксусной кислотой. р1 и R3 (а также R2 и "Et") можно варьировать путем применения соответствующих β-кетоэфиров, легко получаемых путем синтеза, происходящего из хлорангидриды, Кислота Мелдрама, и алкоголь по выбору. Сложные этиловые и бензиловые эфиры легко получить, и реакция примечательна тем, что даже сильно затрудненные терт-бутиловый спирт дает очень высокие выходы в этом синтезе.[8]
Леви и Занетти расширили синтез Кнорра в 1894 году на использование ацетилацетон (2,4-пентандион) в реакции с этил-2-оксиминоацетоацетатом. Результатом был этил-4-ацетил-3,5-диметилпиррол-2-карбоксилат, где «OEt» = R1 = R3 = Me и R2 = COOEt.[9] 4-ацетильная группа может быть легко преобразована в 4-этильную группу с помощью Редукция Вольфа-Кишнера (гидразин и щелочь, нагретые); гидрогенолиз или использование диборан. Бензил или терт-бутилацетоацетаты также хорошо работают в этой системе, и при тщательном контроле температуры терт-бутиловая система дает очень высокий выход (около 80%).[10] N,N-диалкилпиррол-2- и / или 4-карбоксамиды могут быть получены с использованием N,N-диалкилацетоацетамиды в синтезе. С помощью этого метода были успешно получены даже тиоэфиры.[11] Что касается нитрозирования β-кетоэфиров, несмотря на многочисленные спецификации в литературе о строгом контроле температуры при нитрозировании, реакция ведет себя почти как титрование, и смеси можно позволить достичь даже 40 ° C без значительного влияния на конечный выход.
Механизм синтеза пиррола Кнорра начинается с конденсации амина и кетона с образованием имина. Имин тогда таутомеризуется до енамина с последующей циклизацией, удалением воды и изомеризацией до пиррола.

Связанный синтез
Существует ряд важных синтезов пирролов, которые работают по принципу синтеза Кнорра, несмотря на наличие механизмов очень разной связи между исходными материалами и пирроловым продуктом.
Ганс Фишер и Эмми Финк обнаружили, что синтез Занетти из 2,4-пентандиона и этил-2-оксиминоацетоацетата дает этил-3,5-диметилпиррол-2-карбоксилат в качестве побочного продукта. Точно так же диэтилацеталь 3-кетобутиральдегида приводил к образованию этил-5-метилпиррол-2-карбоксилата. Оба этих продукта возникли в результате потери ацетильной группы предполагаемого этил-2-аминоацетоацетатного промежуточного соединения. Важным продуктом синтеза Фишера-Финка был этил-4,5-диметилпиррол-2-карбоксилат, полученный из этил-2-оксиминоацетоацетата и 2-метил-3-оксобутаналя, в свою очередь производимый Клейзеновская конденсация из 2-бутанон с этилформиат.[12]
Джордж Кляйнспен сообщил, что связь Фишера-Финка может быть вызвана исключительно использованием диэтилоксиминомалоната в синтезе с 2,4-пентандионом или его 3-алкилзамещенными производными. Урожайность была высокой, около 60%, и этот синтез в конечном итоге стал одним из самых важных в репертуаре.[13] Выходы были значительно улучшены за счет использования предварительно полученного диэтиламиномалоната (полученного гидрогенолизом диэтилоксиминомалоната в этаноле над Pd / C) и добавления смеси диэтиламиномалоната и β-дикетона к активно кипящей ледяной уксусной кислоте.[14]
Тем временем Джонсон расширил синтез Фишера-Финка за счет взаимодействия 2-оксиминоацетоацетатных эфиров (этилового, бензилового или трет-бутилового) с 3-алкилзамещенными 2,4-пентандионами.[15] Синтез Кляйнспена был расширен под Дэвид Дельфин за счет использования несимметричных β-дикетонов (таких как 3-алкилзамещенные 2,4-гександионы), которые предпочтительно сначала реагируют по менее затрудненной ацетильной группе с образованием соответствующих 5-метилпиррол-2-карбоксилатных эфиров. N,NБыло обнаружено, что -диалкил-2-оксиминоацетоацетамиды также дают пирролы при взаимодействии в условиях Кнорра с 3-замещенными-2,4-пентандионами с выходами, сравнимыми с выходами соответствующих сложных эфиров (около 45%). Однако при использовании несимметричных дикетонов было обнаружено, что ацетильная группа из ацетоацетамида сохраняется в продукте, а одна из ацильных групп из дикетона теряется.[16] Этот же механизм в незначительной степени встречается в системах эфиров ацетоацетата и ранее был обнаружен радиохимически Харбаком и Рапопорт.[17] Большинство описанных выше синтезов находят применение в синтезе порфиринов, желчных пигментов и дипирринов.
Рекомендации
- ^ Кнорр, Людвиг (1884). "Synthese von Pyrrolderivaten" [Синтез производных пиррола]. Berichte der deutschen chemischen Gesellschaft (на немецком). 17 (2): 1635–1642. Дои:10.1002 / cber.18840170220.
- ^ Кнорр, Людвиг (1886). "Synthetische Versuche mit dem Acetessigester" [Синтетические эксперименты со сложным эфиром ацетоуксусной кислоты]. Annalen der Chemie (на немецком). 236 (3): 290–332. Дои:10.1002 / jlac.18862360303.
- ^ Кнорр, Л.; Ланге, Х. (1902). "Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen" [Об образовании производных пиррола из изонитрозокетонов]. Berichte der deutschen chemischen Gesellschaft (на немецком). 35 (3): 2998–3008. Дои:10.1002 / cber.19020350392.
- ^ Корвин, Алсоф Генри (1950). «Химия пиррола и его производных». В Элдерфилд, Роберт Кули (ред.). Гетероциклические соединения. 1. Нью-Йорк: Wiley. С. 287 и сл.
- ^ Фишер, Ганс (1935). «2,4-Диметил-3,5-дикарбэтоксипиррол (2,4-пирроледикарбоновая кислота, 3,5-диметил-, диэтиловый эфир)». Органический синтез. 15: 17. Дои:10.15227 / orgsyn.015.0017.; Коллективный объем, 2, п. 202
- ^ Фишер, Ганс (1941). «Криптопиррол (пиррол, 2,4-диметил-3-этил)». Органический синтез. 21: 67. Дои:10.15227 / orgsyn.021.0067.; Коллективный объем, 3, п. 513
- ^ Корвин, Алсоф Н .; Бейли, Уильям А .; Viohl, Пол (1942). "Структурные исследования замещенного дипиррилметана. Необычная связь между симметрией точки плавления". Журнал Американского химического общества. 64 (6): 1267–1273. Дои:10.1021 / ja01258a007.
- ^ Оикава, Юдзи; Сугано, Киёси; Ёнемицу, Осаму (1978). «Кислота Мелдрума в органическом синтезе. 2. Общий и универсальный синтез β-кетоэфиров». Журнал органической химии. 43 (10): 2087–2088. Дои:10.1021 / jo00404a066.
- ^ Zanetti, C.U .; Леви, Э. (1894). "Sintesi di composti pirrolici dai nitrosochetoni" [Синтез пиррольных соединений из нитрозокетонов]. La Gazzetta Chimica Italiana (на итальянском). 24 (1): 546–554.
- ^ Трейбс, Альфред; Хинтермайер, Карл (1954). "терт-Butylester von Pyrrolcarbonsäuren ". Chemische Berichte (на немецком). 87 (8): 1167–1174. Дои:10.1002 / cber.19540870818.
- ^ Bullock, E .; Chen, T. S .; Погрузчик, К. Э. (1966). «Получение и реакции некоторых сложных эфиров пиррилтиола». Канадский химический журнал. 44 (9): 1007–1111. Дои:10.1139 / v66-149.
- ^ Фишер, Ганс; Финк, Эмми (1948). "Über eine neue Pyrrolsynthese" [О новом синтезе пирролов]. Zeitschrift für Physiologische Chemie (на немецком). 283 (3–4): 152–161. Дои:10.1515 / bchm2.1948.283.3-4.152.
- ^ Кляйнспен, Джордж Г. (1955). «Новый путь к некоторым сложным эфирам 2-пирролкарбоновой кислоты и нитрилам». Журнал Американского химического общества. 77 (6): 1546–1548. Дои:10.1021 / ja01611a043.
- ^ Пейн, Джон Б.; Дельфин, Дэвид (1985). «Химия пиррола. Улучшенный синтез эфиров этилпиррол-2-карбоксилата из диэтиламиномалоната». Журнал органической химии. 50 (26): 5598–5604. Дои:10.1021 / jo00350a033.
- ^ Bullock, E .; Johnson, A. W .; Markham, E .; Шоу, К. Б. (1958). «287. Синтез копропорфирина III». Журнал химического общества (возобновлено): 1430–1440. Дои:10.1039 / JR9580001430.
- ^ Пейн, Джон Б.; Бро, Джонатан Р .; Буллер, Кэти К .; Эриксон, Эрика Э .; Дельфин, Д. (1987). «Механизм образования N,N-диалкил-2-пирролкарбоксамиды из 1,3-дикетонов и N,N-диалкилоксиминоацетоацетамиды ». Журнал органической химии. 52 (18): 3993–3997. Дои:10.1021 / jo00227a010.
- ^ Рапопорт, Генри; Харбукт, Джон В. (1971). «Механизм конденсации модифицированного пиррола Кнорра». Журнал органической химии. 36 (6): 853–855. Дои:10.1021 / jo00805a030.
