Кислота Мелдрамса - Википедия - Meldrums acid
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,2-диметил-1,3-диоксан-4,6-дион | |
| Другие имена Изопропилиденмалонат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.016.358 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС8О4 | |
| Молярная масса | 144.126 г · моль−1 |
| Температура плавления | От 94 до 95 ° C (от 201 до 203 ° F, от 367 до 368 K) (разлагается)[1] |
| Кислотность (пKа) | 4.97 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
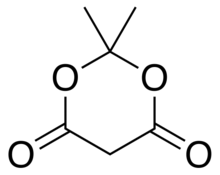
Кислота Мелдрама или же 2,2-диметил-1,3-диоксан-4,6-дион является органическое соединение с формулой C
6ЧАС
8О
4. Его молекула имеет гетероциклический ядро с четырьмя углерод и два кислород атомы; формулу также можно записать как [−O− (C (CH
3)
2) −O− (C = O) - (CH
2) - (C = O) -].
Это бесцветное кристаллическое твердое вещество, мало растворимое в воде. При нагревании разлагается с выделением углекислый газ и ацетон.[2][3]
Характеристики
Кислотность
Состав может легко потерять ион водорода от метилен элемент CH
2 в кольце (карбон 5); который создает двойную связь между ним и одним из соседних атомов углерода (номер 4 или 6) и отрицательный заряд в соответствующем кислороде. Результирующий анион [C
6ЧАС
7О
4]− стабилизируется резонанс между двумя альтернативами, так что двойная связь делокализованный и каждый кислород в карбонилы имеет формальный заряд −1/2.

В константа ионизации пKа составляет 4,97; что заставляет его вести себя как одноосновная кислота хотя он не содержит карбоновая кислота группы.[2] По этому и другим свойствам состав напоминает димедон и барбитуровая кислота. Однако, хотя димедон существует в растворе преимущественно в виде моно-энол таутомер, Кислота Мелдрама почти полностью соответствует дикетон форма.[2]
Необычно высокая кислотность этого соединения долгое время считалась аномальной - оно на 8 порядков кислотнее, чем близкородственное соединение. диметилмалонат. В 2004 году Охвада и его коллеги определили, что минимизирующая энергию конформационная структура соединения размещает σCH орбитали в правильной геометрии, чтобы выровняться с π*CO, так что основное состояние представляет необычно сильную дестабилизацию связи C-H.[4]
Подготовка
Оригинальный синтез
Компаунд был впервые сделан Мелдрамом реакция конденсации ацетона с малоновая кислота в уксусный ангидрид и серная кислота.[3]

Альтернативные синтезы
В качестве альтернативы своему первоначальному препарату кислоту Мелдрума можно синтезировать из малоновой кислоты, изопропенилацетат (ан энол производное ацетона) и каталитическая серная кислота.
Третий путь - это реакция недокись углерода C
3О
2 с ацетоном в присутствии Щавелевая кислота.[2]
Использует
Нравиться малоновая кислота и его сложноэфирные производные и другие 1,3-дикарбонильные соединения, Кислота Мелдрума может и служить реагентом для различных нуклеофильный реакции.
Алкилирование и ацилирование
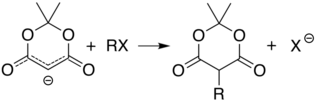
Кислотность углерода 5 (между двумя карбонильными группами) позволяет алкилирование и ацилирование кислоты Мелдрума в этой позиции. Например, депротонирование и реакция с простым алкилгалогенид (R − Cl) присоединяет алкильную группу (R−) в этой позиции:
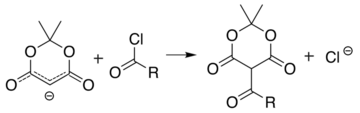
Аналогичная реакция с ацилхлорид (R− (C = O) −Cl) прикрепляет ацил (R− (C = O) -) вместо:
Эти две реакции позволяют кислоте Мелдрума служить исходным каркасом для синтеза множества различных структур с различными функциональными группами. С алкилированными продуктами можно дополнительно манипулировать для получения различных амидных и сложноэфирных соединений. Нагревание ацильного продукта в присутствии спирта приводит к сложноэфирному обмену и декарбоксилирование в процессе, аналогичном синтез эфира малоновой кислоты. Реакционная природа циклического сложного диэфира обеспечивает хорошую реакционную способность даже для спиртов с такими ограничениями, как т-бутанол.[5] Кетоэфиры этого типа полезны в Синтез пиррола Knorr.
Синтез кетенов
При температурах выше 200 ° C[6] Кислота Мелдрама подвергается перициклический реакция, которая высвобождает ацетон и углекислый газ и производит высокореактивный кетен сложный:[7]

Эти кетены можно выделить с помощью мгновенный вакуумный пиролиз (FVP). Кетены обладают высокой электрофильностью и могут подвергаться реакция присоединения с другими химическими веществами. При таком подходе возможно образование новых связей C – C, колец, амиды, сложные эфиры и кислоты:
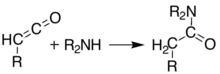
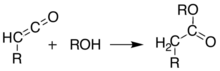

В качестве альтернативы пиролиз можно проводить в растворе, чтобы получить те же результаты без выделения кетена, в одноразовая реакция. Способность образовывать такие разнообразные продукты делает кислоту Мелдрума очень полезным реагентом для химиков-синтетиков.[8][9][10]
История

Комплекс назван в честь Эндрю Норман Мелдрам который сообщил о его синтезе в 1908 г.[3] Он ошибочно определил его структуру как β-лактон из β-гидроксиизопропилмалоновая кислота; правильная структура, бислактон 1,3-диоксан было сообщено в 1948 году.[11]
Рекомендации
- ^ «Кислота Мелдрама». Индекс Merck. 14-го. версия. Исследовательские лаборатории Мерк. 2006. с. 1005. ISBN 978-0-911910-00-1.
- ^ а б c d Макнаб, Хэмиш (1978). «Кислота Мелдрама». Обзоры химического общества. 7: 345–358. Дои:10.1039 / CS9780700345.
- ^ а б c Норман Мелдрам, Эндрю (1908). «Β-лактоновая кислота из ацетона и малоновой кислоты». Журнал химического общества, Сделки. 93: 598–601. Дои:10.1039 / CT9089300598.
- ^ Накамура, Сатоши; Хирао, Хадзиме; Охвада, Томохико (2004). «Обоснование кислотности кислоты Мелдрама. Согласованная связь кислотности C-H со свойствами локализованных реактивных орбиталей». J. Org. Chem. 69 (13): 4309–4316. Дои:10.1021 / jo049456f. PMID 15202884.
- ^ Оикава, Юдзи; Сугано, Киёси; Ёнемицу, Осаму (1978). «Кислота Мелдрума в органическом синтезе. 2. Общий и универсальный синтез β-кетоэфиров». J. Org. Chem. 43 (10): 2087–2088. Дои:10.1021 / jo00404a066.
- ^ Gaber, Abd El-Aal M .; Макнаб, Хэмиш (2001). «Синтетические применения пиролиза кислотных производных Мелдрама». Синтез. 2001 (14): 2059–2074. Дои:10.1055 / с-2001-18057.
- ^ Дюма, Аарон М .; Филлион, Эрик (2009). "Кислоты Мелдрама и 5-алкилиденовые кислоты Мелдрама в каталитических процессах образования углеродных связей". Соотв. Chem. Res. 43 (3): 440–454. Дои:10.1021 / ar900229z.
- ^ Оикава, Юдзи; Хирасава, Хитоши; Ёнемицу, Осаму (1978). «Кислота Мелдрума в органическом синтезе. 1. Удобный однореакторный синтез этилиндолепропионатов». Буквы Тетраэдра. 19 (20): 1759–1762. Дои:10.1016/0040-4039(78)80037-9.
- ^ Липсон, Виктория В .; Горобец Николай Ю. (2009). «Сто лет кислоты Мелдрама: достижения в синтезе производных пиридина и пиримидина». Мол. Дайверы. 13 (4): 399–419. Дои:10.1007 / s11030-009-9136-х. PMID 19381852.
- ^ Бонифасио, Васко Д. Б. (2004). «Кислота Мелдрама». Synlett. 2004 (9): 1649–1650. Дои:10.1055 / с-2004-829539.
- ^ Дэвидсон, Дэвид; Бернхард, Сидней А. (1948). «Структура предполагаемой β-лактоновой кислоты Мелдрама». Журнал Американского химического общества. 70 (10): 3426–3428. Дои:10.1021 / ja01190a060. PMID 18891879.
дальнейшее чтение
- Геренсер, Янош; Дорман, Дьёрдь; Дарвас, Ференц (2006). "Кислота Мелдрама в многокомпонентных реакциях: приложения к комбинаторному и разнообразно-ориентированному синтезу". QSAR и комбинаторная наука. 25 (5–6): 439–448. Дои:10.1002 / qsar.200540212.
- Иванов, Андрей С. (2008). «Кислота Мелдрума и родственные ей соединения в синтезе натуральных продуктов и аналогов». Chem. Soc. Ред. 37 (4): 789–811. Дои:10.1039 / B716020H.
- Кидд, Хэмиш (29 октября 2008 г.). "Кислота Мелдрама". Мир химии: 35–36.
