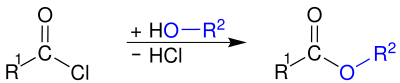Ацилхлорид - Википедия - Acyl chloride

В органическая химия, ацилхлорид (или же хлорангидрид) является органическое соединение с функциональная группа -COCl. Их формула обычно записывается как RCOCl, где R - боковая цепь. Это реактивные производные карбоновые кислоты. Конкретным примером ацилхлорида является ацетилхлорид, CH3COCl. Ацилхлориды являются наиболее важной подгруппой ацилгалогениды.
Номенклатура
Если ацилхлоридный фрагмент имеет приоритет, ацилхлориды называют, взяв название исходной карбоновой кислоты и подставив -илхлорид за -иновая кислота. Таким образом:
- ацетилхлорид CH3COCl
- бензоилхлорид C6ЧАС5COCl
Когда другие функциональные группы имеют приоритет, ацилхлориды считаются префиксами - хлоркарбонил:[1]
- (хлоркарбонил) уксусная кислота ClOCCH2COOH
Характеристики
Отсутствие способности формировать водородные связи, хлорангидриды имеют более низкие температуры кипения и плавления, чем аналогичные карбоновые кислоты. Например, уксусная кислота кипит при 118 ° C, а ацетилхлорид - при 51 ° C. Как большинство карбонильные соединения, ИК-спектроскопия показывает полосу около 1750 см−1.
Простейшим стабильным ацилхлоридом является этаноилхлорид или ацетилхлорид; метаноилхлорид (формилхлорид) нестабилен при комнатной температуре, хотя его можно получить при –60 ° C или ниже.[2][3] Ацилхлорид не растворяется в воде. Вместо этого он разлагается в воде.
Синтез
Промышленные маршруты
Промышленный путь получения ацетилхлорида включает реакцию уксусный ангидрид с хлористый водород:[4]
- (CH3CO)2O + HCl → CH3COCl + CH3CO2ЧАС
Пропионил хлорид производится хлорированием пропионовая кислота с фосген:[5]
- CH3CH2CO2H + COCl2 → CH3CH2COCl + HCl + CO2
Бензоилхлорид получают путем частичного гидролиза бензотрихлорид:[6]
- C6ЧАС5CCl3 + H2О → С6ЧАС5C (O) Cl + 2 HCl
Лабораторные методы
В лаборатории ацилхлориды обычно получают таким же образом, как и алкилхлориды путем замены соответствующих гидроксизаместителей на хлориды. Таким образом, карбоновые кислоты обрабатывают тионилхлорид (SOCl2),[7] трихлорид фосфора (PCl3),[8] пентахлорид фосфора (PCl5) или оксалилхлорид27 ([COCl]2):[9][10]

- 3 RCO2H + PCl3 → 3 RCOCl + H3PO3
- RCO2H + PCl5 → RCOCl + POCl3 + HCl
Тионил хлорид[11] - хорошо подходящий реагент, поскольку все побочные продукты (HCl, SO2) представляют собой газы, а остаточный тионилхлорид может быть легко удален благодаря его низкой температуре кипения (76 ° C). По сравнению с тионилхлоридом оксалилхлорид более дорогой, но также более мягкий реагент и, следовательно, более селективный. Соответственно синтезируются ацилбромиды и йодиды, но встречаются реже.[12]
Реакция с тионилхлоридом может катализироваться диметилформамид.[13] В этой реакции диоксид серы (ТАК2) и хлористый водород (HCl) образуются оба газа, которые могут покинуть реакционный сосуд, продвигая реакцию вперед. Избыток тионилхлорида (т.кип. 74,6 ° C) также легко испаряется.[10] Механизмы реакции с участием тионилхлорида и пентахлорида фосфора аналогичны.
Другой метод предполагает использование оксалилхлорид:
- RCO2Н + ClCOCOCl → RCOCl + CO + CO2 + HCl
Реакция катализируется диметилформамидом (ДМФ), который реагирует с оксалилхлоридом на первой стадии с образованием иминиевого промежуточного соединения, которое взаимодействует с карбоновой кислотой, выделяя оксид и регенерируя катализатор ДМФ.[13]
В качестве источника хлоридов можно использовать хлориды кислот.[14]
Другие методы, которые не образуют HCl, включают Реакция Аппеля:[15]
- RCO2H + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
Другой - использование цианур хлорид:[16]
- RCO2H + C3N3Cl3 → RCOCl + C3N3Cl2ОЙ
Реакции
Нуклеофильные реакции
Ацилхлориды реагируют с водой с образованием карбоновой кислоты:
Этот гидролиз обычно является неприятным, а не преднамеренным. Ацилхлориды используются для приготовления ангидриды кислот, амиды и сложные эфиры, путем реакции хлорангидридов с: солью карбоновая кислота, амин, или алкоголь, соответственно.
Использование базы, например водный едкий натр или же пиридин,[10] или избыток амина (при получении амидов)[13] желательно удалить побочный продукт хлористого водорода и катализировать реакцию. Хотя часто можно получить сложные эфиры или амиды из карбоновой кислоты со спиртами или аминами, реакции обратимы, что часто приводит к низким выходам. Напротив, обе реакции, участвующие в получении сложных эфиров и амидов через ацилхлориды (образование ацилхлорида из карбоновой кислоты с последующим сочетанием со спиртом или амином), являются быстрыми и необратимыми. Это делает двухстадийный путь часто предпочтительным по сравнению с одностадийной реакцией с карбоновой кислотой.[10]
С углеродными нуклеофилами, такими как Реактивы Гриньяра, ацилхлориды обычно дают кетон, который подвержен атаке вторым эквивалентом, чтобы получить третичный алкоголь. Реакция ацилгалогенидов с определенными кадмийорганический реагенты останавливаются на стадии кетона, хотя соединения кадмия очень токсичны и канцерогены.[17][18] Нуклеофильная реакция с Реактивы Гилмана также дают кетоны, что отражает низкую реакционную способность этих соединений диорганокоппера лития.[10] Хлорангидриды ароматических кислот обычно менее реакционноспособны, чем хлорангидриды алкильных кислот, и поэтому для реакции требуются несколько более жесткие условия.
Ацилхлориды восстанавливаются литийалюминийгидрид и гидрид диизобутилалюминия дать первичные спирты. Литий три-трет-бутоксиалюминий гидрид, объемный донор гидрида, восстанавливает ацилхлориды до альдегидов, как и Редукция Розенмунда с помощью водородный газ над отравленным палладиевым катализатором.[19]
Электрофильные реакции
С Кислота Льюиса катализаторы, такие как хлорид железа или же хлорид алюминия, ацилхлориды участвуют в Ацилирование Фриделя-Крафтса, чтобы получить арилкетоны:[8][10]
Из-за суровых условий и реакционной способности промежуточных продуктов эта в остальном весьма полезная реакция имеет тенденцию быть грязной, а также экологически вредной.
Реактивность
Галогениды карбоновых кислот являются одними из наиболее реакционноспособных и универсальных соединений в органической химии, и был рассмотрен полный спектр возможных реакций.[20] Ацилхлориды обладают большей реакционной способностью, чем другие производные карбоновых кислот, такие как кислота. ангидриды, сложные эфиры или же амиды:
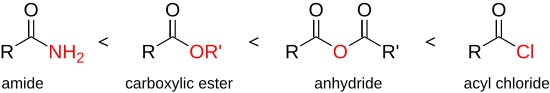
Поэтому хлорангидриды можно использовать для синтеза всех перечисленных соединений с более низкой реакционной способностью. Высокая реакционная способность хлорангидрида основана на том, что ион хлорида является слабым основанием и отличной уходящей группой, так что даже слабые нуклеофилы атакуют карбонильную группу. По сравнению с его исходным соединением (карбоновой кислотой) более высокая реакционная способность может быть объяснена тем, что гидроксильная группа является гораздо худшей уходящей группой.
Механизм
Считается, что алкоголиз ацилгалогенидов (алкоксидегалогенирование) протекает через SN2 (схема 10).[21] Однако механизм также может быть тетраэдрическим или SN1 в высокополярных растворителях[22] (в то время как SN2 включает согласованную реакцию, тетраэдрический путь присоединения-элиминирования включает заметное промежуточное соединение).[23]

- Механизм образования сложного эфира при алкоголизе ацилхлорида.
Опасности
Ацилхлориды с низким молекулярным весом часто лакриматоры, и они бурно реагируют с водой, спиртами и аминами.
Рекомендации
- ^ Номенклатура органической химии, R-5.7.6 Галогениды кислот
- ^ Сих, Джон К. (2001-04-15), «Формилхлорид», в John Wiley & Sons, Ltd (ред.), Энциклопедия реагентов для органического синтеза, John Wiley & Sons, Ltd, Дои:10.1002 / 047084289x.rf026, ISBN 9780471936237
- ^ Ричард О. Норман; Джеймс М. Коксон (16 сентября 1993 г.). Принципы органического синтеза, 3-е издание. CRC Press. п. 371. ISBN 978-0-7487-6162-3.
- ^ Патент США 5672749, Филип Р. ДеВроу, У. Брайан Уэйтс, Роберт Э. Янг, "Процесс получения ацетилхлорида"
- ^ Самель, Ульф-Райнер; Колер, Вальтер; Геймер Армин Отто; Кеузер, Ульрих (2005). «Пропионовая кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_223.
- ^ Маки, Такао; Такеда, Кадзуо (2002). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_555.
- ^ Helferich, B .; Шефер, В. (1929). «н-бутирл хлорид». Органический синтез. 9: 32. Дои:10.15227 / orgsyn.009.0032.
- ^ а б Allen, C.F.H .; Баркер, У. Э. (1932). «Дезоксибензоин». Органический синтез. 12: 16. Дои:10.15227 / orgsyn.012.0016.
- ^ Адамс, Роджер (1923). «п-Нитробензоилхлорид». Органический синтез. 3: 75. Дои:10.15227 / orgsyn.003.0075.
- ^ а б c d е ж Бойд, Роберт В .; Моррисон, Роберт (1992). Органическая химия. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. С. 666–762. ISBN 0-13-643669-2.
- ^ J. S. Pizey, Synthetic Reagents, Vol. 1, Halsted Press, Нью-Йорк, 1974.
- ^ Кейнан, Эхуд; Сахай, М. (июнь 1990 г.). «Дииодосилан. 3. Прямой синтез ацилйодидов из карбоновых кислот, сложных эфиров, лактонов, ацилхлоридов и ангидридов». Журнал органической химии. 55 (12): 3922–3926. Дои:10.1021 / jo00299a042. ISSN 0022-3263.
- ^ а б c Клейден, Джонатан (2001). Органическая химия. Оксфорд: Издательство Оксфордского университета. стр.276–296. ISBN 0-19-850346-6.
- ^ Л. П. Киридес (1940). «Фумарил хлорид». Органический синтез. 20: 51. Дои:10.15227 / orgsyn.020.0051.
- ^ "Трифенилфосфин-четыреххлористый углерод Ташнер, Майкл Дж. e-EROS: Энциклопедия реагентов для органического синтеза, 2001
- ^ К. Венкатараман; Д. Р. Вэгл (1979). «Цианурхлорид: полезный реагент для превращения карбоновых кислот в хлориды, сложные эфиры, амиды и пептиды». Tetrahedron Lett. 20 (32): 3037–3040. Дои:10.1016 / S0040-4039 (00) 71006-9.
- ^ Спиридонова Е.Я. (1991). «[Экспериментальное изучение токсических свойств диметилкадмия]». Гигиена Труда И Профессиональные Заболевания (6): 14–7. PMID 1916391.
- ^ http://monographs.iarc.fr/ENG/Monographs/vol100C/mono100C-8.pdf[требуется полная цитата ]
- ^ Уильям Ройш. «Производные карбоновых кислот». Виртуальный текст органической химии. Университет штата Мичиган. Архивировано из оригинал на 2016-05-16. Получено 2009-02-19.
- ^ Зоннтаг, Норман О.В. (1953-04-01). «Реакции хлоридов алифатических кислот». Химические обзоры. 52 (2): 237–416. Дои:10.1021 / cr60162a001. ISSN 0009-2665.
- ^ Бентли, Т. Уильям; Ллевеллин, Гарет; Макалистер, Дж. Энтони (январь 1996 г.). «Механизм SN2 для алкоголиза, аминолиза и гидролиза ацетилхлорида». Журнал органической химии. 61 (22): 7927–7932. Дои:10.1021 / jo9609844. ISSN 0022-3263.
- ^ К. Х. Бэмфорд и К. Ф. Х. Типпер, Комплексная химическая кинетика: образование и гидролиз сложных эфиров и родственные реакции, издательство Elsevier, Амстердам, 1972.
- ^ Фокс, Джозеф М .; Дмитренко, Ольга; Ляо, Лянь-ань; Бах, Роберт Д. (октябрь 2004 г.). «Вычислительные исследования нуклеофильного замещения на карбонильном углероде: механизм S N 2 по сравнению с тетраэдрическим промежуточным соединением в органическом синтезе». Журнал органической химии. 69 (21): 7317–7328. Дои:10.1021 / jo049494z. ISSN 0022-3263.