Синтез Паала – Кнорра - Paal–Knorr synthesis
| Синтез Паала-Кнорра | |
|---|---|
| Названный в честь | Карл Паал Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000161 |
В Синтез Паала – Кнорра в органическая химия это реакция, которая порождает либо фураны, пирролы, или же тиофены из 1,4-дикетоны. Это синтетически ценный метод получения замещенных фуранов и пирролов, общих структурных компонентов многих природных продуктов. Первоначально о нем независимо друг от друга сообщили немецкие химики Карл Паал и Людвиг Кнорр в 1884 г. как метод получения фуранов и был адаптирован для пирролов и тиофенов.[1][2] Хотя синтез Паала-Кнорра нашел широкое применение, механизм не был полностью понят до тех пор, пока не был выяснен В. Амарнатхом. и другие. в 1990-е гг.[3][4]
Для синтеза фурана необходим кислотный катализатор:[5]
В синтезе пиррола первичный амин участвует:
и в этом тиофен например, соединение пентасульфид фосфора:
Механизмы
Синтез фурана
| Синтез фурана Пааль-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | paal-knorr-furan-синтез |
| RSC ID онтологии | RXNO: 0000162 |
Катализируемый кислотой синтез фурана протекает путем протонирования одного карбонила, который подвергается атаке образующимся енолом другого карбонила. Обезвоживание полуацеталя дает образовавшийся фуран.[6]

Механизм синтеза фурана Паала – Кнорра был выяснен в 1995 г. В. Амарнатхом. и другие.[3] Работа Амарнатха показала, что диастереомеры 3,4-дизамещенных-2,5-гександионов реагируют с разной скоростью. В общепринятом механизме эти дионы будут проходить через общий енольный промежуточный продукт, что означает, что мезо- и д, л-рацемические изомеры будут циклизоваться с той же скоростью, с какой они образуются из общего промежуточного продукта. Смысл различных реакций состоит в том, что циклизация должна происходить согласованно с образованием енола. Таким образом, механизм был предложен через атаку протонированного карбонила образующимся енолом. Амарнат также обнаружил, что непрореагировавший дион не подвергся конформационной изомеризации, что также указывает на то, что енол не является промежуточным продуктом.
Пиррольный синтез
| Синтез пиррола Пааль-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | paal-knorr-пиррол-синтез |
| RSC ID онтологии | RXNO: 0000164 |
Механизм синтеза пиррола исследовал В. Амарнатх. и другие. в 1991 г.[4] Его работа предполагает, что протонированный карбонил подвергается атаке амина с образованием полуаминаля. Амин атакует другой карбонил с образованием производного 2,5-дигидрокситетрагидропиррола, которое подвергается дегидратации с образованием соответствующего замещенного пиррола.[7]

Реакцию обычно проводят в протонных или кислотных условиях Льюиса с первичным амином. Использование гидроксид аммония или ацетат аммония (как сообщает Паал) дает N-незамещенный пиррол.
Синтез тиофена
| Синтез тиофена Пааль-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | paal-knorr-тиофен-синтез |
| RSC ID онтологии | RXNO: 0000163 |
Синтез тиофена осуществляется по механизму, очень похожему на синтез фурана. Исходный дикетон превращается в тиокетон с сульфуризирующим агентом, который затем подвергается тому же механизму, что и синтез фурана.[8]

Большинство агентов сульфуризации являются сильными дегидраторами и способствуют завершению реакции. Ранние постулаты о механизме синтеза фурана Паала-Кнорра предполагали, что тиофен был получен путем сульфуризации фуранового продукта. Кампейн и Фой показали, что обработка изолированных фуранов в результате синтеза фуранов Пааль-Кнорра пентасульфид фосфора дало противоречивые результаты при обработке 1,4-дикарбонилов пентасульфидом фосфора, что исключило сульфуризацию фуранового механизма и предполагает, что реакция протекает через сульфуризацию дикарбонила с образованием тиокетон.[8]
Объем

Реакция Паала – Кнорра весьма разнообразна. Во всех синтезах почти все дикарбонилы могут быть превращены в соответствующий им гетероцикл. R2 и R5 могут быть H, арилом или алкилом. R3 и R4 могут быть H, арилом, алкилом или сложным эфиром. В синтезе пиррола (X = N) R1 может быть H, арилом, алкилом, амино или гидроксилом.[9]
Для проведения этих реакций можно использовать различные условия, большинство из которых мягкие. Синтез фурана Паала-Кнорра обычно проводят в кислых водных условиях с протонными кислотами, такими как водная серная или соляная кислота, или в безводных условиях с кислотой Льюиса или дегидратирующим агентом. Общие дегидратирующие агенты включают: пятиокись фосфора, ангидриды, или хлорид цинка. Для синтеза пиррола требуется первичный амин в аналогичных условиях, или можно использовать аммиак (или предшественники аммиака). Для синтеза тиофена требуется сульфуризующий агент, который обычно является достаточным дегидратором, например пентасульфид фосфора, Реактив Лавессона, или же сероводород.
Традиционно реакция Паала-Кнорра была ограничена доступностью 1,4-дикетонов в качестве синтетических предшественников. Современные химические методы значительно расширили доступность этих реагентов, а вариации Паала-Кнорра теперь позволяют использовать различные прекурсоры. Считается, что метод Паала-Кнорра ограничен жесткими условиями реакции, такими как длительное нагревание в кислоте, что может ухудшить чувствительные функциональные возможности многих потенциальных предшественников фурана. Современные методы позволяют создавать более мягкие условия, в которых можно полностью избежать жары, в том числе: микроволновый катализатор циклизации.
Вариации
Вместо 1,4-дикарбонила можно использовать несколько суррогатов 1,4-дикарбонила. Хотя эти заместители имеют структуру, отличную от 1,4-дикарбонила, их реакции протекают по механизмам, очень похожим на механизм Паля-Кнорра.
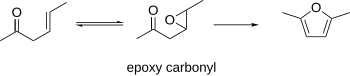
β-эпоксикарбонилы
Известно, что β-эпоксикарбонилы циклизуются в фураны. В этой процедуре можно использовать β-γ-ненасыщенные карбонилы в качестве исходных материалов, которые можно эпоксидировать. Полученный эпоксикарбонил можно циклизовать до фурана в кислых или основных условиях.[10]
1,4-диол-2-ин
1,4-диол-2-иновые системы также использовались для химии Паала – Кнорра. Используя палладий, 1,4-диол-2-ин может быть изомеризован до соответствующего 1,4-дикетона. на месте и затем дегидратируют до соответствующего фурана с использованием агента дегидратации.[11]

Значение этой вариации состоит в том, что она увеличивает сферу применения метода Паала-Кнорра за счет использования преимуществ существующей химии ацетилена, в частности, для получения пропаргиловых спиртов.
Ацетали
Ацетали также оказались полезными стартовыми материалами для Paal-Knorr. Кетон со связями ацеталя 3 на удалении от него может быть преобразован в точно таких же условиях, как 1,4-дикетон, в соответствующий гетероцикл.
Паал – Кнорр с использованием микроволновой печи
Другим вариантом было введение микроволнового излучения для усиления Пааля – Кнорра. Традиционные условия Паала-Кнорра включали длительное нагревание сильных кислот для ускорения обезвоживания, которое происходило в течение нескольких часов. Было продемонстрировано, что реакции Паала-Кнорра в микроволновых печах протекают во временных масштабах, измеряемых в минутах, и в открытых колбах при комнатной температуре.[12]
Связанные реакции
В Синтез пиррола Knorr Кнорр в 1884 г. сообщил о синтезе замещенного пиррола из аминокетона и кетона.[13]
| Кнорр синтез пиразола | |
|---|---|
| Названный в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000391 |
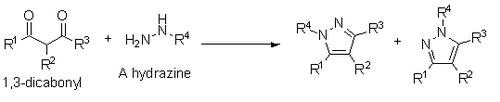
Knorr также сообщает о синтезе пиразолы из 1,3-дикарбонилов и гидразины, гидразиды или полибикарбазиды. Этот синтез происходит по механизму конденсации, подобному механизму Пааль-Кнорра, однако, если используется замещенный гидразин, он приводит к смеси региоизомеров, в которой замещенный гетероатом находится либо рядом с заместителем R1, либо с заместителем R3.[14]
Синтетические приложения
В 2000 г. Б. М. Трост и другие. сообщили об официальном синтезе антибиотика розеофилина. Путь Троста к макроциклическому ядру розеофилина, как и других, основывался на синтезе пиррола Паала-Кнорра для получения конденсированного пиррола.[15] Нагревание 1,4-дикетона с ацетатом аммония в метаноле с камфорсульфоновой кислотой и молекулярными ситами 4 ангстрем дает пиррол без N-замещения. Было обнаружено, что этот пиррол является нестабильным, и перед выделением его обрабатывали триметилсилилэтоксиметоксихлоридом (SEM-Cl) для защиты пиррола.

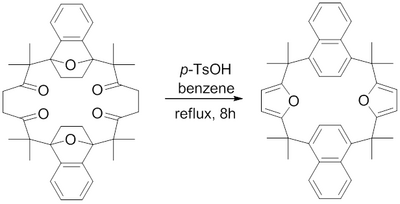
В 1982 г. Х. Харт и другие. сообщили о синтезе макроцикла, содержащего конденсированные фурановые кольца, с использованием фуранового синтеза Паала-Кнорра.[16] Рефлюкс параграф-толуолсульфоновая кислота в бензоле дегидратирует 1,4-дикетоны до их соответствующих фуранов для получения сложных макроциклических конденсированных фуранов.
Смотрите также
- Синтез пиррола по Ганцу
- Синтез пиррола Knorr
- Синтез Фейста-Бенари
- Циклизация Фольхарда – Эрдмана
- Синтез пиридина Ганча
Рекомендации
- ^ Паал, К. (1884), "Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters", Berichte der deutschen chemischen Gesellschaft, 17 (2): 2756–2767, Дои:10.1002 / cber.188401702228
- ^ Кнорр, Л. (1884), "Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester", Berichte der deutschen chemischen Gesellschaft, 17 (2): 2863–2870, Дои:10.1002 / cber.188401702254
- ^ а б Amarnath, V .; Амарнатх, К. (1995), "Промежуточные соединения в синтезе фуранов Пааль-Кнорра", Журнал органической химии, 60 (2): 301–307, Дои:10.1021 / jo00107a006
- ^ а б Amarnath, V .; Энтони, Д. С .; Amarnath, K .; Valentine, W. M .; Wetterau, L.A .; Грэхем, Д. Г. (1991), "Промежуточные соединения в синтезе пирролов Пааль-Кнорра", Журнал органической химии, 56 (24): 6924–6931, Дои:10.1021 / jo00024a040
- ^ Томас Л. Гилкрист (1987). Гетероциклическая химия. Харлоу: Longman Scientific. ISBN 0-582-01421-2.
- ^ Ласло Курти; Барбара Чако (2005), Стратегические применения названных реакций в органическом синтезе, Книги о науке и технологиях Elsevier, ISBN 9780123694836
- ^ Адальберт Воллраб (1999), Organische Chemie (на немецком языке), Springer-Verlag, p. 850, ISBN 3-540-43998-6
- ^ а б Campaigne, E .; Фой, В. О. (1952), "Синтез 2,5-диарилтиофенов", Журнал органической химии, 17 (10): 1405–1412, Дои:10.1021 / jo50010a023
- ^ Холман, Р. В. (2005), «Стратегическое применение названных реакций в органическом синтезе: история вопроса и подробные механизмы (Кюрти, Ласло; Чако, Барбара)», Журнал химического образования, 82 (12): 1780, Bibcode:2005JChEd..82S1780H, Дои:10.1021 / ed082p1780.3
- ^ Cormier, R.A .; Фрэнсис, М. Д. (1981), "Эпоксикетон-фурановая перегруппировка", Синтетические коммуникации, 11 (5): 365, Дои:10.1080/00397918108064300
- ^ Ji, J .; Лу, X. (1993), «Простой синтез 2,5-дизамещенных фуранов через комплекс палладия и перфторированную смолу, катализируемую изомеризацией-дегидратацией алкиндиолов», Журнал химического общества, химические коммуникации (9): 764–765, Дои:10.1039 / C39930000764
- ^ Минетто, G .; Raveglia, L. F .; Таддеи, М. (2004), "Реакция Паала-Кнорра с помощью микроволнового излучения. Быстрый подход к замещенным пирролам и фуранам", Органические буквы, 6 (3): 389–392, Дои:10.1021 / ol0362820, PMID 14748600
- ^ Кнорр, Л. (1884), "Synthese von Pyrrolderivaten", Berichte der deutschen chemischen Gesellschaft, 17 (2): 1635–1642, Дои:10.1002 / cber.18840170220
- ^ Кнорр, Л. (1883 г.), "Einwirkung von Acetessigester auf Phenylhydrazin", Berichte der deutschen chemischen Gesellschaft, 16 (2): 2597–2599, Дои:10.1002 / cber.188301602194
- ^ Trost, B.M .; Доэрти, Г. А. (2000), «Асимметричный синтез трициклического ядра и формальный полный синтез розеофилина через метатезис энина», Журнал Американского химического общества, 122 (16): 3801–3810, Дои:10.1021 / ja9941781
- ^ Hart, H .; Takehira, Y. (1982), "Аддукты, полученные из макроциклов фурана и бензина", Журнал органической химии, 47 (22): 4370–4372, Дои:10.1021 / jo00143a049



