Фуран - Furan
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Фуран[1] | |||
| Систематическое название ИЮПАК 1,4-эпоксибута-1,3-диен 1-Оксациклопента-2,4-диен | |||
| Другие имена Оксол Окса [5] аннулен 1,4-эпокси-1,3-бутадиен 5-Оксациклопента-1,3-диен 5-оксацикло-1,3-пентадиен Фурфуран Дивинилен оксид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.390 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС4О | |||
| Молярная масса | 68.075 г · моль−1 | ||
| Внешность | Бесцветная летучая жидкость | ||
| Плотность | 0,936 г / мл | ||
| Температура плавления | -85,6 ° С (-122,1 ° F, 187,6 К) | ||
| Точка кипения | 31,3 ° С (88,3 ° F, 304,4 К) | ||
| -43.09·10−6 см3/ моль | |||
| Опасности | |||
| Паспорт безопасности | Pennakem | ||
| R-фразы (устарело) | R26 / 27/28, R45 | ||
| S-фразы (устарело) | S16, S37, S45, S28 | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -36 ° С (-33 ° F, 237 К) | ||
| 390 ° С (734 ° F, 663 К) | |||
| Пределы взрываемости | Ниже: 2,3% Верхний: 14,3% при 20 ° C | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | > 2 г / кг (крыса) | ||
| Родственные соединения | |||
Связанный гетероциклы | Пиррол Тиофен | ||
Родственные соединения | Тетрагидрофуран (THF) 2,5-диметилфуран Бензофуран Дибензофуран | ||
| Структура | |||
| C2v | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Фуран это гетероциклический органическое соединение, состоящий из пятичленного ароматный кольцо с четырьмя атомами углерода и одним кислородом. Химические соединения, содержащие такие кольца, также называют фуранами.
Фуран - бесцветный, легковоспламеняющийся, высоко летучий жидкость с точка кипения близкая к комнатной температуре. Он растворим в обычных органических растворителях, в том числе в алкоголь, эфир, и ацетон, и плохо растворяется в воде.[2] Его запах «сильный, эфирный; хлороформ -подобно".[3] это токсичный и возможно канцерогенный в людях. Фуран используется как отправная точка для других специальные химикаты.[4]
История
Название «фуран» происходит от латинский мех, что значит отруби.[5] (Фурфурол производится из отрубей.) Первое описанное производное фурана было 2-фурановая кислота, к Карл Вильгельм Шееле в 1780 г. Другая важная производная, фурфурол, сообщил Иоганн Вольфганг Дёберейнер в 1831 году и девять лет спустя охарактеризован Джон Стенхаус. Сам фуран был впервые приготовлен Генрих Лимприхт в 1870 году, хотя он назвал его «тетрафенолом» (как если бы это был четырехуглеродный аналог фенол, С6ЧАС6О).[6][7]
Производство
Промышленно фуран производится палладий -катализируемое декарбонилирование фурфурол, или медь -катализируемое окисление 1,3-бутадиен:[4]
В лаборатории фуран можно получить из фурфурол окислением до 2-фурановой кислоты с последующим декарбоксилирование.[8] Его также можно приготовить непосредственно термическое разложение из пентоза -содержащие материалы, и целлюлозный твердые вещества, особенно сосна дерево.
Синтез фуранов
В Синтез Фейста-Бенари это классический способ синтеза фуранов, хотя было разработано множество способов синтеза.[9] Одним из простейших методов синтеза фуранов является реакция 1,4-дикетоны с пятиокись фосфора (П2О5) в Синтез Паала – Кнорра. В тиофен реакция образования 1,4-дикетонов с Реактив Лавессона также образует фураны в качестве побочных продуктов. Существует множество способов синтеза замещенных фуранов.[10]
Химия
Фуран ароматный потому что один из одинокие пары из электроны на атоме кислорода делокализованный в кольцо, создавая 4п + 2 ароматические системы (см. Правило Хюккеля ) похожий на бензол. Из-за ароматичности молекула плоская и не имеет дискретных двойные связи. Другая неподеленная пара электронов атома кислорода проходит в плоскости плоской кольцевой системы. В зр2 гибридизация заключается в том, чтобы позволить одной из неподеленных пар кислорода находиться в p орбитальный и, таким образом, позволить ему взаимодействовать с π система.
Из-за своей ароматичности поведение фурана совершенно не похоже на поведение более типичного гетероциклического соединения. эфиры Такие как тетрагидрофуран.
- Он значительно более реактивен, чем бензол в электрофильное замещение реакции, обусловленные электронодонорными эффектами гетероатома кислорода. Исследование вкладчиков резонанса показывает повышенную электронную плотность кольца, что приводит к увеличению скорости электрофильного замещения.[11]
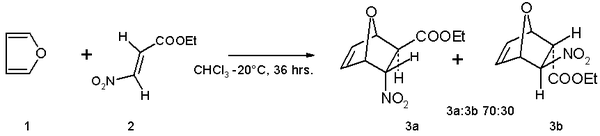
- Фуран служит диен в Реакции Дильса – Альдера с электронодефицитным диенофилы такие как этил (E) -3-нитроакрилат.[12] Продукт реакции представляет собой смесь изомеров с предпочтением эндо изомер:
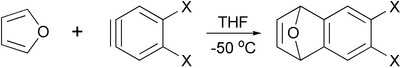
- Реакция Дильса-Альдера фурана с аринами дает соответствующие производные дигидронафталины, которые являются полезными промежуточными продуктами в синтезе других полициклические ароматические соединения.[13]
- Гидрирование фуранов последовательно дает дигидрофураны и тетрагидрофураны.
- в Реакция Ахматовича, фураны превращаются в дигидропиран соединения.
- Пиррол может быть получен промышленным способом путем взаимодействия фурана и аммиак в присутствии твердой кислоты катализаторы, Такие как SiO2 и Al2О3.[14]
Безопасность
Фуран содержится в термически обработанных коммерческих продуктах питания и производится посредством термическое разложение натуральных компонентов пищи.[15][16] Встречается в жареном кофе, растворимый кофе и обработанный детское питание.[16][17][18] Исследования показали, что кофе, приготовленный в эспрессо производители, и, прежде всего, кофе из капсулы, содержит больше фурана, чем в традиционном капельные кофеварки, хотя уровни все еще находятся в безопасных для здоровья пределах.[19]
Воздействие фурана в дозах, примерно в 2000 раз превышающих прогнозируемый уровень воздействия на человека через пищевые продукты, увеличивает риск гепатоцеллюлярные опухоли у крыс и мышей и опухоли желчных протоков у крыс.[20] Поэтому фуран указан как возможный человеческий канцероген.[20]
Смотрите также
- BS 4994 – Фурановая смола как термореактивный стеклопластик для оборудования химических производств
- Фуранокумарин
- Фуранофлавоноид
- Фураноза
- Фурантетракарбоновая кислота
- Простые ароматические кольца
- Фурановые жирные кислоты
- Тетрагидрофуран
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 392. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Якубке, Ханс Дитер; Jeschkeit, Ганс (1994). Краткая энциклопедия химии. Вальтер де Грюйтер. стр.1–1201. ISBN 0-89925-457-8.
- ^ Публикация DHHS (NIOSH) № 2016–171, п. 2, по состоянию на ноябрь 2019 г.
- ^ а б Hoydonckx, H.E .; Van Rhijn, W. M .; Van Rhijn, W .; Де Вос, Д. Э .; Джейкобс, П. А. "Фурфурол и производные". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a12_119.pub2.
- ^ Сеннинг, Александр (2006). Словарь химиоэтимологии Elsevier. Эльзевир. ISBN 0-444-52239-5.
- ^ Лимприхт, Х. (1870). "Убер дас Тетрафенол С"4ЧАС4O ". Berichte der Deutschen Chemischen Gesellschaft. 3 (1): 90–91. Дои:10.1002 / cber.18700030129.
- ^ Родд, Эрнест Гарри (1971). Химия углеродных соединений: современный всеобъемлющий трактат. Эльзевир.
- ^ Уилсон, У. К. (1941). «Фуран». Органический синтез.; Коллективный объем, 1, п. 274
- ^ Hou, X. L .; Cheung, H. Y .; Hon, T. Y .; Kwan, P. L .; Lo, T. H .; Tong, S. Y .; Вонг, Х. Н. (1998). «Региоселективный синтез замещенных фуранов». Тетраэдр. 54 (10): 1955–2020. Дои:10.1016 / S0040-4020 (97) 10303-9.
- ^ Катрицки, Алан Р. (2003). «Синтез 2,4-дизамещенных фуранов и 4,6-диарилзамещенных 2,3-бензо-1,3a, 6a-триазапенталенов» (PDF). Аркивок. 2004 (2): 109. Дои:10.3998 / ark.5550190.0005.208.
- ^ Брюс, Паула Ю. (2007). Органическая химия (5-е изд.). Река Аппер Сэдл, штат Нью-Джерси: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ^ Masesane, I .; Бацанов, А .; Howard, J .; Modal, R .; Сталь, П. (2006). «Оксанорборненовый подход к 3-гидрокси, 3,4-дигидрокси и 3,4,5-тригидроксипроизводным 2-аминоциклогексанкарбоновой кислоты». Журнал органической химии Байльштейна. 2 (9): 9. Дои:10.1186/1860-5397-2-9. ЧВК 1524792. PMID 16674802.
- ^ Филатов, М. А .; Балущев, С .; Илиева, И. З .; Enkelmann, V .; Митева, Т .; Ландфестер, К.; Алещенков, С.Е .; Чепраков, А. В. (2012). «Тетраарилтетраантра [2,3] порфирины: синтез, структура и оптические свойства» (PDF). J. Org. Chem. 77 (24): 11119–11131. Дои:10.1021 / jo302135q. PMID 23205621. Архивировано из оригинал (PDF) на 2020-02-19.
- ^ Харреус, Альбрехт Людвиг. «Пиррол». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_453.
- ^ Anese, M .; Manzocco, L .; Calligaris, S .; Николи, М. С. (2013). «Промышленно применимые стратегии уменьшения содержания акриламида, фурана и 5-гидроксиметилфурфурола в пищевых продуктах» (PDF). Журнал сельскохозяйственной и пищевой химии. 61 (43): 10209–14. Дои:10.1021 / jf305085r. PMID 23627283. Архивировано из оригинал (PDF) на 2017-08-08.
- ^ а б Moro, S .; Chipman, J. K .; Wegener, J. W .; Hamberger, C .; Декант, В .; Малли А. (2012). «Фуран в термически обработанных пищевых продуктах: образование, воздействие, токсичность и аспекты оценки риска» (PDF). Молекулярное питание и пищевые исследования. 56 (8): 1197–1211. Дои:10.1002 / мнф.201200093. HDL:1871/41889. PMID 22641279.
- ^ Европейское агентство по безопасности пищевых продуктов (2011). «Обновленная информация об уровнях фурана в пищевых продуктах по результатам мониторинга 2004–2010 годов и оценка воздействия». Журнал EFSA. 9 (9): 2347. Дои:10.2903 / j.efsa.2011.2347.

- ^ Waizenegger, J .; Winkler, G .; Кубалла, Т .; Ruge, W .; Керстинг, М .; Alexy, U .; Лахенмайер, Д. В. (2012). «Анализ и оценка риска фурана в кофейных продуктах, предназначенных для подростков». Пищевые добавки и загрязняющие вещества: часть А. 29 (1): 19–28. Дои:10.1080/19440049.2011.617012. PMID 22035212. S2CID 29027966.
- ^ «Эспрессо-машины: кофе в капсулах содержит больше фурана, чем остальные». Science Daily. 14 апреля 2011 г.
- ^ а б Бахия, Н .; Аппель, К. Э. (2010). «Токсичность и канцерогенность фурана в рационе человека» (PDF). Архив токсикологии. 84 (7): 563–578. Дои:10.1007 / s00204-010-0531-у. PMID 20237914. S2CID 19389984.