Точка кипения - Boiling point

В точка кипения вещества - это температура, при которой давление газа из жидкость равно давление окружающая жидкость[1][2] и жидкость превращается в пар.
Температура кипения жидкости меняется в зависимости от давления окружающей среды. Жидкость в частичном вакуум имеет более низкую точку кипения, чем когда эта жидкость находится при атмосферное давление. Жидкость под высоким давлением имеет более высокую точку кипения, чем когда жидкость находится под атмосферным давлением. Например, вода закипает при 100 ° C (212 ° F) на уровне моря, но при 93,4 ° C (200,1 ° F) на высоте 1905 метров (6250 футов). [3] высота. При заданном давлении разные жидкости будут кипятить при разных температурах.
В нормальная точка кипения (также называемый температура кипения при атмосферном давлении или точка кипения при атмосферном давлении) жидкости - это частный случай, когда давление пара жидкости равно определенному атмосферному давлению на уровне моря, одному атмосфера.[4][5] При этой температуре давление пара жидкости становится достаточным, чтобы преодолеть атмосферное давление и позволить пузырькам пара образоваться внутри объема жидкости. В стандартная точка кипения был определен ИЮПАК с 1982 г. как температура, при которой кипение происходит под давлением в один бар.[6]
В теплота испарения это энергия, необходимая для преобразования заданного количества (моль, кг, фунт и т. д.) вещества из жидкости в газ при заданном давлении (часто атмосферном).
Жидкости могут превращаться в пар при температурах ниже их точек кипения в процессе испарение. Испарение - это поверхностное явление, при котором молекулы, расположенные у края жидкости, не сдерживаемые достаточным давлением жидкости с этой стороны, уходят в окружающую среду в виде пар. С другой стороны, кипячение это процесс, при котором молекулы в любом месте жидкости ускользают, что приводит к образованию пузырьков пара внутри жидкости.
Температура и давление насыщения
А насыщенная жидкость содержит столько тепловой энергии, сколько может без кипения (или, наоборот, насыщенный пар содержит как можно меньше тепловой энергии без уплотнение ).
Температура насыщения средства точка кипения. Температура насыщения - это температура для соответствующего давления насыщения, при котором жидкость кипит, превращаясь в паровая фаза. Можно сказать, что жидкость насыщена тепловая энергия. Любое добавление тепловой энергии приводит к фаза перехода.
Если давление в системе остается постоянным (изобарический ), пар при температуре насыщения начнет конденсироваться в жидкую фазу в виде тепловой энергии (высокая температура ) удален. Точно так же жидкость при температуре и давлении насыщения будет кипеть в свою паровую фазу при приложении дополнительной тепловой энергии.
Точка кипения соответствует температуре, при которой давление пара жидкости равно давлению окружающей среды. Таким образом, температура кипения зависит от давления. Точки кипения могут быть опубликованы в отношении NIST, США стандартное давление из 101325 кПа (или 1 банкомат ), или ИЮПАК стандартное давление 100000 кПа. На больших высотах, где атмосферное давление намного ниже, температура кипения также ниже. Температура кипения увеличивается с повышением давления до критическая точка, где свойства газа и жидкости становятся идентичными. Точка кипения не может быть увеличена выше критической точки. Точно так же точка кипения снижается при понижении давления до тех пор, пока тройная точка достигнуто. Точка кипения не может быть понижена ниже тройной точки.
Если известна теплота парообразования и давление пара жидкости при определенной температуре, точку кипения можно рассчитать с помощью Уравнение Клаузиуса – Клапейрона, таким образом:
куда:
- - температура кипения при интересующем давлении,
- это постоянная идеального газа,
- это давление газа жидкости при интересующем давлении,
- какое-то давление, где соответствующее известна (обычно данные доступны при 1 атм или 100 кПа),
- это теплота испарения жидкости,
- температура кипения,
- это натуральный логарифм.
Давление насыщения - давление для соответствующей температуры насыщения, при которой жидкость переходит в паровую фазу. Давление насыщения и температура насыщения имеют прямую зависимость: с увеличением давления насыщения увеличивается и температура насыщения.
Если температура в система остается постоянным ( изотермический системы), пар при давлении насыщения и температуре начнет конденсировать в жидкую фазу по мере увеличения давления в системе. Точно так же жидкость при давлении насыщения и температуре будет иметь тенденцию к вспышка в паровую фазу при понижении давления в системе.
Есть два соглашения относительно стандартная температура кипения воды: The нормальная точка кипения составляет 99,97° C (211.9 ° F ) при давлении 1 атм (т.е. 101,325 кПа). ИЮПАК рекомендовал стандартная температура кипения воды при стандартном давлении 100 кПа (1 бар)[7] составляет 99,61° C (211.3 ° F ).[6][8] Для сравнения поверх гора Эверест, на высоте 8 848 м (29 029 футов) давление составляет около 34кПа (255 Торр )[9] а температура кипения воды 71° C (160 ° F Температурная шкала Цельсия определялась до 1954 года двумя точками: 0 ° C определялось точкой замерзания воды, а 100 ° C определялось температурой кипения воды при стандартном атмосферном давлении.
Связь между нормальной температурой кипения и давлением пара жидкостей
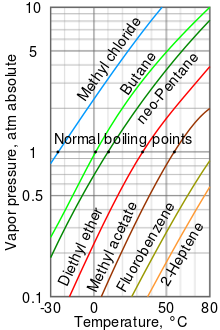
Чем выше давление пара жидкости при данной температуре, тем ниже нормальная точка кипения (то есть точка кипения при атмосферном давлении) жидкости.
На диаграмме давления пара справа представлены графики зависимости давления пара от температуры для различных жидкостей.[10] Как видно из диаграммы, жидкости с самым высоким давлением пара имеют самую низкую нормальную температуру кипения.
Например, при любой заданной температуре метилхлорид имеет самое высокое давление пара среди всех жидкостей в таблице. Он также имеет самую низкую нормальную точку кипения (-24,2 ° C), где кривая давления паров хлористого метила (синяя линия) пересекает горизонтальную линию давления в одну атмосферу (банкомат ) абсолютного давления пара.
В критическая точка жидкости - это самая высокая температура (и давление), при которой она действительно закипит.
Смотрите также Давление паров воды.
Свойства элементов
Элемент с самой низкой точкой кипения - это гелий. Обе точки кипения рений и вольфрам превышает 5000 K в стандартное давление; Поскольку трудно точно измерить экстремальные температуры без предвзятости, в литературе упоминается, что оба они имеют более высокую температуру кипения.[11]
Температура кипения как эталонное свойство чистого соединения
Как видно из приведенного выше графика зависимости логарифма давления пара от температуры для любого заданного чистого химическое соединение, его нормальная температура кипения может служить индикатором общего непостоянство. Данное чистое соединение имеет только одну нормальную точку кипения, если таковая имеется, и нормальную точку кипения соединения и температура плавления может служить характеристикой физические свойства для этого соединения, перечисленного в справочниках. Чем выше нормальная точка кипения соединения, тем менее летучим является это соединение в целом, и, наоборот, чем ниже нормальная точка кипения соединения, тем более летучим это соединение в целом. Некоторые соединения разлагаются при более высоких температурах, прежде чем достичь своей нормальной точки кипения, а иногда даже до точки плавления. Для стабильного соединения температура кипения колеблется от его тройная точка к его критическая точка, в зависимости от внешнего давления. За пределами тройной точки нормальная точка кипения соединения, если таковая имеется, выше, чем его точка плавления. За пределами критической точки жидкая и паровая фазы соединения сливаются в одну фазу, которую можно назвать перегретым газом. При любой заданной температуре, если нормальная точка кипения соединения ниже, то это соединение обычно будет существовать в виде газа при атмосферном внешнем давлении. Если нормальная точка кипения соединения выше, то это соединение может существовать в виде жидкости или твердого вещества при данной температуре при атмосферном внешнем давлении и, таким образом, будет существовать в равновесии со своим паром (если летучим), если его пары содержатся. Если пары соединения не содержатся, то некоторые летучие соединения могут в конечном итоге улетучиваться, несмотря на их более высокие температуры кипения.
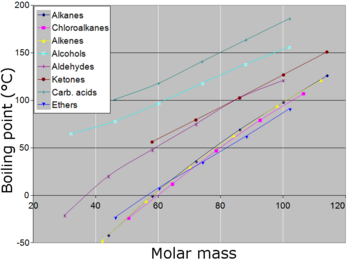
В общем, соединения с ионные связи имеют высокие температуры кипения, если они не разлагаются до достижения таких высоких температур. Много металлы имеют высокие температуры кипения, но не все. В очень общем случае - при прочих равных условиях - в соединениях с ковалентно связанными молекулы, как размер молекулы (или молекулярная масса ) увеличивается, нормальная температура кипения увеличивается. Когда размер молекулы становится равным макромолекула, полимер, или иначе очень большое, соединение часто разлагается при высокой температуре до того, как будет достигнута точка кипения. Еще одним фактором, влияющим на нормальную температуру кипения соединения, является полярность его молекул. По мере того, как полярность молекул соединения увеличивается, его нормальная точка кипения увеличивается, при прочих равных условиях. Тесно связана способность молекулы образовывать водородные связи (в жидком состоянии), что затрудняет выход молекул из жидкого состояния и, таким образом, увеличивает нормальную точку кипения соединения. Простой карбоновые кислоты димеризуется, образуя водородные связи между молекулами. Незначительный фактор, влияющий на температуру кипения, - это форма молекулы. Делая форму молекулы более компактной, как правило, немного понижает нормальную точку кипения по сравнению с эквивалентной молекулой с большей площадью поверхности.
| Распространенное имя | п-бутан | изобутан |
|---|---|---|
| Название ИЮПАК | бутан | 2-метилпропан |
| Молекулярный форма |  |  |
| Кипячение точка (° C) | −0.5 | −11.7 |
| Распространенное имя | п-пентан | изопентан | неопентан |
|---|---|---|---|
| Название ИЮПАК | пентан | 2-метилбутан | 2,2-диметилпропан |
| Молекулярный форма |  |  |  |
| Кипячение точка (° C) | 36.0 | 27.7 | 9.5 |
Большинство летучих соединений (где-то около температуры окружающей среды) проходят через промежуточную жидкую фазу, нагреваясь от твердой фазы, чтобы в конечном итоге перейти в паровую фазу. По сравнению с кипячением сублимация представляет собой физическое превращение, при котором твердое тело превращается непосредственно в пар, что происходит в некоторых отдельных случаях, например, с углекислый газ при атмосферном давлении. Для таких соединений точка сублимации - температура, при которой твердое тело, превращающееся непосредственно в пар, имеет давление пара, равное внешнему давлению.
Примеси и смеси
В предыдущем разделе были рассмотрены температуры кипения чистых соединений. На давление паров и температуру кипения веществ может влиять присутствие растворенных примесей (растворенные вещества ) или других смешиваемых соединений, степень воздействия зависит от концентрации примесей или других соединений. Наличие нелетучих примесей, таких как соли или соединения непостоянство намного ниже, чем основной компонент, уменьшает его мольная доля и решение летучесть, и, таким образом, повышает нормальную температуру кипения пропорционально концентрация растворенных веществ. Этот эффект называется повышение точки кипения. В качестве общего примера соленая вода кипит при более высокой температуре, чем чистая вода.
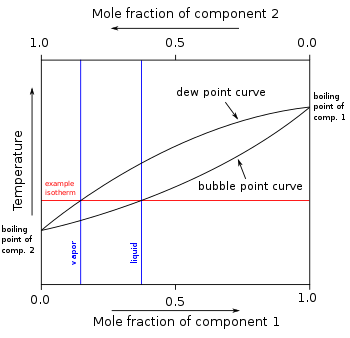
В других смесях смешиваемых соединений (компонентов) могут быть два или более компонентов с различной летучестью, каждый из которых имеет свою собственную точку кипения чистого компонента при любом заданном давлении. Присутствие других летучих компонентов в смеси влияет на давление пара и, следовательно, на точки кипения и точки росы всех компонентов в смеси. Точка росы - это температура, при которой пар конденсируется в жидкость. Более того, при любой заданной температуре состав пара отличается от состава жидкости в большинстве таких случаев. Чтобы проиллюстрировать эти эффекты между летучими компонентами в смеси, диаграмма точки кипения обычно используется. Дистилляция представляет собой процесс кипения и [обычно] конденсации, в котором используются различия в составе жидкой и паровой фаз.
Смотрите также
- Точки кипения элементов (страница данных)
- Повышение температуры кипения
- Критическая точка (термодинамика)
- Эбуллиометр, прибор для точного измерения температуры кипения жидкостей
- Метод Joback (Оценка нормальных температур кипения по молекулярной структуре)
- Список газов включая точки кипения
- Переохлаждение
- Перегрев
- Постоянная Траутона соотнесение скрытой теплоты с температурой кипения
- Тройная точка
Рекомендации
- ^ Голдберг, Дэвид Э. (1988). 3000 решенных задач по химии (1-е изд.). Макгроу-Хилл. раздел 17.43, с. 321. ISBN 0-07-023684-4.
- ^ Теодор, Луи; Дюпон, Р. Райан; Ганесан, Кумар, ред. (1999). Предотвращение загрязнения: подход к управлению отходами в 21 веке. CRC Press. раздел 27, с. 15. ISBN 1-56670-495-2.
- ^ «Точка кипения воды и высота». www.engineeringtoolbox.com.
- ^ Глоссарий по общей химии Университет Пердью страница сайта
- ^ Катушка, Кевин Р .; Fikar, R.M .; Dumas, P.E .; Темплин, Джей М. и Ван Арнум, Патрисия (2006). AP Chemistry (REA) - Лучшая подготовка к экзамену Advanced Placement Exam (9-е изд.). Ассоциация исследований и образования. раздел 71, с. 224. ISBN 0-7386-0221-3.
- ^ а б Кокс, Дж. Д. (1982). «Обозначения для состояний и процессов, значение слова« стандарт »в химической термодинамике и замечания о обычно табулированных формах термодинамических функций». Чистая и прикладная химия. 54 (6): 1239–1250. Дои:10.1351 / pac198254061239.
- ^ Стандартное давление ИЮПАК определяет «стандартное давление» как 105 Па (что составляет 1 бар).
- ^ Приложение 1. Таблицы и диаграммы свойств (единицы СИ), Прокрутите вниз до Таблицы A-5 и прочтите значение температуры 99,61 ° C при давлении 100 кПа (1 бар). Получено с веб-сайта высшего образования Макгроу-Хилла.
- ^ Уэст, Дж. Б. (1999). «Барометрическое давление на Эвересте: новые данные и физиологическое значение». Журнал прикладной физиологии. 86 (3): 1062–6. Дои:10.1152 / jappl.1999.86.3.1062. PMID 10066724.
- ^ Perry, R.H .; Грин Д.У., ред. (1997). Справочник инженеров-химиков Перри (7-е изд.). Макгроу-Хилл. ISBN 0-07-049841-5.
- ^ ДеВо, Ховард (2000). Термодинамика и химия (1-е изд.). Прентис-Холл. ISBN 0-02-328741-1.
внешняя ссылка
- . . 1914.










