Хинолин - Quinoline
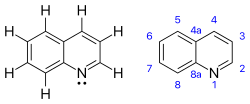 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Хинолин[2] | |||
Систематическое название ИЮПАК
| |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.001.865 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| MeSH | Хинолины | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2656 | ||
| |||
| |||
| Характеристики | |||
| C9ЧАС7N | |||
| Молярная масса | 129.16 г / моль | ||
| Внешность | Бесцветная маслянистая жидкость | ||
| Плотность | 1.093 г / мл | ||
| Температура плавления | -15 ° С (5 ° F, 258 К) | ||
| Точка кипения | 237 ° С (459 ° F, 510 К), 760 мм рт. 108–110 ° C (226–230 ° F), 11 мм рт. | ||
| Слабо растворим | |||
| Растворимость | Растворим в спирте, эфире и сероуглероде | ||
| Кислотность (пKа) | 4,85 (сопряженная кислота)[3] | ||
| −86.0·10−6 см3/ моль | |||
| Термохимия | |||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 174.9 кДж · моль−1 | ||
| Опасности | |||
| R-фразы (устарело) | R21, R22 | ||
| S-фразы (устарело) | S26, S27, S28, S29, S30, Шаблон: S31, Шаблон: S32, S33, Шаблон: S34, S35, S36 | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 101 ° С (214 ° F, 374 К) | ||
| 400 ° С (752 ° F, 673 К) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 331 мг / кг | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Хинолин это гетероциклический ароматный органическое соединение с химической формулой C9ЧАС7Н. Это бесцветный гигроскопичный жидкость с резким запахом. Старые образцы, особенно под воздействием света, становятся желтыми, а затем коричневыми. Хинолин слабо растворяется в холодной воде, но легко растворяется в горячей воде и большинстве органических растворителей.[4] Сам по себе хинолин имеет несколько применений, но многие из его производные полезны в различных приложениях. Ярким примером является хинин, алкалоид содержится в растениях. Более 200 биологически активных хинолинов и хиназолин алкалоиды идентифицированы.[5][6] 4-гидрокси-2-алкилхинолины (HAQ) участвуют в устойчивость к антибиотикам.
Возникновение и изоляция
Хинолин впервые был извлечен из каменноугольная смола в 1834 г. немецким химиком Фридлиб Фердинанд Рунге;[4] он назвал хинолин лейкол («белое масло» по-гречески).[7] Каменноугольная смола остается основным источником коммерческого хинолина.[8] В 1842 г. французский химик Чарльз Герхардт получено соединение сухой перегонкой хинин, стрихнин, или же цинхонин с гидроксид калия;[4] он назвал соединение Chinoilin или же Chinolein.[9] Соединения Рунге и Гепардта казались разными изомеры потому что они по-разному отреагировали. Однако немецкий химик Август Хоффманн в конце концов выяснилось, что различия в поведении связаны с наличием загрязняющих веществ и что два соединения фактически идентичны.[10] Единственное сообщение о хинолине как о натуральном продукте получено от перуанского палочника.Oreophoetes peruana. У них есть пара грудных желез, из которых они выделяют зловонную жидкость, содержащую хинолин, когда их беспокоят. (Eisner, T; Morgan, RC; Attygalle AB, Smedley, SR; Herath, KB, Meinwald, J. (1997) «Защитное производство хинолина фазмидным насекомым (Oreophoetes peruana)» J. Exp. Biol. 200, 2493– 2500).
Как и другие азотные гетероциклические соединения, такие как пиридин производные, хинолин часто упоминается как загрязнитель окружающей среды, связанный с предприятиями по переработке горючего сланца или угля, а также был обнаружен на старых участках обработки древесины. Из-за своей относительно высокой растворимости в воде хинолин имеет значительный потенциал мобильности в окружающей среде, что может способствовать загрязнению воды. Хинолин легко разлагается некоторыми микроорганизмами, такими как Родококк Вид Штамм Q1, выделенный из почвы и ила бумажных фабрик.[11]
Хинолины присутствуют в небольших количествах в сырой нефти в первичном дизель дробная часть. Его можно удалить с помощью процесса, называемого гидроденитрификация.
Синтез
Хинолины часто синтезируются из простых анилинов с использованием ряда названные реакции.
По часовой стрелке сверху это:
- Комбинирует синтез хинолина с помощью анилины и β-дикетоны.
- Синтез Конрада-Лимпаха с помощью анилины и β-кетоэфиры.
- Реакция Добнера с помощью анилины с альдегид и пировиноградная кислота с образованием хинолин-4-карбоновых кислот
- Реакция Добнера-Миллера с помощью анилины и α, β-ненасыщенные карбонил соединения.
- Реакция Гулда-Джейкобса начиная с анилина и этилэтоксиметиленмалоната
- Синтез Скраупа с помощью сульфат железа, глицерин, анилин, нитробензол, и серная кислота.
Существует ряд других процессов, для которых требуются специально замещенные анилины или родственные соединения:
- Лагерный синтез хинолина с использованием о-ациламиноацетофенона и гидроксида
- Синтез Фридлендера с помощью 2-аминобензальдегид и ацетальдегид
- Кнорр синтез хинолина, используя β-кетоанилид и серную кислоту
- Ниментовский синтез хинолина, используя антраниловую кислоту и кетоны
- Реакция Пфитцингера используя изатин с основанием и карбонильным соединением с образованием замещенных хинолин-4-карбоновых кислот
- Поварова реакция используя анилин, а бензальдегид и активированный алкен
Приложения
Хинолин используется в производстве красители, подготовка гидроксихинолин сульфат и ниацин. Он также используется в качестве растворителя для смолы и терпены.
Хинолин в основном используется, как и в производстве других специальные химикаты. Примерно 4 тонны составляются ежегодно согласно отчету, опубликованному в 2005 году.[8] Его основное использование - это предшественник 8-гидроксихинолин, который является универсальным хелатирующим агентом и предшественником пестицидов. Его 2- и 4-метил производные являются предшественниками цианиновые красители. Окисление хинолина дает хинолиновая кислота (пиридин-2,3-дикарбоновая кислота), предшественник гербицида, продаваемого под названием «Assert».[8]
Восстановление хинолина с борогидрид натрия в присутствии уксусная кислота как известно, производит Кайролайн А.[12] (C.f. Кайрин )
Хинолин имеет несколько противомалярийный производные, в том числе хинин, хлорохин, амодиахин, и примахин.
Хинолины восстанавливаются до тетрагидрохинолины энантиоселективно с использованием нескольких каталитических систем.[13][14]

Смотрите также
- Хинолиновые алкалоиды
- 4-аминохинолин
- 8-гидроксихинолин
- Пирролохинолинхинон (PQQ), редокс-кофактор и неоднозначная пищевая добавка
- Хиназолин, аза производное хинолина
- Хинин
- Похожий простые ароматические кольца
- Изохинолин, аналог с атомом азота в положении 2
- Пиридин, аналог без предохранителя бензол звенеть
- Нафталин, аналог с углеродом вместо азота
- Индол, аналог только с пятичленным азотным кольцом
Рекомендации
- ^ «ХИНОЛИН (БЕНЗОПИРИДИН)». Chemicalland21.com. Получено 2012-06-14.
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 4, 211. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Название «хинолин» - это сохраненное название, которое предпочтительнее альтернативных систематических названий слияния «1-бензопиридин» или «бензо [б] пиридин.
- ^ Brown, H.C., et al., В Baude, E.A. и Наход, ФК, Определение органических структур физическими методами., Academic Press, Нью-Йорк, 1955.
- ^ а б c Чисхолм, Хью, изд. (1911). . Британская энциклопедия. 22 (11-е изд.). Издательство Кембриджского университета. п. 759.
- ^ Шан, XF; Моррис-Натшке, SL; Лю, YQ; Guo, X; Сюй, XS; Гото, М; Li, JC; Ян, GZ; Ли, К. Х. (май 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть I.» Обзоры медицинских исследований. 38 (3): 775–828. Дои:10.1002 / мед.21466. ЧВК 6421866. PMID 28902434.
- ^ Шан, Сяо-Фэй; Morris-Natschke, Susan L .; Ян, Гуань-Чжоу; Лю Инь-Цянь; Го, Сяо; Сюй, Сяо-Шань; Гото, Масуо; Ли, Цзюнь-Цай; Чжан, Цзи-Ю; Ли, Куо-Сюн (сентябрь 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть II». Обзоры медицинских исследований. 38 (5): 1614–1660. Дои:10.1002 / med.21492. ЧВК 6105521. PMID 29485730.
- ^ Ф. Ф. Рунге (1834) "Ueber einige Produkte der Steinkohlendestillation" (По некоторым продуктам перегонки угля), Annalen der Physik und Chemie, 31 (5): 65–78; см. особенно стр. 68: «3. Leukol oder Weissöl» (3. Белое масло [по-гречески] или белое масло [по-немецки]). С п. 68: "Diese dritte Basis habe ich Leukol oder Weissöl genannt, weil sie keine farbigen Reactionen zeigt." (Эта третья база, которую я назвал лейкол или белое масло, потому что оно не показывает цветных реакций.)
- ^ а б c Герд Коллин; Хартмут Хёке. «Хинолин и изохинолин». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_465.
- ^ Герхардт, гл. (1842) "Untersuchungen über die organischen Basen" (Исследования органических оснований), Annalen der Chemie und Pharmacie, 42 : 310-313. См. Также: (Редактор) (1842 г.) «Чинолеин или чиноилин» (Хинолин или хиноилин), Annalen der Chemie und Pharmacie, 44 : 279-280.
- ^ Первоначально Хоффманн думал, что Рунге Лейкол и Герхардта Chinolein были отчетливыми. (См .: Гофман, Август Вильгельм (1843). "Chemische Untersuchungen der Organischen Basen im Steinkohlen-Theeröl" (Химические исследования органических оснований в каменноугольном масле), Annalen der Chemie und Pharmacie, 47 : 37-87; см. особенно стр. 76-78.) Однако после дальнейшей очистки его Лейкол образца, Хоффманн определил, что они действительно идентичны. (См .: (Редактор) (1845) "Vorläufige Notiz über die Identität des Leukols und Chinolins" (Предварительное уведомление о идентичности лейкола и хинолина), Annalen der Chemie und Pharmacie, 53 : 427-428.)
- ^ О'Лафлин, Эдвард Дж .; Kehrmeyer, Staci R .; Симс, Джеральд К. (1996). «Выделение, характеристика и использование субстрата бактерии, разлагающей хинолин». Международный биодестерирование и биоразложение. 38 (2): 107. Дои:10.1016 / S0964-8305 (96) 00032-7.
- ^ ГРИББЛ, Гордон В .; ЗДОРОВЬЕ, Питер В. (1975). «Реакции боргидрида натрия в кислой среде; III. Восстановление и алкилирование хинолина и изохинолина карбоновыми кислотами». Синтез. 1975 (10): 650–652. Дои:10.1055 / с-1975-23871. ISSN 0039-7881.
- ^ Xu, L .; Lam, K. H .; Ji, J .; Wu, J .; Fan, Q.-H .; Lo, W.-H .; Чан, А.С.С. Chem. Commun. 2005, 1390.
- ^ Reetz, M. T .; Ли, X. Chem. Commun. 2006, 2159.