Синтез хинолина Knorr - Википедия - Knorr quinoline synthesis
| Кнорр синтез хинолина | |
|---|---|
| Названный в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000394 |
В Кнорр синтез хинолина является внутримолекулярный органическая реакция преобразование β-кетоанилид к 2-гидроксихинолин с помощью серная кислота. Эта реакция была впервые описана Людвиг Кнорр (1859–1921) в 1886 г.[1]

Реакция - это тип электрофильное ароматическое замещение сопровождаемый устранение воды. Исследование 1964 года показало, что при определенных условиях реакции образование 4-гидроксихинолина является конкурирующей реакцией.[2] Например, соединение бензоилацетанилид (1) образует 2-гидроксихинолин (2) при большом превышении полифосфорная кислота (PPA) но 4-гидроксихинолин 3 когда количество PPA невелико. А механизм реакции идентифицировали N, O-дикатионный промежуточный продукт А с избытком кислоты, способной к замыканию цикла, и монокатионным промежуточным продуктом B какие фрагменты анилин и (в конечном итоге) ацетофенон. Анилин реагирует с другим эквивалентом бензоилацетанилида до образования 4-гидроксихинолина.

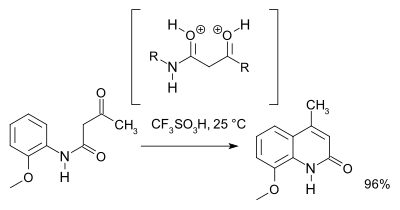
Исследование 2007 года[3] пересмотрел механизм реакции и на основе ЯМР-спектроскопия и теоретические расчеты отдают предпочтение O, O-дикатионному промежуточному соединению (a суперэлектрофил ) над дикатионным интермедиатом N, O. В препаративных целях трифликовая кислота Рекомендовано:
Рекомендации
- ^ Synthetische Versuche mit dem Acetessigester Annalen der Chemie Юстуса Либиха Том 236, выпуск 1–2, дата: 1886, Страницы: 69–115 Людвиг Кнорр Дои:10.1002 / jlac.18862360105
- ^ Превращение бензоилацетанилидов в 2- и 4-гидроксихинолины Б. Стаскун J. Org. Chem. 1964; 29(5); 1153–1157. Дои:10.1021 / jo01028a038
- ^ Циклизации Кнорра и дистонические суперэлектрофилы Киран Кумар Солингапурам Сай, Томас М. Гилберт и Дуглас А. Клумпп J. Org. Chem. 2007, 72, 9761–9764 Дои:10.1021 / jo7013092
