Ниментовский синтез хинолина - Niementowski quinoline synthesis
| Ниментовский синтез хинолина | |
|---|---|
| Названный в честь | Стефан Нементовски |
| Тип реакции | Реакция образования кольца |
В Ниментовский синтез хинолина это химическая реакция из антраниловые кислоты и кетоны (или же альдегиды ) с образованием производных γ-гидроксихинолина.[1][2][3][4]
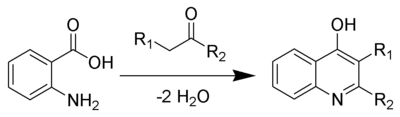
Обзор
В 1894 г. Нементовский сообщили, что 2-фенил-4-гидроксихинолин образуется при нагревании антраниловой кислоты и ацетофенона до 120–130 ° C. Позже он обнаружил, что при более высокой температуре, 200 ° C, антраниловая кислота и гептальдегид образуют минимальные выходы 4-гидрокси-3-пентахинолина.[5] Опубликовано несколько обзоров.[6][7]
Вариации
Температура, необходимая для этой реакции, делает ее менее популярной, чем другие. хинолин синтетические процедуры. Однако были предложены варианты, чтобы сделать эту реакцию более прагматичной и полезной. Добавление форфористого оксихлорида к реакционной смеси для проведения конденсации с образованием обоих изомеров важного предшественника важного α1антагонист адренорецепторов.[8] Когда положение 3 арилкетона замещено, было показано, что реакция типа Нементовского с пропионовой кислотой может давать 4-гидроксихинолин с 2-тиометильным заместителем.[9] Метод также был изменен для использования каталитического количества основания,[10] или в присутствии полифосфорной кислоты.[11]
Механизм
Из-за их сходства с реагентами в Синтез фридлендера хинолона, а бензальдегид с альдегид или же кетон, механизм синтеза хинолина Ниментовского минимально отличается от такового при синтезе Фридлендера. При глубоком изучении возможны два пути реакции, и оба имеют существенную поддержку.[5] Считается, что реакция начинается с образования основания Шиффа, а затем протекает через внутримолекулярную конденсацию с образованием промежуточного имина (см. Ниже). Затем происходит потеря воды, которая приводит к замыканию цикла и образованию производного хинолина. Большинство данных подтверждают это как механизм в нормальных условиях 120–130 ° C. Альтернативно, реакция начинается с межмолекулярной конденсации и последующего образования иминного промежуточного соединения.[12] Было показано, что последний чаще встречается в кислых или основных условиях. Аналогичный путь был предложен для Нементовский синтез хиназолина.[13]

Рекомендации
- ^ Нементовский, С. В. (1894). "Synthesen der Chinolinderivate". Chemische Berichte. 27 (2): 1394–1403. Дои:10.1002 / cber.18940270242.
- ^ Niementowski, S. v .; Ожеховский, Б. (1895). "Synthesen der Chinolinderivate aus Anthranilsäure und Aldehyden". Chemische Berichte. 28 (3): 2809–2822. Дои:10.1002 / cber.18950280393.
- ^ Нементовский, С. В. (1905). "Ueber die Einwirkung des Benzoylessigesters auf Anthranilsäure (III. Mittheilung über Synthesen der Chinolinderivate)". Chemische Berichte. 38 (2): 2044–2051. Дои:10.1002 / cber.190503802142.
- ^ Нементовский, С. В. (1907). "Über die Einwirkung des Benzoylessigesters auf Anthranilsäure auf Anthrailsäure". Chemische Berichte. 40 (4): 4285–4294. Дои:10.1002 / cber.19070400444.
- ^ а б Харц, стр. 376–384
- ^ Манске, Р. Х. (1942). «Химия хинолинов». Chem. Ред. 30: 127. Дои:10.1021 / cr60095a006.
- ^ Хисано, Т. (1973). "Недавние исследования модифицированного синтеза 4-хиназолона Нементовского. Обзор". Орг. Prep. Процедуры. Int. 5 (4): 145–193. Дои:10.1080/00304947309355565.
- ^ Rosini, M .; Anontello, A .; Cavalli, A .; Bolognesi, M .; Минарини, А .; Marucci, G .; Poggesi, E .; Мельхиорре, К. (2003). «Празозин-родственные соединения. Влияние преобразования пиперазинилхиназолиновой части в аминометилтетрагидроакридиновую систему на сродство к α1-адренорецепторам». J. Med. Chem. 46 (23): 4895–4903. Дои:10.1021 / jm030952q. PMID 14584940.
- ^ Wang, M. -X., Liu, Y., Huang, Z, -T .; Лю; Хуанг (2001). «Новый и удобный синтез полифункциональных хинолинов, хинолонов и их реакции аннулирования». Буквы Тетраэдра. 42 (13): 2553–2555. Дои:10.1016 / S0040-4039 (01) 00231-3.CS1 maint: несколько имен: список авторов (связь)
- ^ Chong, R.J .; Siddiqui, M.A .; Снейкус, В. (1983). «Синтез хиральных аннулетов 1,4,7-триазациклононанов». Буквы Тетраэдра. 43 (21): 3795–3798. Дои:10.1016 / S0040-4039 (02) 00705-0.
- ^ Nahnda Kumar, R., Suresh, T., Mylithi, A., Mohan, P.S .; Суреш; Мифили; Мохан (2001). «Легкий доступ к пиримидо [4,5-b] хинолинам и его тиоаналогам». Гетероцикл. Сообщество. 7 (2): 193–198. Дои:10.1515 / HC.2001.7.2.193.CS1 maint: несколько имен: список авторов (связь)
- ^ Марко-Контеллес, Хосе; Перес-Майораль, Елена; Самади, Абделуахид; Каррейрас, Мария ду Карму; Сориано, Елена (2009). «Последние достижения в реакции Фридлендера». Химические обзоры. 109 (6): 2652–2671. Дои:10.1021 / cr800482c. PMID 19361199.
- ^ Харц, стр. 440–453.
Библиография
- Hartz, R. (2011) в Назовите реакции в гетероциклической химии II, Джи Джек Ли, Э. Дж. Кори (ред.), Вили, ISBN 978-0-470-08508-0.
