Нитрамид - Nitramide
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Другие имена Нитрамин | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ЧАС2N2О2 | |||
| Молярная масса | 62,03 г моль−1 | ||
| Внешность | Бесцветное твердое вещество[1] | ||
| Плотность | 1,378 г / см3 | ||
| Температура плавления | От 72 до 75 ° C (от 162 до 167 ° F, от 345 до 348 K)[1] | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
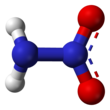
Нитрамид это химическое соединение с молекулярной формулой H2NNO2. Органил производные нитрамида, RNHNO2 называются нитроамины, и широко используются как взрывчатка: примеры включают Гексоген и HMX. Это таутомер азотистая кислота.
Структура
Молекула нитрамида по существу представляет собой аминогруппу (-NH2), связанный с нитрогруппой (-NO2). Сообщается, что в газовой фазе он не является плоским,[2] но плоские в кристаллической фазе.[1]
Синтез
Оригинальный синтез нитрамида Тиле и Лахманом включал гидролиз нитрокарбамата калия:[1]
- K2(O2NNCO2) + 2H2ТАК4 → O2NNH2 + CO2 + 2ХСО4
Другие пути получения нитрамида включают гидролиз нитрокарбаминовой кислоты,
- О2NNHCO2H → O2NNH2 + CO2
реакция сульфамат натрия с азотная кислота,
- Na (SO3NH2) + HNO3 → O2NNH2 + NaHSO4
и реакция пятиокись азота с двумя эквивалентами аммиак.
- N2О5 + 2NH3 → O2NNH2 + NH4НЕТ3
Органические нитрамиды
Органические нитрамиды, также называемые нитраминами, являются важными взрывчатыми веществами. Они подготовлены нитролиз из гексаметилентетрамин.

Рекомендации
- ^ а б c d Häußler, A .; Klapötke, T. M .; Пиотровски, Х. (2002). «Экспериментальное и теоретическое исследование структуры нитрамида H2NNO2" (PDF). Zeitschrift für Naturforschung. 57 млрд (2): 151–156.
- ^ Тайлер, Дж. К. (1963). «Микроволновый спектр нитрамида». Журнал молекулярной спектроскопии. 11 (1–6): 39–46. Дои:10.1016/0022-2852(63)90004-3.