Диаграмма Пурбе - Pourbaix diagram

В электрохимия, и в более общем плане химии растворов Диаграмма Пурбе, также известный как диаграмма потенциал / pH, EЧАС–PH диаграмма или Диаграмма pE / pH, - график возможных термодинамически устойчивых фаз (т.е., в химическое равновесие ) водной электрохимической системы. Границы (50% / 50%) между преобладающими химическими соединениями (водные ионы в растворе или твердые фазы) представлены линиями. Таким образом, диаграмму Пурбе можно читать как стандартную фазовая диаграмма с другим набором осей. Как и фазовые диаграммы, они не учитывают скорость реакции или кинетические эффекты. Помимо потенциала и pH, равновесные концентрации также зависят, например, от температуры, давления и концентрации. Диаграммы Пурбе обычно приводятся при комнатной температуре, атмосферном давлении и молярных концентрациях 10.−6 и изменение любого из этих параметров даст другую диаграмму.
Диаграммы названы в честь Марсель Пурбэ (1904–1998), русский -бельгиец химик кто их придумал.
Диаграмма
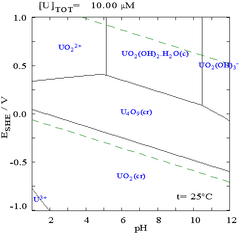

Диаграммы Пурбе также известны как EЧАС-PH диаграммы из-за разметки двух осей. Вертикальная ось обозначена EЧАС для потенциал напряжения с уважением к стандартный водородный электрод (SHE) по расчетам Уравнение Нернста. Буква «H» означает водород, хотя могут использоваться и другие стандарты, и они предназначены только для комнатной температуры.
куда вольт тепловое напряжение или «наклон Нернста» при стандартной температуре и λ = ln (10), так что вольт. Горизонтальная ось обозначена pH для функции −log от H+ ионная активность.
Линии на диаграмме Пурбе показывают условия равновесия, то есть, когда активности равны, для видов по обе стороны от этой линии. Вместо этого по обе стороны от этой линии будет считаться преобладающей одна форма вида.[3]
Чтобы нарисовать положение линий с помощью уравнения Нернста, необходимо определить активность химического вещества в состоянии равновесия. Обычно активность какого-либо вещества приблизительно равна концентрации (для растворимых веществ) или парциальному давлению (для газов). Для всех видов, присутствующих в системе, следует использовать одни и те же значения.[3]
Для растворимых веществ линии часто проводят для концентраций 1 М или 10 мкМ.−6 М. Иногда для других концентраций проводят дополнительные линии.
Если диаграмма включает равновесие между растворенными частицами и газом, давление обычно устанавливается равным п0 = 1 атм = 101325 Па, минимальное давление, необходимое для выделения газа из водного раствора при стандартных условиях.[3]
Хотя такие диаграммы можно нарисовать для любой химической системы, важно отметить, что добавление связующего металла (лиганд ) часто изменяет диаграмму. Например, карбонат оказывает большое влияние на диаграмму для урана. (См. Диаграммы справа). Присутствие следовых количеств определенных частиц, таких как ионы хлора, также может сильно повлиять на стабильность определенных веществ, разрушая пассивирующие слои.
Кроме того, изменения температуры и концентрации сольватированных ионов в растворе будут сдвигать линии равновесия в соответствии с уравнением Нернста.
Диаграммы также не принимают во внимание кинетические эффекты, а это означает, что виды, показанные как нестабильные, на практике могут не реагировать в значительной степени.
Упрощенная диаграмма Пурбе указывает на области «невосприимчивости», «коррозии» и «пассивности» вместо стабильных видов. Таким образом, они дают представление о стабильности конкретного металла в конкретной среде. Иммунитет означает, что металл не подвергается атаке, в то время как коррозия показывает, что произойдет общая атака. Пассивация возникает, когда металл образует устойчивое покрытие из оксида или другой соли на своей поверхности, лучшим примером является относительная стабильность алюминий из-за глинозем слой, образующийся на его поверхности при воздействии воздуха.
Расчет диаграммы Пурбе
Для простого случая термодинамической системы, состоящей из металла (M) и воды, можно записать различные уравнения реакции в виде:
куда р1 и р2 любые реагенты, включающие M, водород и кислород. Уравнение должно быть сбалансировано для M, H, O и заряда. Стандарт Свободная энергия Гиббса связано с каждым уравнением. Уравнение, сбалансированное по основанию, можно преобразовать в уравнение, сбалансированное по кислоте, используя константу равновесия для самоионизация воды, и ниже рассматриваются только кислотно-сбалансированные уравнения.
Далее склон Нернста (или тепловое напряжение ) используется, который имеет значение 0,02569 ... В при STP. Когда используются логарифмы по основанию 10, VТ λ = 0,05916 ... В при STP, где λ= ln [10]. На диаграмме Пурбе есть три типа границ линий: вертикальные, горизонтальные и наклонные.[4][5]
Вертикальная граница
Когда электроны не обмениваются (п= 0) равновесие между р1 и р2 не зависит от потенциала электрода, и граничная линия будет вертикальной линией с определенным значением pH. Уравнение реакции можно записать:
а энергетический баланс записывается как куда K это константа равновесия: . Таким образом:
или, используя десятичный логарифм,
которое может быть решено для конкретного значения pH.
Например[4] рассмотрим систему железа и воды и линию равновесия между железо ион Fe3+ ион и гематит Fe2О3. Уравнение реакции:
у которого есть .[4] Тогда оказывается, что pH вертикальной линии на диаграмме Пурбе составляет:
В STP для [Fe3+] = 10−6, [Fe2О3] = [H2O] = 1, это дает pH = 1,76.
Горизонтальная граница
Когда H+ и ОН− ионы не участвуют, граница горизонтальная, не зависит от pH. Уравнение реакции записывается:
Энергетический баланс
Используя определение потенциала электрода ∆G = -F E, это можно переписать в виде уравнения Нернста:
или, используя логарифмы с основанием 10:
Для примера железа и воды рассмотрим границу между Fe2+ и Fe3+ . Уравнение реакции:
а так как в ней участвуют электроны, то Eo = 0,771 В[6] а поскольку H+ ионы не участвуют, это не зависит от pH. В зависимости от температуры
Для обоих ионных частиц при на СТП, и граница будет горизонтальной линией на Eчас= 0,771 вольт. Это зависит от температуры.
Наклонная граничная линия
В этом случае и электроны, и H+ ионы участвуют, а потенциал электрода является функцией pH. Уравнение реакции можно записать:
Используя выражения для свободной энергии через потенциалы, энергетический баланс задается уравнением Нернста:
В качестве примера железа и воды рассмотрим границу между ионом двухвалентного железа Fe2+ и гематит Fe2О3. Уравнение реакции имеет вид:
с .[4] Уравнение граничной линии, выраженное в десятичных логарифмах, будет:
Для [Fe2О3] = [H2O] = 1 и [Fe2+]=10−6, это дает Eчас= 1,0826 - 0,1775 pH.
Область устойчивости воды
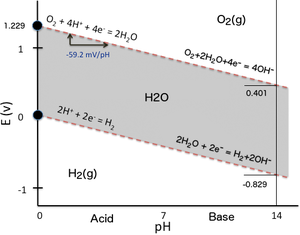
Во многих случаях возможные условия в системе ограничиваются областью устойчивости воды. На диаграмме Пурбе для урана пределы устойчивости воды отмечены двумя пунктирными зелеными линиями, а область устойчивости воды находится между этими линиями.
В условиях сильного восстановления (низкий EЧАС/ pE) вода будет восстанавливаться до водорода согласно[3]
или же
Используя уравнение Нернста, положив E0 = 0 В и летучесть газообразного водорода (соответствующая активности) при 1, уравнение для нижней линии устойчивости воды на диаграмме Пурбе будет иметь следующий вид:
при стандартной температуре и давлении. Ниже этой линии вода будет восстанавливаться до водорода, и обычно невозможно перейти за эту линию, пока есть вода, которую нужно восстановить.
Соответственно, в сильно окислительных условиях (высокие EЧАС/ pE) вода будет окисляться до газообразного кислорода в соответствии с[3]
Используя уравнение Нернста, как указано выше, но с буквой E0 = -ΔG0H2O/ 2F = 1,229 В, дает верхний предел устойчивости воды при
при стандартной температуре и давлении. Выше этой линии вода будет окисляться с образованием газообразного кислорода, и обычно невозможно выйти за эту линию, пока еще присутствует вода для окисления.
Использует
Диаграммы Пурбе имеют несколько применений, например, в исследованиях коррозии, геолого-геофизических исследованиях и исследованиях окружающей среды. Правильное использование диаграммы Пурбе поможет пролить свет не только на природу частиц, присутствующих в растворе (или образце), но также может помочь понять механизм реакции.[7]
В химии окружающей среды
Диаграммы Пурбе широко используются для описания химического поведения химических веществ в гидросфере. В этих случаях, потенциал сокращения pE используется вместо EЧАС.[3] pE - безразмерное число, которое легко соотнести с EЧАС по уравнению
Значения pE в химии окружающей среды колеблются от –12 до +25, поскольку при низком или высоком потенциале вода будет соответственно восстановлена или окислена. В экологических приложениях концентрация растворенных веществ обычно устанавливается в пределах 10−2 М и 10−5 M для создания линий равновесия.
Смотрите также
Рекомендации
- ^ «Университет Западного Орегона».
- ^ а б . Игнаси Пуигдоменек, База данных химического равновесия и программное обеспечение для построения графиков Hydra / Medusa (2004) Королевский технологический институт KTH, бесплатно загружаемое программное обеспечение по адресу «Архивная копия». Архивировано из оригинал на 2007-09-29. Получено 2007-09-29.CS1 maint: заархивированная копия как заголовок (связь)
- ^ а б c d е ж ван Лун, Гэри; Даффи, Стивен (2011). Химия окружающей среды - глобальная перспектива (3-е изд.). Издательство Оксфордского университета. С. 235–248. ISBN 978-0-19-922886-7.
- ^ а б c d Веринк, Э. Младший «Упрощенная процедура построения диаграмм Пурбе» (PDF). Получено 2017-03-29.
- ^ Копелиович, Дмитрий. "Диаграммы Пурбе". SubsTech. Получено 2017-03-29.
- ^ «Химия железа в природной воде» (PDF). Документ геологического управления по водоснабжению 1459. 1962. Получено 2017-03-29.
- ^ Нойхаузер Т., Беллемар-Алфорд Д., Пейн Н.А., Мартино Э. и Маузеролл Дж., Раскрытие скрытых реакций в гальванических ячейках, Электрокатализ, 2018, Дои:10.1007 / s12678-018-0459-1.
- Брукинс, Д., Eh-pH диаграммы для геохимии. 1988 г., Springer-Verlag, ISBN 0-387-18485-6
- Денни А. Джонс, Принципы и предотвращение коррозии, 2-е издание, 1996 г., Prentice Hall, Upper Saddle River, NJ. ISBN 0-13-359993-0 Стр. 50-52
- Пурбэ, М., Атлас электрохимических равновесий в водных растворах. 2-е англ. Изд. 1974, Хьюстон, Техас: Национальная ассоциация инженеров-коррозионистов.
- Такено, Наото (май 2005 г.). Атлас диаграмм Eh-pH (Взаимное сравнение термодинамических баз данных) (PDF) (Отчет). Цукуба, Ибараки, Япония: Национальный институт передовых промышленных наук и технологий - Исследовательский центр глубоких геологических сред. Получено 2017-05-16.
внешняя ссылка
- Марсель Пурбэ - Доктора коррозии
- Пакет преподавания и обучения DoITPoMS - «Уравнение Нернста и диаграммы Пурбе»
Программного обеспечения
- ChemEQL Бесплатное программное обеспечение для расчета химического равновесия от Eawag.
- FactSage Коммерческое программное обеспечение банка термодинамических данных, также доступное в бесплатном веб приложение.
- Верстак геохимика Коммерческое программное обеспечение для геохимического моделирования от A Water Solutions LLC.
- GWB Student Edition Бесплатная студенческая версия популярного пакета программ геохимического моделирования.
- ГИДРА / МЕДУЗА Бесплатное программное обеспечение для создания диаграмм химического равновесия из KTH Кафедра химии.
- HSC Химия Коммерческое программное обеспечение для термохимических расчетов от Outotec Oy.
- PhreePlot Бесплатная программа для построения геохимических графиков с использованием USGS код PHREEQC.
- Окна Thermo-Calc Коммерческое программное обеспечение для термодинамических расчетов от Thermo-Calc Software.
- Материалы проекта Общедоступный веб-сайт, который может создавать диаграммы Пурбе из большой базы данных вычисленных свойств материалов, размещенной на NERSC.

![{ displaystyle E _ { text {H}} = E ^ {0} - { frac {V_ {T} lambda} {n}} log { frac {[C] ^ {c} [D] ^ {d}} {[A] ^ {a} [B] ^ {b}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee5e4550e539eb3a29ea4281eb96eb9bc5115bfe)








![{ displaystyle K = [r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2 ! O}}] ^ {c} [{ ce {H +}}] ^ {d}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87adfc0c9e0154a616838c46c049bc55f29b0b78)
![{ displaystyle Delta G ^ { circ} = - RT ln ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c} [{ ce {H +}}] ^ {d})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6379c0a1205f4e534ff2dece3c377c19b1a91f94)
![{ displaystyle Delta G ^ { circ} = - (RT lambda) , ( log ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O] }}] ^ {c}) - d , { ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc62325717e1f27690ddbf1cb9bf2657ebdc3d7c)


![{ displaystyle { ce {pH}} = { frac {1} {6}} left ({ frac { Delta G ^ { circ}} {RT lambda}} + log left ({ frac {{ ce {[Fe2O3]}}} {{ ce {[Fe ^ {3 +}] ^ 2 [H2O] ^ 3}}}} right) right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed92083e91c693c8205cf35ca48cec5a8f4eb96e)

![{ displaystyle Delta G = Delta G ^ { circ} - (RT) ln [r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49573779d6c31dd6dcae88b60beb35e8384fc098)
![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T}} {n}} ln ([r_ {1}] ^ {a} [r_ {2}] ^ {b} [{ ce {H2O}}] ^ {c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fdc8eecdeb1b7458fc95d793cb9e6277f514298)
![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T} lambda} {n}} log ([r_ {1}] ^ {a} [r_ {2} ] ^ {b} [{ ce {H2O}}] ^ {c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dca188b0b051f5e3d0006b46d6e4ef0d93c66dba)

![{ displaystyle E_ {h} = {E ^ { circ}} + V_ {T} lambda log left ({ frac {{ ce {[Fe ^ {2 +}]}}}} {{ ce {[Fe ^ {3 +}]}}}} right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5c40cc273dbc059e29da9efe26d66944aa5c7)



![{ displaystyle E_ {h} = {E ^ { circ}} + { frac {V_ {T} lambda} {n}} ( log ([r_ {1}] ^ {a} [r_ {2 }] ^ {b} [{ ce {H2O}}] ^ {c}) - d , { ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4ede4b68bc1cb439390de991bba0b50c2b4779e)


![{ displaystyle E_ {h} = {E ^ { circ}} - { frac {V_ {T} lambda} {2}} left ( log left ({ frac {{ ce {[Fe ^ {+ 2}] ^ 2 [H2O] ^ 3}}} {{ ce {[Fe2O3]}}}} right) +6 { ce {pH}} right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a9ef1c99cc5b13ceaf698f773290a079c3988f)





