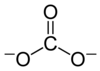
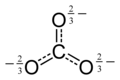
Карбонат - Carbonate
 | |
| Имена | |
|---|---|
| Название ИЮПАК Карбонат | |
| Систематическое название ИЮПАК Триоксидокарбонат[1]:127 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| CO2− 3 | |
| Молярная масса | 60.008 г · моль−1 |
| Конъюгированная кислота | Бикарбонат |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В химии карбонат это соль из угольная кислота (ЧАС2CO3),[2] характеризуется наличием карбонат-ион, а многоатомный ион с формулой CO2−
3. Имя может также относиться к карбонатный эфир, органическое соединение, содержащее карбонат группа C (= O) (O–)2.
Этот термин также используется как глагол для описания карбонизация: процесс повышения концентрации карбонатов и бикарбонат ионы в воде для производства газированная вода и другие газированные напитки - либо путем добавления углекислый газ газ под давлением или растворением карбонатных или бикарбонатных солей в воде.
В геология и минералогия, термин «карбонат» может относиться как к карбонатные минералы и карбонатная порода (который состоит в основном из карбонатных минералов), и в обоих преобладает карбонат-ион, CO2−
3. Карбонатные минералы чрезвычайно разнообразны и повсеместно встречаются в химически осажденных осадочная порода. Наиболее распространены кальцит или же карбонат кальция, CaCO3, главный компонент известняк (а также основной компонент моллюск снаряды и коралл скелеты); доломит, карбонат кальция и магния CaMg (CO3)2; и сидерит, или же утюг (II) карбонат, FeCO3, важно железная руда. Карбонат натрия («сода» или «натрон») и карбонат калия («поташ») использовались с древних времен для очистки и консервирования, а также для изготовления стекло. Карбонаты широко используются в промышленности, например при выплавке чугуна, в качестве сырья для портландцемент и Лайм производство, в составе керамические глазури, и больше.
Структура и склеивание
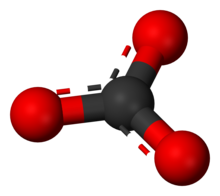
Карбонат-ион - самый простой оксоуглеродный анион. Он состоит из одного углерод атом в окружении трех кислород атомов, в тригонально плоский договоренность, с D3ч молекулярная симметрия. Он имеет молекулярную массу 60,01.г / моль и несет в себе общую официальное обвинение −2. Это сопряженное основание из гидрокарбонат (бикарбонат) ион HCO−
3, которая является сопряженной базой ЧАС
2CO
3, угольная кислота.
В Структура Льюиса карбонат-иона имеет две (длинные) одинарные связи с отрицательными атомами кислорода и одну короткую двойную связь с нейтральным кислородом.
Эта структура несовместима с наблюдаемой симметрией иона, что означает, что все три связи имеют одинаковую длину и что три атома кислорода эквивалентны. Как и в случае с изоэлектронный нитрат иона симметрия может быть достигнута резонанс среди трех структур:
Этот резонанс можно описать моделью с дробными связями и делокализованный сборы:
Химические свойства
Карбонаты металлов обычно разлагаются при нагревании, выделяя углекислый газ в течение длительного времени. цикл углерода к краткосрочному циклу углерода и оставлению оксида металла.[2] Этот процесс называется прокаливание, после кал, латинское название негашеной извести или оксид кальция, CaO, который получают обжигом известняка в печь для обжига извести.
Карбонатная соль образуется, когда положительно заряженный ион, M+
, M2+
, или же M3+
, связывается с отрицательно заряженными атомами кислорода иона, образуя электростатические аттракционы с ними, образуя ионный сложный:
- 2 M+
+ CO2−
3 → M
2CO
3
- M2+
+ CO2−
3 → MCO
3
- 2 M3+
+ 3 CO2−
3 → M
2(CO
3)
3
Большинство карбонатных солей нерастворимый в воды в стандартная температура и давление, с константы растворимости менее чем 1×10−8. Исключения включают литий, натрий, калий и аммоний карбонаты, а также многие карбонаты урана.
В водный раствор карбонат, бикарбонат, диоксид углерода и угольная кислота существуют вместе в динамическое равновесие. В сильноосновных условиях преобладает карбонат-ион, а в слабоосновных условиях - ион карбоната. бикарбонат ion преобладает. В более кислых условиях водные углекислый газ, CO2(aq) - основная форма, которая с водой H2O находится в равновесии с угольной кислотой - равновесие сильно зависит от углекислого газа. Таким образом карбонат натрия базовый, бикарбонат натрия является слабоосновным, а сам углекислый газ - слабой кислотой.
Газированная вода образуется при растворении CO2 в воде под давлением. Когда парциальное давление CO2 уменьшается, например, когда банка с газированной водой открыта, равновесие для каждой из форм карбоната (карбонат, бикарбонат, диоксид углерода и угольная кислота) смещается до тех пор, пока концентрация CO2 в растворе равна растворимости CO2 при этой температуре и давлении. В живых системах фермент, карбоангидраза, ускоряет взаимное превращение CO2 и угольная кислота.
Хотя карбонатные соли большинства металлов нерастворимы в воде, этого нельзя сказать о бикарбонатных солях. В растворе это равновесие между карбонатом, бикарбонатом, диоксидом углерода и угольной кислотой постоянно меняется в зависимости от условий изменения температуры и давления. В случае ионов металлов с нерастворимыми карбонатами, такими как CaCO3, приводит к образованию нерастворимых соединений. Это объясняет накопление накипи внутри труб, вызванное жесткая вода.
Карбонат в неорганической номенклатуре
Систематическая добавка IUPAC для карбонатного аниона - триоксидокарбонат (2-).[1]:127 По аналогии, цианид анион CN− называется нитридокарбонатом (1-).[1]:291 Однако, следуя той же логике для карбоната (4−) (ортокарбоновая кислота ) по аналогии с силикатом (4−) (ортокремниевая кислота ), в систематической добавочной номенклатуре не имеет смысла, поскольку этот вид никогда не был идентифицирован при нормальных условиях температуры и давления. Ортокарбоновая кислота энергетически намного менее стабильна, чем ортокремниевая кислота, и не может существовать при нормальных условиях из-за энергетически невыгодной орбитальной конфигурации одного центрального атома углерода, связанного с четырьмя атомами кислорода.[1]:287[3]
Органические карбонаты
В органическая химия карбонат также может относиться к функциональная группа внутри более крупной молекулы, содержащей атом углерода, связанный с тремя атомами кислорода, один из которых имеет двойную связь. Эти соединения также известны как органокарбонаты или сложные эфиры карбонатов и имеют общую формулу ROCOOR 'или RR'CO3. Важные органокарбонаты включают: диметилкарбонат, циклические соединения этиленкарбонат и пропиленкарбонат, и замена фосгена, трифосген.
Буфер
Он работает как буфер в крови следующим образом: при низком pH концентрация ионов водорода слишком высока, поэтому выдыхается CO2. Это приведет к смещению уравнения влево,[требуется дальнейшее объяснение ] существенно уменьшая концентрацию H+ ионы, вызывающие более щелочной pH.
Когда pH слишком высокий, концентрация ионов водорода в крови слишком низкая, поэтому почки выделяют бикарбонат (HCO−
3). Это заставляет уравнение сдвигаться вправо, существенно увеличивая концентрацию ионов водорода, вызывая более кислый pH.
Три важных обратимых реакции контролируют указанный выше баланс pH:[4]
- ЧАС2CO3 ⇌ H+ + HCO−
3
- ЧАС2CO3 ⇌ CO2 + H2О
- CO2(водный) ⇌ CO2(грамм)
Выдыхаемый CO2(g) истощает CO2(aq), который, в свою очередь, потребляет H2CO3, вызывая вышеупомянутый сдвиг влево в первой реакции на Принцип Ле Шателье. По тому же принципу, когда pH слишком высок, почки выделяют бикарбонат (HCO−
3) в мочу в виде мочевины через цикл мочевины (или орнитиновый цикл Кребса – Хенселейта). Удалив бикарбонат, больше H+ образуется из угольной кислоты (H2CO3), который исходит от CO2(g) произведено клеточное дыхание.
Что особенно важно, тот же буфер действует в океанах. Это главный фактор в изменении климата и долгосрочном углеродном цикле из-за большого количества морских организмов (особенно кораллов), которые образованы из карбоната кальция. Повышенная растворимость карбоната за счет повышения температуры приводит к снижению производства морских кальцит и повышенная концентрация углекислого газа в атмосфере. Это, в свою очередь, увеличивает температуру Земли. Тоннаж CO2−
3 находится в геологическом масштабе и может все повторно растворяться в море и выбрасываться в атмосферу, увеличивая CO2 уровни даже больше.[нужна цитата ]
Карбонатные соли
- Обзор карбонатов:
Присутствие за пределами Земли
Принято считать, что присутствие карбонатов в камень является веским доказательством наличия жидкой воды. Недавние наблюдения планетарная туманность NGC 6302 показать доказательства наличия карбонатов в космосе,[5] где водные изменения, подобные земным, маловероятны. Были предложены другие минералы, которые соответствовали бы наблюдениям.
До не давнего времени карбонатные отложения не были обнаружены на Марсе с помощью дистанционного зондирования или полевых миссий, хотя марсианские метеориты содержат небольшие количества. Подземные воды могли существовать в Гусев[6] и Meridiani Planum.[7]
Смотрите также
- Карбонаты крышки
- Ортокарбоновая кислота, ЧАС
4CO
4, или же С (ОН)
4, гипотетическая нестабильная молекула - Оксалат
- Пероксокарбонат
- Перкарбонат натрия
Рекомендации
- ^ а б c d Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. Электронная версия.
- ^ а б Чисхолм, Хью, изд. (1911). . Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.
- ^ Аль-Шемали Мусстафа; Болдырь Александр I (2002). «Поиск ионных ортокарбонатов: Ab initio исследование Na4CO4". J. Phys. Chem. А. 106 (38): 8951–8954. Дои:10.1021 / jp020207 +.
- ^ «Архивная копия». Архивировано из оригинал на 2011-07-21. Получено 2010-09-05.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Кемпер, Ф., Молстер, Ф.Дж., Ягер, К. и Уотерс, Л. Б. Ф. М. (2001) Минеральный состав и пространственное распределение пылевых выбросов NGC 6302. Астрономия и астрофизика 394, 679–690.
- ^ Squyres, S.W .; и другие. (2007). «Пирокластическая активность на Домашней плите в кратере Гусева, Марс» (PDF). Наука. 316 (5825): 738–742. Bibcode:2007Sci ... 316..738S. Дои:10.1126 / science.1139045. HDL:2060/20070016011. PMID 17478719.
- ^ Squyres, S.W .; и другие. (2006). "Обзор миссии марсохода Opportunity Mars на Меридиани Планум: от Кратера Орла до Чистилища" (PDF). Журнал геофизических исследований: планеты. 111 (E12): н / д. Bibcode:2006JGRE..11112S12S. Дои:10.1029 / 2006JE002771. HDL:1893/17165.