Бикарбонат натрия - Sodium bicarbonate
эта статья нужны дополнительные цитаты для проверка. (Март 2020 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
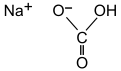 | |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гидрокарбонат натрия | |||
| Другие имена Пищевая сода, бикарбонат (лабораторный сленг), бикарбонат соды, нахолит | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 4153970 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.122 | ||
| Номер ЕС |
| ||
| Номер E | E500 (ii) (регуляторы кислотности, ...) | ||
| КЕГГ | |||
| MeSH | Натрий + бикарбонат | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Свойства | |||
| NaHCO 3 | |||
| Молярная масса | 84,0066 г моль−1 | ||
| Внешность | Белые кристаллы | ||
| Запах | Без запаха | ||
| Плотность |
| ||
| Температура плавления | (Разлагается на карбонат натрия начиная с 50 ° C[1][6]) | ||
| Растворимость | 0,02 мас.% Ацетона, 2,13 мас.% Метанола при 22 ° C.[4] не растворим в этиловый спирт | ||
| журнал п | −0.82 | ||
| Кислотность (пKа) | |||
| nα = 1,377 nβ = 1,501 nγ = 1,583 | |||
| Структура | |||
| Моноклиника | |||
| Термохимия | |||
Теплоемкость (C) | 87,6 Дж / моль К[7] | ||
Стандартный моляр энтропия (S | 101,7 Дж / моль К[7] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -950,8 кДж / моль[7] | ||
Свободная энергия Гиббса (Δжг˚) | -851,0 кДж / моль[7] | ||
| Фармакология | |||
| B05CB04 (КТО) B05XA02 (КТО), QG04BQ01 (КТО) | |||
| Внутривенно, перорально | |||
| Опасности | |||
| Основной опасности | Вызывает серьезное раздражение глаз | ||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 4220 мг / кг (крыса, перорально)[8] | ||
| Родственные соединения | |||
Другой анионы | Карбонат натрия | ||
Другой катионы | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||

Бикарбонат натрия (Название ИЮПАК: гидрокарбонат натрия), широко известный как пищевая сода или бикарбонат соды, это химическое соединение с формулой NaHCO3. Это поваренная соль состоит из натрий катион (Na+ ) и бикарбонат анион (HCO3− ). Бикарбонат натрия - белое твердое вещество, которое кристаллический, но часто выглядит как мелкий порошок. Имеет слегка соленый, щелочной вкус напоминающий стиральную соду (карбонат натрия ). Природная минеральная форма нахколит. Это компонент минерала Натрон и растворяется во многих минеральных источниках. [9]
Номенклатура
Поскольку соль известна давно и широко используется, она имеет много родственных названий, таких как пищевая сода, хлебная сода, кулинарная сода, и бикарбонат соды. Период, термин пищевая сода чаще встречается в США, тогда как бикарбонат соды чаще встречается в Австралии и Великобритании.[10] В разговорной речи названия бикарбонат натрия и бикарбонат соды часто сокращаются; распространены такие формы, как бикарбонат натрия, бикарбонат натрия, бикарбонат и бикарбонат.[нужна цитата ]
Слово Saleratus, от латинский Sal æratus (что означает «газированная соль»), широко использовалась в 19 век как для бикарбоната натрия, так и для бикарбонат калия.[11]
Он известен как один из Номер E пищевые добавки E500.[нужна цитата ]
Префикс би в бикарбонат исходит из устаревшей системы именования и основан на наблюдении, что в два раза больше карбонат (CO3) на натрий в бикарбонате натрия (NaHCO3) как есть в карбонат натрия (Na2CO3). Современные химические формулы этих соединений выражают их точный химический состав (который был неизвестен, когда названия карбонат натрия и бикарбонат натрия были придуманы) как гидрокарбонат натрия (NaHCO3) и карбонат натрия (Na2CO3). Эти названия однозначны, так как натрий всегда имеет +1 степень окисления и карбонат в степени окисления -2.[нужна цитата ]
Использует
Готовка
Закваска
В кулинарии пищевая сода в основном используется в выпечка как разрыхлитель. Когда он вступает в реакцию с кислотой, выделяется углекислый газ, который вызывает расширение жидкого теста и формирование характерной текстуры и зерна в тортах. быстрый хлеб, содовый хлеб, а также другие печеные и жареные продукты. Кислотно-щелочная реакция в общих чертах может быть представлена следующим образом:[12]
- NaHCO3 + H+ → Na+ + CO2 + H2О
Кислотные материалы, которые вызывают эту реакцию, включают: гидрофосфаты, соус тартар, лимонный сок, йогурт, пахта, какао, и уксус. Пищевая сода может использоваться вместе с закваска, который является кислым, что делает продукт более легким и менее кислым.[13]
Тепло само по себе может привести к тому, что бикарбонат натрия станет разрыхлителем при выпечке из-за термическое разложение, выделяя диоксид углерода при температуре выше 80 ° C (180 ° F), а именно:[14]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
При использовании таким способом самостоятельно, без присутствия кислотного компонента (будь то жидкое тесто или использование разрыхлителя, содержащего кислоту), только половина доступного CO2 выпущен (один СО2 молекула образуется на каждые два эквивалента NaHCO3). Кроме того, в отсутствие кислоты термическое разложение бикарбоната натрия также дает карбонат натрия, который является сильнощелочным и придает выпечке горький, «мыльный» вкус и желтый цвет. Поскольку реакция протекает медленно при комнатной температуре, смеси (тесто для пирогов и т. Д.) Можно выдерживать, не поднимаясь, пока они не нагреются в духовке.[нужна цитата ]
При добавлении кислоты, щелочных ингредиентов, таких как цельное молоко или Обработанный по-голландски какао часто добавляют в выпечку, чтобы избежать кислого привкуса.[15]
Порошок для выпечки
Порошок для выпечки, также продаваемый для приготовления пищи, содержит около 30% бикарбоната и различных кислотных ингредиентов, которые активируются при добавлении воды, без необходимости добавления кислот в среду для приготовления пищи.[16][17][18] Многие формы разрыхлителя содержат бикарбонат натрия в сочетании с кислый фосфат кальция, фосфат натрия-алюминия, или соус тартар.[19] Пищевая сода щелочная; кислота, используемая в разрыхлителе, позволяет избежать металлического привкуса, когда химические изменения во время выпечки создают карбонат натрия.[нужна цитата ]
Другой
Бикарбонат натрия иногда использовали при приготовлении зеленых овощей,[когда? ] поскольку он придает им ярко-зеленый цвет - который был описан как искусственно выглядящий - из-за его реакции с хлорофилл производить хлорофиллин.[20] Однако это имеет тенденцию влиять на вкус, текстуру и содержание питательных веществ и больше не встречается.[21][нужен лучший источник ]
Пищевая сода используется для смягчения импульсы (горох, фасоль) до и во время приготовления, как в традиционном британском пюре из гороха рецепт замачивания гороха. Основным действием бикарбоната натрия является изменение pH раствора для замачивания и воды для приготовления пищи; это смягчает твердую внешнюю оболочку, сокращает время приготовления и может изменить процентное содержание питательных веществ в блюде, его вкус и консистенцию.[нужна цитата ]
Пищевая сода может вступать в реакцию с кислотами в продуктах питания, в том числе с витамин C (L-аскорбиновая кислота).[нужна цитата ]
Он используется в азиатской и латиноамериканской кухне для смягчать мясо. Он также используется в панировка, например, для жареных продуктов, чтобы сделать их более хрустящими и пропустить пар, чтобы панировка не сдувалась во время приготовления.[нужна цитата ]
Фунгициды и борьба с вредителями
Бикарбонат натрия может быть эффективным способом борьбы с ростом грибков,[22] и в США зарегистрирован Агентство по охране окружающей среды как биопестицид.[23]
Повышение щелочности / pH
Бикарбонат натрия можно добавлять в бассейны, спа и садовые пруды для увеличения общего количества щелочность (увеличьте pH).[24]
Пиротехника
Бикарбонат натрия - один из основных компонентов обычного фейерверк "черная змея". Эффект вызван термическим разложением, в результате которого образуется углекислый газ с длительным змея -подобный зола как продукт сгорания другого основного компонента, сахароза.[нужна цитата ] Бикарбонат натрия также используется для замедления реакций горения за счет выделения CO.2 и H2O при нагревании, оба из которых являются антипиренами.
Мягкое дезинфицирующее средство
Имеет слабый дезинфицирующее средство свойства,[25][26] и это может быть эффективным фунгицид против некоторых организмов.[27] Поскольку пищевая сода впитывает затхлый запах, она стала надежным средством подержанная книга продавцы, делая книги менее неприятными.[28]
Огнетушитель
Бикарбонат натрия можно использовать для тушения небольших пожаров, связанных с жиром или электрическим током, если его бросить на огонь, поскольку при нагревании бикарбоната натрия выделяется диоксид углерода.[29] Однако его не следует применять при пожарах в фритюрницы; внезапный выброс газа может вызвать разбрызгивание смазки.[29] Бикарбонат натрия используется в Британской Колумбии. сухой химический огнетушители как альтернатива более агрессивным диаммонийфосфат в огнетушителях ABC. Щелочная природа бикарбоната натрия делает его единственным сухим химическим агентом, кроме Фиолетовый-К, который использовался в крупномасштабных системах пожаротушения, установленных на коммерческих кухнях. Поскольку он может действовать как щелочь, средство имеет мягкий омыление действует на горячую смазку, образуя удушающую мыльную пену.[нужна цитата ]
Нейтрализация кислот
Бикарбонат натрия самопроизвольно реагирует с кислотами с выделением CO.2 газ как продукт реакции. Он обычно используется для нейтрализации нежелательных кислотных растворов или разливов кислоты в химических лабораториях.[30] Не рекомендуется использовать бикарбонат натрия для нейтрализации основания.[31] хотя это амфотерный, реагируя как с кислотами, так и с основаниями.[нужна цитата ]
Использование в медицине и здоровье
Бикарбонат натрия, смешанный с водой, может использоваться как антацид лечить изжога и изжога.[32] Его реакция с желудочной кислоты производит соль, воду и углекислый газ:
- NaHCO3 + HCl → NaCl + H2O + CO2(г)
Смесь бикарбоната натрия и полиэтиленгликоль такие как PegLyte,[33] растворенный в воде и принимаемый внутрь, является эффективным промывание желудочно-кишечного тракта подготовка и слабительное перед операцией на желудочно-кишечном тракте, гастроскопия, так далее.[нужна цитата ]
Бикарбонат натрия внутривенно в водном растворе иногда используется при ацидоз, или когда в крови недостаточно ионов натрия или бикарбоната.[34] В случае респираторного ацидоза введенный ион бикарбоната сдвигает буфер углекислоты / бикарбоната плазмы влево и, таким образом, повышает pH. По этой причине бикарбонат натрия используется под медицинским наблюдением. сердечно-легочная реанимация. Инфузия бикарбоната показана только в том случае, если pH крови заметно низок (<7,1–7,0).[35]
HCO3− используется для лечения гиперкалиемия, так как он будет вести K+ обратно в клетки в периоды ацидоза.[36] Поскольку бикарбонат натрия может вызвать алкалоз, его иногда используют для лечения передозировки аспирина. Аспирин требует кислой среды для правильного всасывания, а щелочная среда уменьшает абсорбцию аспирина в случае передозировки.[37] Бикарбонат натрия также использовался при лечении передозировка трициклическим антидепрессантом.[38] Его также можно наносить местно в виде пасты, состоящей из трех частей пищевой соды и одной части воды, чтобы облегчить некоторые виды укусов насекомых (а также сопутствующего отека).[39]
Некоторые альтернативные практики, такие как Туллио Симончини продвигали пищевую соду как рак лекарство, против которого предостерегает Американское онкологическое общество из-за его недоказанной эффективности и потенциальной опасности при использовании.[40] Эдзард Эрнст назвал продвижение бикарбоната натрия в качестве лекарства от рака «одной из самых отвратительных альтернативных афер, которые я видел в течение долгого времени».[41]
Бикарбонат натрия можно добавлять в местные анестетики, чтобы ускорить наступление их эффекта и сделать инъекцию менее болезненной.[42] Это также компонент Решение Моффетта, используется в носовой хирургия.[нужна цитата ]
Было высказано предположение, что кислая диета ослабляет кости.[43] Один систематический мета-анализ исследования не показывает такого эффекта.[44] Другой также обнаружил, что нет никаких доказательств того, что щелочные диеты улучшают здоровье костей, но предполагает, что щелочные диеты «могут иметь некоторую ценность» по другим причинам.[45]
Антацид (например, пищевая сода) были приготовлены и использованы протестующими для смягчения последствий воздействия слезоточивый газ во время протестов.[46][неудачная проверка ][47]
Как и в выпечке, бикарбонат натрия используется вместе с слабой кислотой, такой как Винная кислота в качестве наполнителя в шипучих таблетках: когда такую таблетку бросают в стакан с водой, карбонат покидает реакционную среду в виде газообразного диоксида углерода (HCO3− + H+ → H2O + CO2↑ или, точнее, HCO3− + H3О+ → 2 H2O + CO2↑), оставляя лекарство растворенным в воде вместе с образовавшейся солью (в этом примере тартрат натрия ).[48]
Личная гигиена
Зубная паста содержащие бикарбонат натрия, в нескольких исследованиях показали, что они лучше отбеливают[49][50][51] и эффект удаления налета[52][53] чем зубные пасты без него.[нужна цитата ]
Бикарбонат натрия также используется в качестве ингредиента в некоторых жидкостях для полоскания рта. Обладает противокариесными и абразивными свойствами.[54] Он действует как механическое очищающее средство для зубов и десен, нейтрализует выработку кислоты во рту, а также действует как антисептик чтобы предотвратить инфекции.[55][56] Бикарбонат натрия в сочетании с другими ингредиентами можно использовать для приготовления сухого или влажного дезодорант.[57][58] Бикарбонат натрия можно использовать в качестве буферного агента в сочетании с поваренной солью при создании раствора для орошение носа.[59]
Он используется в гигиене глаз для лечения блефарит. Это делается путем добавления чайной ложки бикарбоната натрия в прохладную воду, которая была недавно кипячена, с последующим нежным протиранием основы ресниц ватным тампоном, смоченным в растворе.[60]
Ветеринарное использование
Бикарбонат натрия используется в качестве добавки к корму для крупного рогатого скота, в частности, как буферный агент для рубец.[61]
В спорте
Хотя небольшие дозы бикарбоната натрия использовались в качестве добавки для спортсменов в соревнованиях, основанных на скорости, таких как бег на средние дистанции, доказательств его пользы недостаточно, а передозировка - это серьезная проблема. риск для здоровья потому что бикарбонат натрия может вызвать раздражение желудочно-кишечного тракта.[62]
Чистящее средство
Бикарбонат натрия используется в процессе удаления краски и коррозии, называемого губительный. В качестве абразивоструйной среды используется бикарбонат натрия для удаления поверхностных загрязнений с более мягких и менее эластичных субстраты например, алюминий, медь или дерево, которые могут быть повреждены абразивным материалом из кварцевого песка.[63]
Производитель рекомендует пасту из пищевой соды с минимальным количеством воды в качестве мягкого чистящего порошка.[29] и полезен при удалении поверхностной ржавчины, поскольку ржавчина образует водорастворимое соединение в концентрированном щелочном растворе;[64] следует использовать холодную воду, так как растворы горячей воды могут вызвать коррозию стали. [65] Бикарбонат натрия разрушает тонкий защитный оксидный слой, который образуется на алюминии, что делает его непригодным для очистки этого металла.[66] Раствор в теплой воде удалит тускнеть из серебра, когда серебро соприкасается с куском алюминиевая фольга.[66][67] Пищевая сода обычно добавляется в стиральные машины в качестве замены смягчителя воды и для удаления запахов с одежды. Он также эффективен для удаления тяжелых пятен от чая и кофе с чашек при разбавлении теплой водой.
В течение Манхэттенский проект При разработке ядерной бомбы в начале 1940-х химическая токсичность урана была проблемой. Было обнаружено, что оксиды урана очень хорошо прилипают к хлопковой ткани и не смываются мылом или стиральным порошком. Однако уран вымывается 2% -ным раствором бикарбоната натрия. Одежда может быть загрязнена токсичной пылью обедненный уран (DU), который очень плотный, поэтому используется для противовесов в гражданском контексте и в бронебойных снарядах. DU не удаляется обычной стиркой; промывание с помощью примерно 170 г пищевой соды в 2 галлонах (7,5 л) воды поможет вымыть ее.[68]
Контроль запаха
Часто утверждают, что пищевая сода является эффективным средством для удаления запаха,[69][нужен лучший источник ] и часто рекомендуется хранить открытую коробку в холодильнике для поглощения запаха.[70] Эту идею продвигал ведущий американский бренд пищевой соды, Рука и молот в рекламной кампании, начатой в 1972 году.[71] Хотя эта кампания считается классикой маркетинг, что за год привело к тому, что более половины американских холодильников содержали ящик пищевой соды,[72][73] мало доказательств того, что он действительно эффективен в этом приложении.[74][75]
Химия
Бикарбонат натрия - это амфотерный соединение. Водные растворы мягко щелочной из-за образования угольная кислота и гидроксид ион:
- HCO−
3 + H2O → ЧАС
2CO
3 + ОН−
Бикарбонат натрия можно использовать в качестве промывки для удаления любых кислотных примесей из «сырой» жидкости, что позволяет получить более чистый образец. Реакция бикарбоната натрия и кислота производит соль и угольную кислоту, которая легко разлагается на диоксид углерода и воду:
- NaHCO3 + HCl → NaCl + H2CO3
- ЧАС2CO3 → H2O + CO2(г)
Бикарбонат натрия реагирует с уксусная кислота (нашел в уксус ), производя ацетат натрия, вода и углекислый газ:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(г)
Бикарбонат натрия реагирует с базы такие как гидроксид натрия с образованием карбонатов:
- NaHCO3 + NaOH → Na2CO3 + H2О
Термическое разложение
При температуре от 80 до 100 ° C (176–212 ° F) бикарбонат натрия постепенно разлагается на карбонат натрия, воду и диоксид углерода. Преобразование происходит быстрее при 200 ° C (392 ° F):[76]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Большинство бикарбонатов подвергаются этому реакция дегидратации. Дальнейшее нагревание превращает карбонат в окись (выше 850 ° C / 1560 ° F):[76]
- Na2CO3 → Na2O + CO2
Эти преобразования относятся к использованию NaHCO3 в качестве огнетушащего вещества («порошок BC») в виде сухого порошка. огнетушители.[нужна цитата ]
История
В 1791 г. французский химик Николя Леблан произвел карбонат натрия, также известный как кальцинированной соды. В 1846 году два американских пекаря, Джон Дуайт и Остин Черч, основал первый в США завод по производству пищевой соды из карбоната натрия и углекислый газ.[77]
Салератус, бикарбонат калия или натрия, упоминается в романе Отважные капитаны от Редьярд Киплинг как широко использовавшийся в 1800-х годах в коммерческом рыболовстве, чтобы предотвратить порчу свежевыловленной рыбы.[78]
В 1919 году сенатор США заявил, что бикарбонат соды может вылечить испанский грипп ... В разгар дебатов 26 января 1919 года сенатор Оверман прервал дискуссию, объявив об открытии лекарства. «Я хочу сказать для тех, кто проводит это расследование, - сообщил он, - что мне сказал судья вышестоящего суда в горной стране Северной Каролины, что они открыли лекарство от этой болезни». Предполагаемое лекарство предполагало критику современной науки и признание простой мудрости простых людей. «Они говорят, что обычная пищевая сода вылечит болезнь, - продолжил он, - что они вылечили ее с ее помощью, что у них вообще нет смертей; они используют обычную пищевую соду, которая лечит болезнь». - Американская пандемия: Затерянные миры эпидемии гриппа 1918 г., Oxford University Press, 15 марта 2012 г., стр. 178
Производство
Бикарбонат натрия промышленно производится из карбонат натрия:[79]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
Производится в масштабе около 100 000 тонн / год (по состоянию на 2001 год).[сомнительный ] [80] с мировой производственной мощностью 2,4 миллиона тонн в год (по состоянию на 2002 год).[81] Коммерческое количество пищевой соды также производится аналогичным методом: кальцинированная сода добывается в виде руды. трона, растворяется в воде и обрабатывается диоксидом углерода. Бикарбонат натрия выпадает в осадок из этого раствора.[нужна цитата ]
Взяв во внимание Сольвеевский процесс, бикарбонат натрия является промежуточным продуктом реакции хлорид натрия, аммиак, и углекислый газ. Однако продукт имеет низкую чистоту (75%).[нужна цитата ]
Хотя не имеет практического значения, NaHCO3 может быть получен реакцией диоксида углерода с водный раствор гидроксида натрия:[нужна цитата ]
- CO2 + NaOH → NaHCO3
Добыча
Встречающиеся в природе месторождения нахколита (NaHCO3) находятся в эоцен - возраст (55,8–33,9 млн лет назад) Формация Грин Ривер, Piceance Basin в Колорадо. Нахколит отлагался пластами в периоды сильного испарения в бассейне. В промышленных масштабах он добывается с использованием обычных методов подземной добычи, таких как буровая, барабанная и длинная забоя, аналогично добыче угля.[нужна цитата ]
Ограниченные количества продукта дополнительно получают путем добычи раствора, прокачки нагретой воды через ранее добытые пласты нахколита и восстановления растворенного нахколита над землей посредством процесса кристаллизации с естественным охлаждением. В настоящее время только компания Genesis Alkali (ранее Tronox, ранее FMC) в бассейне реки Грин-Ривер, штат Вайоминг, успешно добыла этот продукт на коммерческой основе.[нужна цитата ][82]
В популярной культуре
Фильм
Бикарбонат натрия, как «бикарбонат соды», был частым источником изюминки для Граучо Маркс в Братья маркс фильмы. В Утиный суп, Маркс играет лидера нации в состоянии войны. В одной из сцен он получает сообщение с поля боя, что его генерал сообщает о газовой атаке, и Граучо говорит своему помощнику: «Скажите ему, чтобы он выпил чайную ложку соды и полстакана воды».[83] В Ночь в опере, Персонаж Граучо обращается к публике на премьере оперы, говоря о ведущем теноре: «Синьор Ласспарри происходит из очень известной семьи. Его мать была известной бас-певицей. Его отец был первым человеком, который начал начинять спагетти бикарбонатом натрия. соды, вызывая и вылечивая одновременно несварение желудка ".[84]
Смотрите также
использованная литература
- ^ а б Хейнс, стр. 4,90
- ^ а б c Хейнс, стр. 5,194
- ^ а б c "Бикарбонат натрия" (PDF). Программа ООН по окружающей среде. Архивировано из оригинал (PDF) на 2011-05-16.
- ^ Эллингбоу Дж. Л., Руннелс Дж. Х. (1966). «Растворимость карбоната натрия и бикарбоната натрия в смесях ацетон-вода и метанол-вода». J. Chem. Англ. Данные. 11 (3): 323–324. Дои:10.1021 / je60030a009.
- ^ а б Хейнс, стр. 7,23
- ^ Паскуали I, Беттини Р., Джордано Ф. (2007). «Температурное поведение композиций диклофенака, диклофенака натрия и бикарбоната натрия». Журнал термического анализа и калориметрии. 90 (3): 903–907. Дои:10.1007 / s10973-006-8182-1. S2CID 95695262.
- ^ а б c d Хейнс, стр. 5,19
- ^ Чемберс М. «Бикарбонат натрия [USP: JAN]». ChemIDplus. Национальная медицинская библиотека США.
- ^ https://www.sciencedirect.com/topics/engineering/mineral-springs
- ^ "В чем разница между бикарбонатом соды, пищевой содой и разрыхлителем?". Такова жизнь! Тихоокеанская сеть.
- ^ «Определение SALERATUS». www.merriam-webster.com. Получено 2020-12-06.
- ^ Бент А.Дж., изд. (1997). Технология изготовления тортов (6 изд.). Springer. п. 102. ISBN 9780751403497. Получено 2009-08-12.
- ^ Cascio J. "Закваска" (PDF). Университет Аляски в Фэрбенксе Совместная служба поддержки. FNH-00061. Архивировано из оригинал (PDF) 27 марта 2016 г.. Получено 2 мая 2017.
- ^ «Практическое применение пищевой соды на кухне». About.com Food. Получено 2017-01-22.
Короче говоря, использование пищевой соды их много: он дезодорирует, нейтрализует и очищает все без токсичного беспорядка большинства коммерческих продуктов.
- ^ «Выпечка 101: разница между пищевой содой и разрыхлителем». Радость пекаря. Получено 2015-08-04.
- ^ Черногорский JH, Хукер Р. «Химия выпечки» (PDF). Новозеландский институт химии. Архивировано из оригинал (PDF) на 2016-11-27. Получено 2017-01-22.
- ^ «Пищевая сода и разрыхлитель». FineCooking.com. Получено 2017-01-22.
- ^ "Часто задаваемые вопросы о пищевой соде". Arm & Hammer, мультибрендовые. Компания Черч и Дуайт. В чем разница пищевая сода и разрыхлитель ?. Архивировано из оригинал 27 июня 2017 г.. Получено 20 июля 2017.
- ^ «Глоссарий ингредиенты». Cooking.com. Архивировано из оригинал 15 сентября 2008 г.
- ^ Шрилакшми Б. (2003). Наука о еде. New Age International. п. 188. ISBN 978-81-224-1481-3.
- ^ Сукхадвала С. «Бикарбонат соды рецепты». BBC Food. Получено 20 июля 2017.
- ^ Бикарбонат калия (073508) и бикарбонат натрия (073505) Информационный бюллетень. Агентство по охране окружающей среды США. Обновлено 17 февраля 2011 г. Проверено 25 ноября 2011 г.
- ^ Зарегистрированный биофунгицид 29.04.02 Агентство по охране окружающей среды США. Обновлено 29 марта 2002 г. Проверено 25 ноября 2011 г.
- ^ "Руководство для владельцев бассейнов от Arm & Hammer Baking soda" (PDF). Armandhammer.com. Архивировано из оригинал (PDF) 7 сентября 2012 г.. Получено 30 июля 2009.
- ^ Малик Ю.С., Гоял С.М. (май 2006 г.). «Вирулицидная эффективность бикарбоната натрия на поверхности контакта с пищей против калицивируса кошек, суррогата норовируса». Международный журнал пищевой микробиологии. 109 (1–2): 160–3. Дои:10.1016 / j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (январь 2000 г.). «Антимикробная активность домашних дезинфицирующих средств и натуральных продуктов против потенциальных патогенов человека». Инфекционный контроль и больничная эпидемиология. 21 (1): 33–8. Дои:10.1086/501694. PMID 10656352.
- ^ Замани М., Шарифи Теграни А., Али Абади А.А. (2007). «Оценка противогрибковой активности карбонатных и бикарбонатных солей отдельно или в сочетании с агентами биологического контроля в борьбе с зеленой плесенью цитрусовых». Коммуникации в сельскохозяйственных и прикладных биологических науках. 72 (4): 773–7. PMID 18396809.
- ^ Альтман Г (22 мая 2006 г.). «Ремонт книг для мыслителей: как удалить запахи из книг». Книжный мыслитель (69).
- ^ а б c "Пищевая сода Arm & Hammer - Основы - Магия пищевой соды Arm & Hammer". armandhammer.com. Архивировано из оригинал 31 августа 2009 г.. Получено 30 июля 2009.
- ^ «Подготовка к чрезвычайным ситуациям от неконтролируемых опасностей». Американское химическое общество.
- ^ Хурум Д. «Лабораторная безопасность» (PDF). Гражданское строительство. Северо-Западный университет.
- ^ "Бикарбонат натрия". Джексон Сигельбаум Гастроэнтерология. 1998. Архивировано с оригинал на 2016-10-05. Получено 2016-10-04.
- ^ «ПегЛайт». Пендо Фама.
- ^ «Внутривенное вливание бикарбоната натрия» (PDF). Информация о потребительской медицине. Лучший канал здоровья. 2004-07-13. Архивировано из оригинал (PDF) на 22 августа 2008 г.
- ^ «Респираторный ацидоз: лечение и лекарства». эмедицина. 26 марта 2020. Цитировать журнал требует
| журнал =(Помогите) - ^ Дарт RC (2004). Медицинская токсикология. Липпинкотт Уильямс и Уилкинс. С. 910–. ISBN 978-0-7817-2845-4.
- ^ Тканевые подгузники. Дональд С. Купер, доктор философии С. 46–.
- ^ [старая информация ]Кнудсен К., Абрахамссон Дж. (Апрель 1997 г.). «Адреналин и бикарбонат натрия независимо и аддитивно увеличивают выживаемость при экспериментальном отравлении амитриптилином». Реанимационная медицина. 25 (4): 669–74. Дои:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Укусы и укусы насекомых: первая помощь». Клиника Майо. 2008-01-15.
- ^ "Бикарбонат натрия". Американское онкологическое общество. 28 ноября 2008. Архивировано 19 февраля 2013 года.. Получено 19 февраля 2013.CS1 maint: неподходящий URL (ссылка на сайт)
- ^ Эрнст Э (3 февраля 2017 г.). «Это должно быть самая отвратительная афера с раком, которую я когда-либо видел».
- ^ Эдгкомб Х., Хокинг Дж., Рэдклифф Дж. (2005). "Anesthesia UK: Местная анестезиологическая фармакология". Больница Джона Рэдклиффа, Оксфорд, Великобритания.
- ^ Фокс Д (15 декабря 2001 г.). "Твердый сыр". Новый ученый. Получено 20 июля 2017.
- ^ Танис Р. Фентон, Сюзанна С. Таф, Эндрю В. Лайон, Миша Элиашив, Дэвид А. Хэнли, «Причинно-следственная оценка кислотной нагрузки с пищей и болезней костей: систематический обзор и метаанализ с применением эпидемиологических критериев Хилла для определения причинной связи», Журнал питания 10: 41 (апрель 2011 г.), Дои:10.1186/1475-2891-10-41, полный текст
- ^ Джерри К. Швальфенберг, Щелочная диета: есть ли доказательства того, что щелочная диета приносит пользу здоровью?, Журнал окружающей среды и общественного здоровья 2012:727630, Дои:10.1155/2012/727630
- ^ Фергюсон Д. (2011-09-28). "'Раствор маалокса и воды, используемый протестующими в качестве средства против слезоточивого газа ". Сырая история.
- ^ «Медицинская справка из Праги 2000». Архивировано из оригинал 2014-10-18.
- ^ Shirsand, S. B .; Суреш, Сарасиджа; Jodhana, L. S .; Свами, П. В. (2010). «Разработка рецептуры и оптимизация быстро распадающихся таблеток лоразепама шипучим методом». Индийский журнал фармацевтических наук. 72 (4): 431–436. Дои:10.4103 / 0250-474X.73911. ISSN 0250-474X. ЧВК 3013557. PMID 21218052. Получено 6 декабря 2020.
- ^ Клебер CJ, Мур MH, Нельсон BJ (1998). «Лабораторная оценка отбеливания зубов средствами для чистки зубов бикарбонатом натрия». Журнал клинической стоматологии. 9 (3): 72–5. PMID 10518866.
- ^ Koertge TE, Brooks CN, Sarbin AG, Powers D, Gunsolley JC (1998). «Продольное сравнение отбеливания зубов в результате использования средства для ухода за зубами». Журнал клинической стоматологии. 9 (3): 67–71. PMID 10518865.
- ^ Янкелл С.Л., Эмлинг Р.К., Петроне М.Э., Рустоги К., Вольпе А.Р., ДеВизио В. и др. (1999). «Шестинедельное клиническое исследование эффективности четырех имеющихся в продаже средств для чистки зубов для удаления внешних пятен на зубах». Журнал клинической стоматологии. 10 (3 Спец. №): 115–8. PMID 10825858.
- ^ Манкоди С, Берковиц Х, Дурбин К., Нельсон Б. (1998). «Оценка влияния чистки зубов на удаление зубного налета». Журнал клинической стоматологии. 9 (3): 57–60. PMID 10518862.
- ^ Патт М.С., Миллеман К.Р., Гассеми А., Форверк Л.М., Хупер В.Дж., Сопаркар П.М. и др. (2008). «Повышение эффективности удаления зубного налета при чистке зубов зубными средствами с пищевой содой: результаты пяти клинических исследований». Журнал клинической стоматологии. 19 (4): 111–9. PMID 19278079.
- ^ Сторехаген С., Осе Н., Мидха С. «Ингредиенты средств для чистки зубов и жидкостей для полоскания рта и их применение» (PDF). Институт стоматологической клиники. Universitetet i Oslo.
- ^ США 4132770A, Barth J, "Oral Product", выпущенный в 1979 г.
- ^ Икбал К., Асмат М., Джавед С., Муштак А., Мохсин Ф., Ханиф С. и др. (Июль 2011 г.). «Роль различных ингредиентов зубных паст и жидкостей для полоскания рта в здоровье полости рта» (PDF). JPDA (Журнал Пакистанской стоматологической ассоциации). 20 (3): 163–70.
- ^ Лэмб Дж. Х. (1946). «Бикарбонат натрия: отличный дезодорант». Журнал следственной дерматологии. 7 (3): 131–133. Дои:10.1038 / jid.1946.13.
- ^ «Бикарбонатная сода: натуральный дезодорант для тела». stableecho.com.
- ^ Мецон РБ (2005). Руководство Гарвардской медицинской школы по исцелению пороков. Макгроу Хилл. п. 68. ISBN 9780071444699.
- ^ «Блефарит. Лечение и причины. Воспаление век | Пациент». Терпеливый. Получено 2016-05-31.
- ^ Патон LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Использование бикарбоната натрия, предлагаемого по выбору или добавленного в рацион, для снижения риска рубцевого ацидоза у крупного рогатого скота». Канадский журнал зоотехники. 86 (3): 429–437. Дои:10.4141 / A06-014.
- ^ Хаджич, Миралем; Экштейн, Макс Леннарт; Шугардт, Моник (2019-06-01). «Влияние бикарбоната натрия на результативность в зависимости от продолжительности упражнений у спортсменов: систематический обзор». Журнал спортивной науки и медицины. 18 (2): 271–281. ISSN 1303-2968. ЧВК 6544001. PMID 31191097.
- ^ "Удалите грязь с помощью пищевой соды". Популярная механика. 5 августа 2013 г.. Получено 2 августа 2020.
- ^ Housecroft CE, Sharpe AG (2008). "Глава 22: d-блочная химия металлов: элементы первого ряда ». Неорганическая химия, 3-е издание. Пирсон. п. 716. ISBN 978-0-13-175553-6.
- ^ "Science Lab.com". MSDS - карбонат натрия. sciencelab.com. Архивировано из оригинал 5 сентября 2012 г.
- ^ а б «Методы отделки в металлоконструкциях». Художественный музей Филадельфии.
- ^ "Положи на него блеск". scifun.chem.wisc.edu. Архивировано из оригинал 31 июля 2012 г.. Получено 2011-03-06.
- ^ Orcutt JA. «Обедненный уран и здоровье: факты и полезные предложения». Фармакология и токсикология соединений урана. Макгроу-Хилл. Архивировано из оригинал 17 января 2013 г.. Получено 21 марта 2012.
- ^ Раймонд Дж (10 июня 2016 г.). «Свечи, продукты и хитрости для устранения запаха на кухне». cravedujour.com.
- ^ Вики Лански, Марта Кэмпбелл, Пищевая сода: более 500 невероятных, забавных и экономных способов применения, о которых вы, вероятно, никогда не задумывались, 2009, ISBN 1931863733, п. 28
- ^ «Надежное решение более 170 лет. Чисто и просто», Arm & Hammer "О нас" страница
- ^ Кейт Сойер, Групповой гений: творческая сила сотрудничества, 2017, ISBN 0465093582, "держать еду свежей"
- ^ Клейтон М. Кристенсен, Скотт Кук, Тэдди Холл, Маркетинговая халатность: причина и лекарство, Harvard Business Review, Декабрь 2005 г., [1]
- ^ «Миф № 100: открытая коробка с пищевой содой в холодильнике поглощает запахи», Брюс Вайнштейн, Марк Скарбро, Омары кричат, когда вы их варите; И 100 других мифов о еде и кулинарии, 2011, ISBN 1439195382, п. 312
- ^ «Пищевая сода как поглотитель запаха», Иллюстрированные повара, [2]
- ^ а б «Разложение карбонатов». Общая химия в Интернете. Архивировано из оригинал на 1999-10-02. Получено 2010-03-16.
- ^ "История компании". Church & Dwight Co. Архивировано из оригинал 16 октября 2011 г.
- ^ Киплинг Р. (1897). Отважные капитаны. п. 25.
- ^ Тим С (2000). «Карбонаты натрия». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a24_299. ISBN 3527306730.
- ^ Холлеман А.Ф., Виберг Э. (2001). Неорганическая химия. Сан-Диего: Academic Press. ISBN 0-12-352651-5.
- ^ Стр. 45, раздел 3.6.2.1 из «Справочный документ по передовым методам обработки (BREF) для кальцинированной соды», отчет, подготовленный Европейская ассоциация производителей кальцинированной соды, Март 2004 г. Архивировано на WebCite с этот исходный URL на 2008-03-01.
- ^ Бестген, Майкл (2019). «Разработка раствора с использованием методов подземного бурения». Патент США 10280726: US 20180038213 A1.
- ^ "Утиный суп (1933)". IMDb. Получено 4 августа 2015.
- ^ «Ночь в опере (1935)». IMDb. Получено 4 августа 2015.
Список используемой литературы
- Хейнс WM, изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press. ISBN 978-1439855119.



