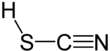Тиоциановая кислота - Википедия - Thiocyanic acid
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Нитридосульфанидокарбон[3] | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.006.672 | ||
| Номер ЕС |
| ||
| 25178 | |||
| КЕГГ | |||
| MeSH | тиоциановая + кислота | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CЧАСNS | |||
| Молярная масса | 59.09 г · моль−1 | ||
| Внешность | бесцветная маслянистая жидкость | ||
| Запах | острый | ||
| Плотность | 2,04 г / см3 | ||
| Температура плавления | 5 ° С (41 ° F, 278 К) | ||
| Смешиваемый | |||
| Растворимость | растворим в этиловый спирт, диэтиловый эфир | ||
| бревно п | 0.429 | ||
| Кислотность (пKа) | 0.926 | ||
| Основность (пKб) | 13.071 | ||
| Опасности | |||
Классификация ЕС (DSD) (устарело) | |||
| R-фразы (устарело) | R20 / 21/22, R32, R52 / 53 | ||
| S-фразы (устарело) | (S2), S13 | ||
| Родственные соединения | |||
Родственные алканнитрилы | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тиоциановая кислота это химическое соединение с формулой HSCN, которая существует как таутомер с изотиоциановой кислотой (HNCS).[4] Изоформа имеет тенденцию преобладать, при этом материал, содержащий около 95% изотиоциановой кислоты в паровой фазе.[5]
 Таутомерия между тиоциановой кислотой (слева) и изотиоциановой кислотой (справа)
Таутомерия между тиоциановой кислотой (слева) и изотиоциановой кислотой (справа)
Это слабая кислота, граничащая с сильной, с pKа 1,1 при 20 ° C и экстраполировано на нулевую ионную силу.[6]
По прогнозам, HSCN будет иметь тройная связь между углеродом и азотом. Он наблюдался спектроскопически, но не был выделен как чистое вещество.[7]
В соли и сложные эфиры тиоциановой кислоты известны как тиоцианаты. Соли состоят из тиоцианат-иона (−SCN) и подходящий катион металла (например, тиоцианат калия, KSCN). Сложные эфиры тиоциановой кислоты имеют общую структуру R – SCN.
Изотиоциановая кислота, HNCS, представляет собой кислоту Льюиса, свободная энергия, энтальпия и энтропия которой изменяются при ее ассоциации 1: 1 с различными основаниями Льюиса в растворе четыреххлористого углерода при 25 ° C.[8] Акцепторные свойства HNCS обсуждаются в Модель ECW.
Рекомендации
- ^ Индекс Merck, 11-е издание, 9257.
- ^ Рихтер, Виктор фон; Шпильманн, Перси Э., пер. (1922). Органическая химия или химия соединений углерода. т. 1. Филадельфия, Пенсильвания, США: P. Blakiston's Son & Co., стр. 466.
- ^ «тиоциановая кислота (CHEBI: 29200)». Химические объекты, представляющие биологический интерес. США: Европейский институт биоинформатики. 18 октября 2009 г. Главная. Получено 5 июн 2012.
- ^ Холлеман, А. Ф .; Виберг, Э. (2001). Неорганическая химия. Сан-Диего: Academic Press. ISBN 0-12-352651-5.
- ^ Beard, C. I .; Дейли, Б. П. (1950). «Структура и дипольный момент изотиоциановой кислоты» (PDF). Журнал химической физики. 18 (11): 1437. Bibcode:1950ЖЧФ..18.1437Б. Дои:10.1063/1.1747507. HDL:1721.1/4934.
- ^ Martell, A.E .; Smith, R.M .; Мотелайтис, Р. Дж. (2001). База данных NIST 46. Гейтерсбург, доктор медицины: Национальный институт стандартов и технологий.
- ^ Wierzejewska, M .; Мильке, З. (2001). «Фотолиз изотиоциановой кислоты HNCS в низкотемпературных матрицах. Инфракрасное обнаружение изомеров HSCN и HSNC». Письма по химической физике. 349 (3–4): 227–234. Bibcode:2001CPL ... 349..227Вт. Дои:10.1016 / S0009-2614 (01) 01180-0.
- ^ . Баракат, Т. М .; Nelson, J .; Nelson, S.M .; Пуллин, А. Д. Э. (1969) «Спектры и водородные связи характеристик тиоциановой кислоты. Часть 4. - Ассоциация со слабыми акцепторами протонов ». Пер. Faraday Soc., 1969, 65, 41-51.