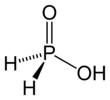
Гипофосфористая кислота - Hypophosphorous acid
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фосфиновая кислота | |||
| Другие имена Гидрокси (оксо) -λ5-фосфан Гидрокси-λ5-фосфанон | |||
| Идентификаторы | |||
| |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.026.001 | ||
| КЕГГ | |||
PubChem CID |
| ||
| UNII | |||
| Номер ООН | ООН 3264 | ||
| |||
| |||
| Свойства | |||
| ЧАС3PO2 | |||
| Молярная масса | 66,00 г / моль | ||
| Внешность | бесцветный, расплывающийся кристаллы или маслянистая жидкость | ||
| Плотность | 1,493 г / см3[2] 1,22 г / см3 (50 мас.% Водн. Раствор) | ||
| Температура плавления | 26,5 ° С (79,7 ° F, 299,6 К) | ||
| Точка кипения | 130 ° С (266 ° F, 403 К) разлагается | ||
| смешивающийся | |||
| Растворимость | очень растворим в алкоголь, эфир | ||
| Кислотность (пKа) | 1.2 | ||
| Основание конъюгата | Фосфинат | ||
| Структура | |||
| псевдотетраэдр | |||
| Опасности | |||
| Паспорт безопасности | Джей Ти Бейкер | ||
| точка возгорания | Не воспламеняется | ||
| Родственные соединения | |||
Связанный фосфор оксокислоты | Фосфорная кислота Фосфорная кислота | ||
Родственные соединения | Гипофосфит натрия Гипофосфит бария | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Гипофосфористая кислота (HPA), или фосфиновая кислота, это фосфор оксикислота и мощный Восстановитель с молекулярной формулой H3PO2. Это бесцветное легкоплавкое соединение, растворимое в воде, диоксане и спиртах. Формула этой кислоты обычно пишется H3PO2, но более наглядное представление - HOP (O) H2, что подчеркивает ее монопротический характер. Соли, полученные из этой кислоты, называются гипофосфиты.[3]
HOP (O) H2 существует в равновесие с несовершеннолетним таутомер HP (ОН)2. Иногда второстепенный таутомер называют гипофосфористой кислотой, а основной таутомер - фосфиновой кислотой.
Подготовка и доступность
Гипофосфорная кислота была впервые получена в 1816 году французским химиком. Пьер Луи Дюлонг (1785–1838).[4]
Кислоту получают промышленным способом с помощью двухстадийного процесса: во-первых, гипофосфитные соли щелочь и щелочноземельные металлы результат реакции белый фосфор горячим водным раствором соответствующего гидроксид, например Са (ОН)2.
- п4 + 4 ОН− + 4 часа2O → 4ЧАС
2PO−
2 + 2 часа2
Затем соль обрабатывают сильной неокисляющей кислотой с получением свободной гипофосфористой кислоты:
- ЧАС
2PO−
2 + H+ → H3PO2
HPA обычно поставляется в виде 50% водного раствора. Безводную кислоту нельзя получить простым испарением воды, так как кислота окисляется до фосфористая кислота и фосфорная кислота а также непропорционально к фосфористой кислоте и фосфин. Чистая безводная гипофосфористая кислота может быть получена путем непрерывной экстракции водных растворов с диэтиловый эфир.[5]
Реакции и использование
Его основное промышленное использование - химическое никелирование (Ni – P), хотя в основном он используется в виде соли (гипофосфит натрия ).[6]
Гипофосфорная кислота может восстанавливать оксид хрома (III) до оксида хрома (II):
ЧАС3PO2 + 2 Кр2О3 → 4 CrO + H3PO4
Органическая химия
В органической химии H3PO2 может использоваться для уменьшения соли арендиазония, преобразование ArN+
2 в Ar – H.[7][8][9] Когда диазотированный в концентрированном растворе гипофосфористой кислоты, амин заместитель может быть удален из аренов.
Благодаря своей способности действовать как мягкий восстанавливающий агент и поглотитель кислорода, он иногда используется в качестве добавки в Этерификация Фишера реакции, где предотвращает образование окрашенных примесей.
Он используется для получения производных фосфиновой кислоты.[10]
Химический статус DEA List I
Поскольку гипофосфористая кислота может уменьшить элементарный йод формировать йодистоводородная кислота, который является эффективным реагентом для снижения эфедрин или псевдоэфедрин к метамфетамин,[11] в Управление по борьбе с наркотиками США обозначил гипофосфористую кислоту (и ее соли) как Химический прекурсор Список I действует с 16 ноября 2001 г.[12] Соответственно, обработчики гипофосфористой кислоты или ее солей в Соединенные Штаты подлежат строгому нормативному контролю, включая требования к регистрации, ведению документации, отчетности и импорту / экспорту в соответствии с Закон о контролируемых веществах и 21 CFR §§ 1309 и 1310.[12][13][14]
Фосфинорганические кислоты (фосфинаты)
Фосфинорганические кислоты имеют формулу R2PO2H. Два водород атомы, непосредственно связанные с фосфором в фосфиновой кислоте, заменяются органическими группами. Например, формальдегид и H3PO2 реагировать давать (HOCH2)2PO2H. Точно так же фосфиновая кислота присоединяется к Майкл акцепторы, например с акриламидом дает H (HO) P (O) CH2CH2C (O) NH2. Семейство Cyanex диалкилфосфиновые кислоты используются в гидрометаллургии для извлечения металлов из руд.
Неорганические производные
Некоторые комплексы металлов были получены из H3PO2, одним из примеров является Ni (O2PH2)2.
Источники
- Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- Объявление ChemicalLand21
- Корбридж, Д. Фосфор: краткое описание его химии, биохимии и технологии (5-е изд.). Амстердам: Эльзевир. ISBN 0-444-89307-5.
- Попик, В. В .; Райт, А.Г .; Хан, Т. А .; Мерфи, Дж. А. (2004). «Гипофосфорная кислота». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза. Нью-Йорк: J. Wiley & Sons. Дои:10.1002 / 047084289X.
- Rich, D. W .; Смит, М. К. (1971). Химическое осаждение никеля, кобальта и железа. Покипси, Нью-Йорк: Корпорация IBM.
использованная литература
- ^ Петруччи, Ральф Х. (2007). Общая химия (9-е изд.). п. 946.
- ^ Прадёт Патнаик. Справочник неорганических химикатов. Макгроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Дулонг подготовил ацидный гипофосфореукс добавлением фосфида бария (Ba3п2) к воде, которая уступила фосфин газ (PH3), фосфат бария и гипофосфит бария. Поскольку газообразный фосфин покинул раствор, а фосфат бария выпал в осадок, в растворе остался только гипофосфит бария. Гипофосфористую кислоту затем можно получить из фильтрата путем добавления серной кислоты, которая осаждает сульфат бария, оставляя гипофосфористую кислоту в растворе. Увидеть:
- Дюлонг (1816 г.) "Extrait d'un mémoire sur les combinaisons du phosphore avec l'oxigène" (Отрывок из воспоминаний о соединениях фосфора с кислородом), Annales de Chimie et de Physique, 2 : 141–150. [На французском]
- Грэм, Томас, Элементы неорганической химии2-е изд. (Филадельфия, Пенсильвания: Бланшар и Ли, 1858 г.), п. 316.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 513. ISBN 978-0-08-037941-8.
- ^ Абрантес, Л. М. (1994). «О механизме химического нанесения Ni – P покрытия». Журнал Электрохимического общества. 141 (9): 2356. Дои:10.1149/1.2055125.
- ^ Уильям Х. Браун; Брент Л. Айверсон; Эрик Анслин; Кристофер С. Фут (2013). Органическая химия. Cengage Learning. п. 1003. ISBN 9781133952848.
- ^ Робисон, М. М .; Робисон, Б.Л. «2,4,6-Трибромбензойная кислота». Органический синтез. 36: 94.; Коллективный объем, 4
- ^ Корнблюм, Н. (1941). «3,3'-Диметоксибифенил и 3,3'-Диметилбифенил». Органический синтез. 21: 30. Дои:10.15227 / orgsyn.021.0030.
- ^ Карла Браво-Альтамирано, Жан-Люк Моншан (2008). «Катализированное палладием дегидративное аллилирование гипофосфористой кислоты аллиловыми спиртами». Орг. Синтезатор. 85: 96. Дои:10.15227 / orgsyn.085.0096.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Гордон, П. Э .; Фрай, А. Дж .; Хикс, Л. Д. (23 августа 2005 г.). «Дальнейшие исследования по восстановлению бензиловых спиртов гипофосфористой кислотой / йодом» (PDF). АРКИВОК. 2005 (vi): 393–400. ISSN 1424-6376.
- ^ а б 66 FR 52670—52675. 17 октября 2001 г.
- ^ "21 CFR 1309". Архивировано из оригинал на 2009-05-03. Получено 2007-05-02.
- ^ 21 USC, Глава 13 (Закон о контролируемых веществах)