Глицин - Glycine
| |||
| |||
| Имена | |||
|---|---|---|---|
| Другие имена 2-аминоэтановая кислота, гликокол | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| Сокращения | Gly, грамм | ||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.248 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C2ЧАС5NО2 | |||
| Молярная масса | 75.067 г · моль−1 | ||
| Внешность | Белое твердое вещество | ||
| Плотность | 1,1607 г / см3[2] | ||
| Температура плавления | 233 ° С (451 ° F, 506 К) (разложение) | ||
| 24,99 г / 100 мл (25 ° С)[3] | |||
| Растворимость | растворим в пиридин умеренно растворим в этиловый спирт не растворим в эфир | ||
| Кислотность (пKа) | 2,34 (карбоксил), 9,6 (амино)[4] | ||
| -40.3·10−6 см3/ моль | |||
| Фармакология | |||
| B05CX03 (ВОЗ) | |||
| Опасности | |||
| Паспорт безопасности | Видеть: страница данных | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 2600 мг / кг (мышь, перорально) | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
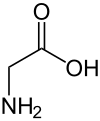
Глицин (символ Gly или же грамм;[5] /ˈɡлаɪsяп/)[6] является аминокислота что есть сингл водород атом как его боковая цепь. Это простейшая аминокислота (поскольку карбаминовая кислота нестабильно), с химическая формула NH2 ‐CH2 ‐COOH. Глицин - один из протеиногенные аминокислоты. это закодированный всеми кодоны начиная с GG (GGU, GGC, GGA, GGG). Глицин является неотъемлемой частью образования альфа-спирали во вторичной структуре белка за счет компактной формы. По той же причине это самая распространенная аминокислота в коллаген тройные спирали. Глицин также ингибирует нейротрансмиттер - вмешательство в его выброс в спинной мозг (например, во время Clostridium tetani инфекция) может вызвать спастический паралич из-за необузданного сокращения мышц.
Глицин представляет собой бесцветное кристаллическое вещество со сладким вкусом. Это единственный ахиральный протеиногенная аминокислота. Он может вписаться в гидрофильный или же гидрофобный среды, из-за его минимальной боковой цепи только одного атома водорода. Ацил радикальный является глицил.
История и этимология
Глицин был открыт в 1820 году французским химиком. Анри Браконно когда он гидролизовал желатин путем кипячения с серная кислота.[7] Первоначально он называл это «сахар желатина»,[8][9] но французский химик Жан-Батист Буссинго показал, что он содержит азот.[10] Американский ученый Эбен Нортон Хорсфорд, затем ученица немецкого химика Юстус фон Либих предложил название «гликоколл»;[11][12] Тем не менее Шведский химик Берцелиус предложил более простое название «глицин».[13][14] Название происходит от Греческий слово γλυκύς "сладкий вкус"[15] (что также связано с префиксами глико- и глюко-, как в гликопротеин и глюкоза ). В 1858 г. французский химик Огюст Кахур определили, что глицин был амин из уксусная кислота.[16]
Производство
Хотя глицин можно выделить из гидролизованного белка, он не используется в промышленном производстве, так как его удобнее производить химическим синтезом.[17] Двумя основными процессами являются аминирование хлоруксусная кислота с аммиак, давая глицин и хлорид аммония,[18] и Синтез аминокислот Strecker,[19] который является основным синтетическим методом в США и Японии.[20] Около 15 тысяч тонны производятся ежегодно таким образом.[21]
Глицин также образуется в качестве примеси при синтезе EDTA, возникающие в результате реакций побочного продукта аммиака.[22]
Химические реакции
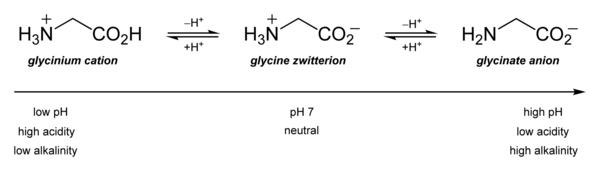
Наиболее важны его кислотно-основные свойства. В водном растворе глицин сам по себе амфотерный: при низком pH молекула может протонироваться с pKа около 2,4 и при высоком pH он теряет протон с pKа около 9,6 (точные значения pKа зависят от температуры и ионной силы).
Глицин действует как бидентатный лиганд для многих ионов металлов. Типичный комплекс Cu (глицинат)2, т.е. Cu (H2NCH2CO2)2, который существует как в цис-, так и в транс-изомерах.
Как бифункциональная молекула, глицин реагирует со многими реагентами. Их можно разделить на реакции с N-центром и с карбоксилатным центром.
Амин претерпевает ожидаемые реакции. С помощью хлорангидридов получают амидокарбоновую кислоту, такую как гиппуровая кислота[23] и ацетилглицин.[24] С азотистая кислота, получается гликолевая кислота (решимость ван Слайка ). С метилиодидом амин становится кватернизованным с образованием бетаин, натуральный продукт:
- ЧАС
3N+
CH
2COO−
+ 3 канала3Я → (CH
3)
3N+
CH
2COO−
+ 3 привет
Глицин конденсируется с образованием пептидов, начиная с образования глицилглицин:
- 2 ЧАС
3N+
CH
2COO−
→ ЧАС
3N+
CH
2КОНХЧ
2COO−
+ H2О
Пиролиз глицина или глицилглицина дает 2,5-дикетопиперазин, циклический диамид.
Метаболизм
Биосинтез
Глицин не необходим для питания человека, так как он биосинтезируется в организме из аминокислоты серин, который, в свою очередь, получается из 3-фосфоглицерат, но метаболическая способность к биосинтезу глицина не удовлетворяет потребность в синтезе коллагена.[25] У большинства организмов фермент серин гидроксиметилтрансфераза катализирует это преобразование через кофактор пиридоксальфосфат:[26]
- серин + тетрагидрофолат → глицин + N5,N10-Метилентетрагидрофолат + H2О
В печени позвоночные, синтез глицина катализируется глицинсинтаза (также называемый ферментом расщепления глицина). Это преобразование легко обратимый:[26]
- CO2 + NH+
4 + N5,N10-Метилентетрагидрофолат + НАДН + Н+ ⇌ Глицин + тетрагидрофолат + НАД+
Деградация
Глицин разлагается тремя путями. Преобладающий путь у животных и растений является обратным пути глицинсинтазы, упомянутому выше. В этом контексте задействованная ферментная система обычно называется система расщепления глицином:[26]
- Глицин + тетрагидрофолат + НАД+ ⇌ CO2 + NH+
4 + N5,N10-Метилентетрагидрофолат + НАДН + H+
Во втором пути глицин разлагается в два этапа. Первый шаг - это процесс, обратный биосинтезу глицина из серина серин-гидроксиметилтрансферазой. Затем серин превращается в пируват к сериндегидратаза.[26]
По третьему пути деградации глицин превращается в глиоксилат к Оксидаза D-аминокислот. Затем глиоксилат окисляется в печени. лактатдегидрогеназа к оксалат в НАД+-зависимая реакция.[26]
Период полувыведения глицина и его выведение из организма значительно зависит от дозы.[27] В одном исследовании период полувыведения варьировал от 0,5 до 4,0 часов.[27]
Глицин чрезвычайно чувствителен к антибиотикам, которые нацелены на фолиевую кислоту, и уровень глицина в крови резко падает в течение минуты после инъекции антибиотика. Некоторые антибиотики могут истощить более 90% глицина в течение нескольких минут после приема.[28]
Физиологическая функция
Основная функция глицина - это предшественник белков. Большинство белков содержат лишь небольшое количество глицина, за исключением коллаген, который содержит около 35% глицина из-за его периодически повторяющейся роли в формировании спиральной структуры коллагена в сочетании с гидроксипролин.[26][29] в генетический код, глицин кодируется всеми кодоны начиная с GG, а именно GGU, GGC, GGA и GGG.
Как биосинтетический промежуточный продукт
В высшем эукариоты, δ-аминолевулиновая кислота, ключевой предшественник порфирины, биосинтезируется из глицина и сукцинил-КоА ферментом АЛК-синтаза. Глицин обеспечивает центральную C2N субъединица всех пурины.[26]
Как нейротрансмиттер
Глицин ингибирует нейротрансмиттер в Центральная нервная система, особенно в спинной мозг, мозговой ствол, и сетчатка. Когда рецепторы глицина активированы, хлористый попадает в нейрон через ионотропные рецепторы, вызывая тормозящий постсинаптический потенциал (IPSP). Стрихнин является сильным антагонистом ионотропных рецепторов глицина, тогда как бикукуллин слабый. Глицин необходим коагонист вместе с глутамат за Рецепторы NMDA. В отличие от тормозящей роли глицина в спинном мозге, это поведение облегчается в (NMDA ) глутаматергический рецепторы, которые являются возбуждающими.[30] В LD50 глицина составляет 7930 мг / кг у крыс (перорально),[31] и обычно вызывает смерть от повышенной возбудимости.
Использует
В США глицин обычно продается двух марок: Фармакопея США («USP») и технический сорт. Продажи класса USP составляют примерно от 80 до 85 процентов рынка глицина в США. Если требуется чистота выше стандарта USP, например, для внутривенный для инъекций можно использовать более дорогой глицин фармацевтического качества. Глицин технической чистоты, который может соответствовать или не соответствовать стандартам качества USP, продается по более низкой цене для использования в промышленных приложениях, например, в качестве агента для комплексообразования металлов и отделки.[32]
Продукты животного и человеческого происхождения
Глицин не широко используется в пищевых продуктах из-за его пищевой ценности, за исключением настоев. Вместо этого роль глицина в пищевой химии - ароматизатор. Умеренно сладкий, с послевкусием сахарина. Он также обладает консервирующими свойствами, возможно, из-за его комплексообразования с ионами металлов. Глицинатные комплексы металлов, например глицинат меди (II) используются как добавки в корма для животных.[21]
Химическое сырье
Глицин является промежуточным звеном в синтезе множества химических продуктов. Он используется при изготовлении гербициды глифосат,[34] ипродион, глифозин, имипротрин и эглиназин.[21] Он используется как промежуточное звено в лекарствах, таких как тиамфеникол.[нужна цитата ]
Лабораторное исследование
Глицин является важным компонентом некоторых растворов, используемых в SDS-СТРАНИЦА метод анализа белков. Он служит буферным агентом, поддерживая pH и предотвращая повреждение образца во время электрофореза. Глицин также используется для удаления антител, меченных белками, из Вестерн-блоттинг мембраны, позволяющие исследовать многочисленные представляющие интерес белки из геля SDS-PAGE. Это позволяет получить больше данных из одного и того же образца, увеличивая надежность данных, уменьшая объем обработки образца и количество необходимых образцов. Этот процесс известен как зачистка.
Присутствие в космосе
Присутствие глицина за пределами Земли было подтверждено в 2009 г. на основе анализа проб, взятых в 2004 г. НАСА космический корабль Звездная пыль от кометы Дикий 2 и впоследствии вернулся на землю. Глицин ранее был обнаружен в Метеорит Мерчисон в 1970 г.[35] Открытие кометного глицина поддержало теорию панспермия, который утверждает, что «строительные блоки» жизни широко распространены по всей Вселенной.[36] В 2016 г. обнаружение глицина в комете 67P / Чурюмова-Герасименко Космический корабль Rosetta было объявлено.[37]
Обнаружение глицина вне Солнечная система в межзвездная среда был обсужден.[38] В 2008 г. Институт радиоастрономии Макса Планка обнаружил спектральные линии глициноподобной молекулы аминоацетонитрил в Большая молекула Heimat, гигантское газовое облако около центра Галактики в созвездии Стрелец.[39]
Эволюция
Несколько независимых эволюционных исследований с использованием различных типов данных показали, что глицин принадлежит к группе аминокислот, составляющих ранний генетический код.[40][41][42][43] Например, регионы низкой сложности (в белках), которые могут напоминать протопептиды ранних генетический код сильно обогащены глицином.[43]
Наличие в продуктах питания
| Еда | г / 100г |
|---|---|
| Закуски, шкуры свинины | 11.04 |
| семена кунжута мука (нежирная) | 3.43 |
| Напитки, протеиновый порошок (соя -основан) | 2.37 |
| Семена, мука из семян сафлора, частично обезжиренная | 2.22 |
| Мясо, бизон, говядина и другие (разные части) | 1.5-2.0 |
| Желатиновые десерты | 1.96 |
| Семена, тыква и давить ядра семян | 1.82 |
| Индейка, все классы, спина, мясо и кожа | 1.79 |
| Курица, бройлеры или фритюрницы, мясо и кожа | 1.74 |
| Свинина, фарш, 96% нежирная / 4% жира, вареная, в крошке | 1.71 |
| Бекон и говяжьи палочки | 1.64 |
| Арахис | 1.63 |
| Ракообразные, колючий лобстер | 1.59 |
| Специи, горчичное семя, земля | 1.59 |
| Салями | 1.55 |
| Орехи, орехи сушеные | 1.51 |
| Рыба, лосось, горбуша, консервы, соленые продукты | 1.42 |
| Миндаль | 1.42 |
| Рыбы, скумбрия | 0.93 |
| Готовые злаки, мюсли, домашние | 0.81 |
| Лук-порей, (луковица и нижняя часть листа), лиофилизированная | 0.7 |
| Сыр, пармезан (и др.), тертые | 0.56 |
| Соевые бобы, зеленый, вареный, вареный, сушеный, без соли | 0.51 |
| Хлеб, белок (включая глютен) | 0.47 |
| Яйцо, целое, вареное, жареное | 0.47 |
| Фасоль белая, зрелые семена, вареные, вареные, с солью | 0.38 |
| Чечевица, зрелые семена, вареные, вареные, с солью | 0.37 |
Смотрите также
Рекомендации
- ^ Индекс Merck: энциклопедия химикатов, лекарств и биологических препаратов (11-е изд.), Merck, 1989, ISBN 091191028X, 4386.
- ^ Справочник по химии и физике, CRC Press, 59-е издание, 1978 г.
- ^ «Растворимость и плотность». Prowl.rockefeller.edu. Получено 2013-11-13.
- ^ Доусон, R.M.C. и др., Данные для биохимических исследований, Oxford, Clarendon Press, 1959.
- ^ «Номенклатура и символика аминокислот и пептидов». Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано с оригинал 9 октября 2008 г.. Получено 5 марта 2018.
- ^ «Глицин | Определение глицина на английском языке в Оксфордских словарях».
- ^ Плиммер, Р.Х.А. (1912) [1908]. Plimmer, R.H.A .; Хопкинс, Ф. (ред.). Химический состав белков. Монографии по биохимии. Часть I. Анализ (2-е изд.). Лондон: Longmans, Green and Co., стр. 82. Получено 18 января, 2010.
- ^ Браконно, Анри (1820). "Sur la conversion des matières animales en nouvelles elements par le moyen de l'acide sulfique" [О превращении животных материалов в новые вещества с помощью серной кислоты]. Annales de Chimie et de Physique. 2-я серия (на французском языке). 13: 113–125. ; см. стр. 114.
- ^ Маккензи, Колин (1822). Тысяча опытов в химии: с иллюстрациями природных явлений; и практические наблюдения за производственными и химическими процессами, которые в настоящее время проводятся для успешного выращивания полезных искусств .... Сэр Р. Филлипс и компания. п.557.
- ^ Буссинго (1838). "Sur la композиция du sucre de gélatine et de l'acide nitro-saccharique de Braconnot" [О составе сахара желатина и нитроглюкаровой кислоты Браконно]. Comptes Rendus (На французском). 7: 493–495.
- ^ Хорсфорд, Э. (1847). «Гликоколл (желатиновый сахар) и некоторые продукты его разложения». Американский журнал науки и искусства. 2-я серия. 3: 369–381.
- ^ Идэ, Аарон Дж. (1970). Развитие современной химии. Курьерская корпорация. ISBN 9780486642352.
- ^ Берцелиус, Якоб (1848). Jahres-Bericht über die Fortschritte der Chemie und Mineralogie (Годовой отчет о достижениях химии и минералогии). т. 47. Tübigen, (Германия): Laupp. п. 654. С п. 654: "Er hat dem Leimzucker как Basis den Namen" Гликоколл gegeben. … Глицин genannt werden, und diesen Namen werde ich anwenden ". (Он [то есть американский ученый Эбен Нортон Хорсфорд, затем ученица немецкого химика Юстус фон Либих ] дал название "гликоколл" Leimzucker [сахар желатина], основа. Это название не благозвучно и, помимо недостатка, противоречит названиям остальных баз. Он состоит из γλυχυς (сладкого) и χολλα (животного клея). Поскольку эта органическая основа - единственная [одна], которая имеет сладкий вкус, то ее можно гораздо короче назвать «глицин», и я буду использовать это название.)
- ^ Най, Мэри Джо (1999). Перед большой наукой: в поисках современной химии и физики, 1800-1940 гг.. Издательство Гарвардского университета. ISBN 9780674063822.
- ^ "глицин". Оксфордские словари. Получено 2015-12-06.
- ^ Каур, А. (1858). "Recherches sur les acides amidés" [Исследования аминированных кислот]. Comptes Rendus (На французском). 46: 1044–1047.
- ^ Окафор, Ндука (09.03.2016). Современная промышленная микробиология и биотехнология. CRC Press. ISBN 9781439843239.
- ^ Ingersoll, A. W .; Бэбкок, С. Х. (1932). «Гиппуровая кислота». Органический синтез. 12: 40.; Коллективный объем, 2, п. 328
- ^ Вайли (14 декабря 2007 г.). Kirk-Othmer Food and Feed Technology, набор из 2 объемов. Джон Вили и сыновья. ISBN 9780470174487.
- ^ «Глицин конференция (предварительная)». USITC. Архивировано 22 февраля 2012 года.. Получено 2014-06-13.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- ^ а б c Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; Криммер, Ханс-Петер; Лойхтенбергер, Вольфганг; Weckbecker, Кристоф (2007). "Аминокислоты". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH.
- ^ Харт, Дж. Роджер (2005). «Этилендиаминтетрауксусная кислота и родственные хелатирующие агенты». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a10_095.
- ^ Ingersoll, A. W .; Бэбкок, С. Х. (1932). «Гиппуровая кислота». Орг. Синтезатор. 12: 40. Дои:10.15227 / orgsyn.012.0040.
- ^ Herbst, R.M .; Шемин, Д. (1939). «Ацетилглицин». Орг. Синтезатор. 19: 4. Дои:10.15227 / orgsyn.019.0004.
- ^ Мелендес-Хевиа, Э; Де Пас-Луго, П; Корниш-Боуден, А; Карденас, М. Л. (декабрь 2009 г.). «Слабое звено в метаболизме: метаболическая способность для биосинтеза глицина не удовлетворяет потребность в синтезе коллагена». Журнал биологических наук. 34 (6): 853–72. Дои:10.1007 / s12038-009-0100-9. PMID 20093739. S2CID 2786988.
- ^ а б c d е ж грамм Нельсон, Дэвид Л .; Кокс, Майкл М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: У. Х. Фриман. С. 127, 675–77, 844, 854. ISBN 0-7167-4339-6.
- ^ а б Хан Р.Г. (1993). «Дозозависимый период полувыведения глицина». Урологическое исследование. 21 (4): 289–291. Дои:10.1007 / BF00307714. PMID 8212419. S2CID 25138444.
- ^ ACS Chem Biol. 2010 Aug 20; 5 (8): 787–795. Doi: 10.1021 / cb100096f
- ^ Шпак, Пол (2011). «Химия и ультраструктура костей рыб: значение для тафономии и анализа стабильных изотопов». Журнал археологической науки. 38 (12): 3358–3372. Дои:10.1016 / j.jas.2011.07.022.
- ^ «Недавние разработки в рецепторах NMDA». Китайский медицинский журнал. 2000 г.
- ^ «Данные о безопасности (MSDS) глицина». Лаборатория физической и теоретической химии Оксфордского университета. 2005. Архивировано с оригинал на 2007-10-20. Получено 2006-11-01.
- ^ «Глицин из Японии и Кореи» (PDF). Комиссия по международной торговле США. Январь 2008 г.. Получено 2014-06-13.
- ^ Casari, B.M .; Махмудхани, А. Х .; Лангер, В. (2004). "Переопределение СНГ-Аквабис (глицинато-κ2НЕТ) медь (II) ». Acta Crystallogr. E. 60 (12): m1949 – m1951. Дои:10.1107 / S1600536804030041.
- ^ Stahl, Shannon S .; Альстерс, Пол Л. (13.07.2016). Жидкофазный аэробный окислительный катализ: промышленное применение и академические перспективы. Джон Вили и сыновья. ISBN 9783527690152.
- ^ Квенволден, Кейт А .; Лоулесс, Джеймс; Перинг, Кэтрин; Петерсон, Этта; Флорес, Хосе; Поннамперума, Кирилл; Каплан, Исаак Р .; Мур, Карлтон (1970). «Доказательства наличия внеземных аминокислот и углеводородов в метеорите Мерчисон». Природа. 228 (5275): 923–926. Bibcode:1970Натура.228..923K. Дои:10.1038 / 228923a0. PMID 5482102. S2CID 4147981.
- ^ «Строительный блок жизни, найденный на комете - Thomson Reuters 2009». Рейтер. 18 августа 2009 г.. Получено 2009-08-18.
- ^ Европейское космическое агентство (27 мая 2016 г.). «Комета Розетты содержит ингредиенты для жизни». Получено 2016-06-05.
- ^ Снайдер Л. Е., Ловас Ф. Дж., Холлис Дж. М. и др. (2005). «Строгая попытка проверить межзвездный глицин». Astrophys J. 619 (2): 914–930. arXiv:Astro-ph / 0410335. Bibcode:2005ApJ ... 619..914S. Дои:10.1086/426677. S2CID 16286204.
- ^ Сотрудники. «Органическая молекула, похожая на аминокислоту, найдена в созвездии Стрельца, 27 марта 2008 г. - Science Daily». Получено 2008-09-16.
- ^ Трифонов, Э.Н. (декабрь 2000 г.). «Согласованный временной порядок аминокислот и эволюция триплетного кода». Ген. 261 (1): 139–151. Дои:10.1016 / S0378-1119 (00) 00476-5.
- ^ Хиггс, Пол Дж .; Пудриц, Ральф Э. (июнь 2009 г.). "Термодинамическая основа синтеза пребиотических аминокислот и природа первого генетического кода". Астробиология. 9 (5): 483–490. Дои:10.1089 / аст.2008.0280. ISSN 1531-1074.
- ^ Халиотис, Анаргирос; Властаридис, Панайотис; Мосиалос, Димитрис; Ибба, Майкл; Becker, Hubert D .; Статопулос, Константинос; Амуциас, Григориос Д. (17 февраля 2017 г.). «Сложная эволюционная история аминоацил-тРНК синтетаз». Исследования нуклеиновых кислот. 45 (3): 1059–1068. Дои:10.1093 / нар / gkw1182. ISSN 0305-1048. ЧВК 5388404. PMID 28180287.
- ^ а б Нтунтуми, Криса; Властаридис, Панайотис; Мосиалос, Димитрис; Статопулос, Константинос; Илиопулос, Иоаннис; Промпонас, Василиос; Оливер, Стивен Дж. Амуциас, Григорис Д. (04.11.2019). «Области низкой сложности в белках прокариот выполняют важные функциональные роли и являются высококонсервативными». Исследования нуклеиновых кислот. 47 (19): 9998–10009. Дои:10.1093 / нар / gkz730. ISSN 0305-1048. ЧВК 6821194. PMID 31504783.
- ^ «Национальная база данных по питательным веществам для справочной информации». Министерство сельского хозяйства США. Архивировано из оригинал на 2015-03-03. Получено 2009-09-07. Цитировать журнал требует
| журнал =(помощь)
дальнейшее чтение
- Куан Ю.Дж., Чарнли С.Б., Хуанг Х.С. и др. (2003). «Межзвездный глицин». Astrophys J. 593 (2): 848–867. Bibcode:2003ApJ ... 593..848K. Дои:10.1086/375637.
- Новак, Рэйчел. «Аминокислота найдена в глубоком космосе - 18 июля 2002 г. - Новый ученый". Получено 2007-07-01.
внешняя ссылка
- Глицин MS Spectrum
- Глицин на PDRHealth.com
- Система расщепления глицином
- Глициновая терапия - новое направление лечения шизофрении?
- «Органическая молекула, похожая на аминокислоту, найдена в созвездии Стрельца». ScienceDaily. 27 марта 2008 г.
- Цай, Гочуань Э. (1 декабря 2008 г.). «Новый класс нейролептиков: усиление нейротрансмиссии, опосредованной рецепторами NMDA». Психиатрические времена. 25 (14).
- ChemSub Online (Глицин).
- Ученые НАСА обнаружили глицин, фундаментальный строительный блок жизни, в образцах кометы Wild 2, возвращенных космическим кораблем НАСА Stardust.