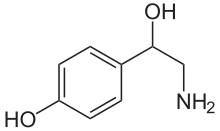
Норэпинефрин - Norepinephrine
 | |
 | |
| Клинические данные | |
|---|---|
| Другие имена |
|
| Физиологический данные | |
| Источник ткани | голубое пятно; Симпатическая нервная система; мозговое вещество надпочечников |
| Целевые ткани | общесистемный |
| Рецепторы | α1, α2, β1, β3 |
| Агонисты | симпатомиметические препараты, клонидин, изопреналин |
| Антагонисты | Трициклические антидепрессанты, бета-блокаторы, нейролептики |
| Предшественник | дофамин |
| Биосинтез | дофамин β-монооксигеназа |
| Метаболизм | МАО-А; COMT |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.088 |
| Химические и физические данные | |
| Формула | C8ЧАС11NО3 |
| Молярная масса | 169.180 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Норэпинефрин (NE), также называемый норадреналин (NA) или же норадреналин, является органический химикат в катехоламин семья, которая функционирует в мозг и тело как гормон и нейротрансмиттер. Название «норадреналин», производное от латинского корня, означающего «в / рядом с почками», чаще используется в Соединенном Королевстве; в Соединенных Штатах, как правило, предпочтение отдается «норэпинефрину», производному от греческих корней, имеющих то же значение.[1] «Норэпинефрин» также является международное непатентованное название дано препарат, средство, медикамент.[2] Независимо от того, какое название используется для самого вещества, части тела, которые производят или подвергаются воздействию, называются норадренергический.
Общая функция норэпинефрина - мобилизация мозга и тела к действию. Высвобождение норэпинефрина является самым низким во время сна, повышается во время бодрствования и достигает гораздо более высоких уровней в ситуациях стресса или опасности, в так называемом борьба или бегство. В мозге норэпинефрин увеличивает возбуждение и бдительность, способствует бдительности, улучшает формирование и восстановление памяти и фокусирует внимание; это также увеличивает беспокойство и беспокойство. В остальном теле норадреналин увеличивается. частота сердцебиения и артериальное давление, запускает выпуск глюкоза от накопителей энергии, увеличивает кровоток к скелетные мышцы, уменьшает приток крови к желудочно-кишечной системе и препятствует опорожнению мочевого пузыря и перистальтика желудочно-кишечного тракта.
В головном мозге норадреналин вырабатывается в ядра которые небольшие, но оказывают мощное воздействие на другие области мозга. Наиболее важным из этих ядер является голубое пятно, расположенный в мосты. Вне мозга норэпинефрин используется в качестве нейромедиатора. симпатические ганглии расположен недалеко от спинной мозг или в брюшная полость, Ячейки Меркель расположен в коже, и он также попадает непосредственно в кровоток через надпочечники. Независимо от того, как и где он высвобождается, норэпинефрин действует на клетки-мишени, связываясь с ними и активируя их. адренорецепторы расположен на поверхности клетки.
Множество важных с медицинской точки зрения лекарств действуют, изменяя действие систем норадреналина. Норадреналин сам по себе широко используется в качестве инъекционного препарата для лечения критически низкого артериального давления. Бета-блокаторы, которые противодействуют некоторым эффектам норадреналина, блокируя их рецепторы, часто используются для лечения глаукома, мигрень, а также ряд сердечно-сосудистых проблем. Альфа-блокаторы, которые противодействуют другому набору эффектов норадреналина, используются для лечения нескольких сердечно-сосудистых и психических заболеваний. Альфа-2 агонисты часто обладают седативным эффектом и обычно используются в качестве усилителей анестезии в хирургии, а также при лечении лекарственными препаратами или алкогольная зависимость. Многие важные психиатрические препараты оказывают сильное воздействие на системы норадреналина в головном мозге, что приводит к побочным эффектам, которые могут быть полезными или вредными.
Структура
Норэпинефрин - это катехоламин и фенэтиламин.[3] Его структура отличается от структуры адреналин только в этом адреналине есть метильная группа присоединен к его азоту, тогда как метильная группа заменена атомом водорода в норэпинефрине.[3] Префикс ни- происходит как сокращение от слова «нормальный», используемое для обозначения деметилированный сложный.[4]


Биохимические механизмы
Биосинтез
Норэпинефрин - это синтезированный от аминокислота тирозин серией ферментативных стадий в мозговое вещество надпочечников и постганглионарные нейроны из Симпатическая нервная система. В то время как преобразование тирозина в дофамин происходит преимущественно в цитоплазме, преобразование дофамина в норэпинефрин путем дофамин β-монооксигеназа происходит преимущественно внутри везикулы нейротрансмиттеров.[8] В метаболический путь является:
- Фенилаланин → Тирозин → L-ДОФА → Дофамин → Норэпинефрин[8]
Таким образом, прямым предшественником норэпинефрина является дофамин, который косвенно синтезируется из незаменимой аминокислоты фенилаланин или заменимая аминокислота тирозин.[8] Эти аминокислоты содержатся почти в каждом белке и, как таковые, поступают с пищей, содержащей белок, причем тирозин является наиболее распространенным.
Фенилаланин превращается в тирозин ферментом фенилаланингидроксилаза, с молекулярными кислород (O2) и тетрагидробиоптерин в качестве кофакторы. Тирозин превращается в L-ДОПА ферментом тирозингидроксилаза, с тетрагидробиоптерин, O2, и вероятно двухвалентное железо (Fe2+) как кофакторы.[8] Превращение тирозина в L-ДОПА ингибируется Метирозин, аналог тирозина. L-ДОФА превращается в дофамин ферментом ароматный Lдекарбоксилаза аминокислот (также известная как DOPA декарбоксилаза), с пиридоксальфосфат в качестве кофактора.[8] Затем дофамин превращается в норэпинефрин ферментом дофамин β-монооксигеназа (ранее известный как дофамин-β-гидроксилаза), с O2 и аскорбиновая кислота как кофакторы.[8]
Сам норэпинефрин в дальнейшем может быть преобразован в адреналин ферментом фенилэтаноламин N-метилтрансфераза с S-аденозил-L-метионин как кофактор.[8]
Деградация
У млекопитающих норэпинефрин быстро разлагается до различных метаболиты. Начальный этап распада может быть катализатором любого из ферментов. моноаминоксидаза (в основном моноаминоксидаза A ) или же COMT.[9] Отсюда распад может происходить разными путями. Основные конечные продукты: Ванилилминдальная кислота или сопряженная форма MHPG, оба из которых считаются биологически неактивными и выводятся с мочой.[10]

Функции
Клеточные эффекты
| Семья | Рецептор | Тип | Механизм |
|---|---|---|---|
| Альфа | α1 | граммq -сопряженный. | Увеличивать IP3 и кальций к активация фосфолипаза C. |
| α2 | граммя/ГРАММо -сопряженный. | Снижаться лагерь к подавление аденилатциклаза. | |
| Бета | β1 | граммs -сопряженный. | Увеличивать лагерь к активация аденилатциклаза. |
| β2 | |||
| β3 |
Как и многие другие биологически активные вещества, норэпинефрин проявляет свое действие, связываясь и активируя рецепторы расположены на поверхности клеток. Были идентифицированы два широких семейства рецепторов норэпинефрина, известные как альфа- и бета-адренорецепторы.[10] Альфа-рецепторы делятся на подтипы α1 и α2; бета-рецепторы на подтипы β1, β2, и β3.[10] Все они функционируют как G-белковые рецепторы, что означает, что они оказывают свое влияние через сложную вторая система обмена сообщениями.[10] Рецепторы альфа-2 обычно обладают ингибирующим действием, но многие из них расположены пресинаптически (т.е.на поверхности клеток, выделяющих норадреналин), поэтому чистым эффектом активации альфа-2 часто является уменьшение количества выделяемого норадреналина.[10] Рецепторы альфа-1 и все три типа бета-рецепторов обычно обладают возбуждающим действием.[10]
Хранение, выпуск и обратный захват

Внутри мозга норэпинефрин функционирует как нейротрансмиттер, и управляется набором механизмов, общих для всех моноаминовые нейротрансмиттеры. После синтеза норэпинефрин транспортируется из цитозоль в синаптические везикулы посредством везикулярный переносчик моноаминов (ВМАТ).[11] VMAT может подавляться Резерпин вызывая уменьшение запасов нейротрансмиттеров. Норэпинефрин хранится в этих пузырьках до тех пор, пока не попадет в синаптическая щель, обычно после потенциал действия заставляет пузырьки выпустить свое содержимое непосредственно в синаптическая щель через процесс, называемый экзоцитоз.[10]
Попадая в синапс, норэпинефрин связывается с рецепторами и активирует их. После потенциала действия молекулы норэпинефрина быстро освобождаются от своих рецепторов. Затем они всасываются обратно в пресинаптическую клетку через обратный захват при посредничестве прежде всего переносчик норэпинефрина (СЕТЬ).[12] Вернувшись в цитозоль, норэпинефрин может расщепляться моноаминоксидаза или переупакован в пузырьки с помощью VMAT, чтобы сделать его доступным для будущего выпуска.[11]
Симпатическая нервная система

Норэпинефрин - главный нейротрансмиттер, используемый симпатической нервной системой, которая состоит из примерно двух десятков симпатические цепные ганглии расположен рядом со спинным мозгом, плюс набор превертебральные ганглии располагается в груди и животе.[13] Эти симпатические ганглии связаны с многочисленными органами, включая глаза, слюнные железы, сердце, легкие, печень, желчный пузырь, желудок, кишечник, почки, мочевой пузырь, репродуктивные органы, мышцы, кожу и надпочечники.[13] Симпатическая активация надпочечников вызывает часть, называемую мозговое вещество надпочечников для выпуска норадреналина (а также адреналина) в кровоток, из которого, действуя как гормон, он получает дополнительный доступ к широкому спектру тканей.[13]
Вообще говоря, действие норадреналина на каждый орган-мишень заключается в изменении его состояния таким образом, чтобы он более способствовал активному движению тела, часто за счет увеличения потребления энергии и повышенного износа.[14] Это можно противопоставить ацетилхолин -опосредованные эффекты парасимпатическая нервная система, который переводит большинство тех же органов в состояние, более благоприятное для отдыха, восстановления и переваривания пищи и обычно менее затратное с точки зрения расхода энергии.[14]
Симпатические эффекты норадреналина включают:
- В глазах увеличивается выработка слез, делая глаза более влажными,[15] и расширение зрачка через сокращение расширитель радужки.
- В сердце увеличение количества перекачиваемой крови.[16]
- В коричневая жировая ткань, увеличение количества сжигаемых калорий для выработки тепла тела (термогенез ).[17]
- Множественные эффекты на иммунная система. Симпатическая нервная система является основным путем взаимодействия между иммунной системой и мозгом, и некоторые компоненты получают симпатические сигналы, в том числе вилочковая железа, селезенка, и лимфатический узел. Однако эффекты сложны: некоторые иммунные процессы активируются, а другие подавляются.[18]
- в артерии, сужение кровеносных сосудов, вызывающее повышение артериального давления.[19]
- в почки, релиз ренин и удержание натрия в кровотоке.[20]
- в печень, увеличение производства глюкоза, либо гликогенолиз после еды или глюконеогенез когда пища не использовалась недавно.[20] В большинстве случаев глюкоза является основным источником энергии для организма.
- в поджелудочная железа, увеличенный выпуск глюкагон, гормон, основное действие которого заключается в увеличении выработки глюкозы печенью.[20]
- В скелетных мышцах увеличение поглощения глюкозы.[20]
- В жировая ткань (т. е. жировые клетки), увеличение липолиз то есть преобразование жира в вещества, которые могут использоваться непосредственно в качестве источников энергии в мышцах и других тканях.[20]
- в желудок и кишечник, снижение пищеварительной деятельности. Это является результатом обычно подавляющего действия норадреналина на кишечная нервная система, вызывая снижение подвижности желудочно-кишечного тракта, кровотока и секреции пищеварительных веществ.[21]
Норадреналин и АТФ находятся сочувствующий ко-передатчики. Установлено, что эндоканнабиноид анандамид и каннабиноид ВЫИГРАТЬ 55,212-2 может изменить общий ответ на стимуляцию симпатического нерва, что указывает на то, что CB1 рецепторы посредничать симпато - тормозящее действие. Таким образом, каннабиноиды могут подавлять как норадренергические, так и пуринергический компоненты симпатической нейротрансмиссия.[22]
Центральная нервная система

Норадренергические нейроны головного мозга образуют система нейротрансмиттеров, который при активации оказывает влияние на большие участки мозга. Эффекты проявляются в настороженности, возбуждение, и готовность к действию.
Норадренергический нейроны (то есть нейроны, основным нейротрансмиттером которых является норадреналин) сравнительно немногочисленны, и их клеточные тела ограничены несколькими относительно небольшими областями мозга, но они посылают проекции во многие другие области мозга и оказывают мощное воздействие на свои цели. Эти группы норадренергических клеток были впервые нанесены на карту в 1964 году Анникой Дальстрем и Кьеллом Фюксом, которые присвоили им метки, начинающиеся с буквы «А» (от «аминергический»).[23] На их схеме области от A1 до A7 содержат нейромедиатор норадреналин (от A8 до A14 содержатся дофамин ). Группа норадренергических клеток A1 расположен в каудальной вентролатеральной части мозгового вещества и играет роль в контроле метаболизма жидкости в организме.[24] Группа норадренергических клеток А2 расположен в области ствола мозга, называемой одиночное ядро; эти клетки участвуют в различных ответах, включая контроль приема пищи и реакцию на стресс.[25] Группы ячеек A5 и A7 проецируются в основном на спинной мозг.[26]
Самый важный источник норэпинефрина в головном мозге - это голубое пятно, который содержит группа норадренергических клеток A6 и примыкает к группе клеток A4. Голубое пятно довольно мало в абсолютном выражении - у приматов оно, по оценкам, содержит около 15000 нейронов, что составляет менее одной миллионной нейронов в головном мозге, - но оно посылает проекции во все основные части головного мозга, а также в спинной мозг. .[27]
Уровень активности голубого пятна широко коррелирует с бдительностью и скоростью реакции. Активность LC низка во время сна и практически отсутствует в состоянии REM (сновидения).[28] Он проходит на базовом уровне во время бодрствования, но временно увеличивается, когда человеку предъявляют какой-либо стимул, привлекающий внимание. Неприятные раздражители, такие как боль, затрудненное дыхание, вздутие мочевого пузыря, жара или холод, вызывают большее увеличение. Крайне неприятные состояния, такие как сильный страх или сильная боль, связаны с очень высоким уровнем активности LC.[27]
Норэпинефрин, выделяемый голубым пятном, влияет на работу мозга разными способами. Он улучшает обработку сенсорных входных сигналов, усиливает внимание, улучшает формирование и извлечение как долговременной, так и рабочей памяти, а также увеличивает способность мозга реагировать на входные данные, изменяя паттерн активности в префронтальной коре и других областях.[29] Контроль уровня возбуждения достаточно силен, так что лекарственное подавление LC оказывает сильное седативное действие.[28]
Существует большое сходство между ситуациями, которые активируют голубое пятно в головном мозге, и ситуациями, которые активируют симпатическую нервную систему на периферии: LC по существу мобилизует мозг для действий, в то время как симпатическая система мобилизует тело. Утверждалось, что это сходство возникает из-за того, что оба они в значительной степени контролируются одними и теми же структурами мозга, в частности, частью ствола мозга, называемой ядро гигантоцеллюлярное.[27]
Кожа
Норэпинефрин также производится Ячейки Меркель которые являются частью соматосенсорной системы. Он активирует афферентный сенсорный нейрон.[30]
Фармакология
Большое количество важных лекарств проявляют свое действие, взаимодействуя с норадреналиновой системой мозга или тела. Их применение включает лечение сердечно-сосудистых заболеваний, шока и различных психических заболеваний. Эти препараты делятся на: симпатомиметические препараты которые имитируют или усиливают по крайней мере некоторые эффекты норадреналина, высвобождаемого симпатической нервной системой; симпатолитический лекарства, напротив, блокируют по крайней мере некоторые эффекты.[31] Оба они представляют собой большие группы с разнообразным использованием, в зависимости от того, какие именно эффекты усиливаются или блокируются.[31]
Норэпинефрин сам по себе классифицируется как симпатомиметическое лекарство: его эффекты при внутривенной инъекции, увеличивающие частоту и силу сердечных сокращений и сужение кровеносных сосудов, делают его очень полезным для лечения неотложных состояний, связанных с критически низким кровяным давлением.[31] Кампания выживания при сепсисе рекомендован норэпинефрин в качестве средства первой линии при лечении септический шок который не реагирует на жидкостная реанимация, дополненный вазопрессин и адреналин. Дофамин использование ограничено только тщательно отобранными пациентами.[32]
Бета-блокаторы
Это симпатолитический препараты, блокирующие действие бета-адренорецепторы при этом оказывает незначительное влияние на альфа-рецепторы или совсем не влияет на них. Иногда их используют для лечения высокое кровяное давление, мерцательная аритмия и хроническая сердечная недостаточность, но недавние обзоры пришли к выводу, что другие типы лекарств обычно лучше для этих целей.[33][34] Однако бета-блокаторы могут быть хорошим выбором при других сердечно-сосудистых заболеваниях, в том числе: стенокардия и Синдром Марфана.[35] Они также широко используются для лечения глаукома, чаще всего в виде глазных капель.[36] Поскольку они снижают симптомы тревоги и тремор, они иногда используются артистами, ораторами и спортсменами для уменьшения беспокойство по поводу производительности, хотя они не одобрены с медицинской точки зрения для этой цели и запрещены Международный олимпийский комитет.[37][38]
Однако полезность бета-блокаторов ограничена рядом серьезных побочных эффектов, включая замедление частоты сердечных сокращений, снижение артериального давления, астму и реактивная гипогликемия.[36] Негативные эффекты могут быть особенно серьезными у людей, страдающих сахарный диабет.[33]
Альфа-блокаторы
Это симпатолитический препараты, которые блокируют действие адренергических альфа-рецепторов, при этом практически не влияя на бета-рецепторы.[39] Однако препараты, принадлежащие к этой группе, могут иметь очень разные эффекты, в зависимости от того, блокируют ли они в основном рецепторы альфа-1, рецепторы альфа-2 или и то, и другое. Рецепторы альфа-2, как описано в другом месте этой статьи, часто локализуются на самих нейронах, выделяющих норэпинефрин, и оказывают на них тормозящее действие; следовательно, блокада рецепторов альфа-2 обычно приводит к увеличению высвобождения норэпинефрина.[39] Рецепторы альфа-1 обычно расположены на клетках-мишенях и оказывают на них возбуждающее действие; следовательно, блокада рецепторов альфа-1 обычно приводит к блокированию некоторых эффектов норадреналина.[39] Такие препараты как фентоламин которые действуют на оба типа рецепторов, могут вызывать сложную комбинацию обоих эффектов. В большинстве случаев, когда термин «альфа-блокатор» используется без уточнения, он относится к селективному антагонисту альфа-1.
Селективный альфа-1 блокаторы имеют множество применений. Поскольку одним из их эффектов является подавление сокращения гладкой мускулатуры простаты, они часто используются для лечения симптомов доброкачественная гиперплазия предстательной железы.[40] Альфа-адреноблокаторы также могут помочь людям избавиться от камней в почках.[41] Их влияние на центральную нервную систему делает их полезными для лечения генерализованное тревожное расстройство, паническое расстройство, и пост-травматическое стрессовое растройство.[42] Однако они могут иметь серьезные побочные эффекты, включая снижение артериального давления.[39]
Некоторые антидепрессанты частично действуют избирательно. альфа-2 блокаторы, но самым известным препаратом в этом классе является йохимбин, который добывается из коры африканского Йохимбе дерево.[43] Йохимбин действует как усилитель мужской потенции, но его полезность для этой цели ограничена серьезными побочными эффектами, включая беспокойство и бессонницу.[43] Передозировка может вызвать опасное повышение артериального давления.[43] Йохимбин запрещен во многих странах, но в Соединенных Штатах, поскольку он извлекается из растений, а не синтезируется химическим путем, он продается. без рецепта как пищевая добавка.[44]
Альфа-2 агонисты
Это симпатомиметик препараты, которые активируют альфа-2 рецепторы или усилить их эффекты.[45] Поскольку рецепторы альфа-2 являются ингибирующими, и многие из них находятся пресинаптически на высвобождающих норэпинефрин клетках, общий эффект этих препаратов обычно заключается в уменьшении количества высвобождаемого норадреналина.[45] Препараты из этой группы, которые могут проникать в мозг, часто обладают сильным седативным действием из-за их ингибирующего действия на голубое пятно.[45] Клонидин, например, используется для лечения тревожных расстройств и бессонницы, а также как успокаивающее средство. премедикация для пациентов, которым предстоит операция.[46] Ксилазин, еще один препарат из этой группы, также является сильнодействующим седативным средством и часто используется в сочетании с кетамин как общий наркоз за ветеринарная хирургия —В Соединенных Штатах Америки он не был одобрен для использования у людей.[47]
Стимуляторы и антидепрессанты
Считается, что эти препараты опосредуются различными системами нейротрансмиттеров (дофамин за стимуляторы, серотонин за антидепрессанты ), но многие из них также повышают уровень норадреналина в головном мозге.[48] Амфетамин, например, является стимулятором, увеличивающим высвобождение норадреналина, а также дофамина.[49] Ингибиторы моноаминоксидазы являются антидепрессантами, которые ингибируют метаболическое разложение норэпинефрина, а также серотонина и дофамина.[50] В некоторых случаях трудно отличить опосредованные норэпинефрином эффекты от эффектов, связанных с другими нейротрансмиттерами.[нужна цитата ]
Заболевания и расстройства
Ряд важных медицинских проблем связан с дисфункцией норадреналиновой системы мозга или тела.
Симпатическая гиперактивация
Гиперактивация Симпатическая нервная система не является признанным состоянием само по себе, но это компонент ряда условий, а также возможное последствие принятия симпатомиметические препараты. Он вызывает характерный набор симптомов, включая боли, учащенное сердцебиение, повышенное артериальное давление, потоотделение, сердцебиение, беспокойство, головную боль, бледность и падение уровня глюкозы в крови. Если симпатическая активность повышается в течение длительного времени, это может вызвать потерю веса и другие изменения организма, связанные со стрессом.
Список состояний, которые могут вызвать гиперактивацию симпатической нервной системы, включает тяжелую травму головного мозга,[51] повреждение спинного мозга,[52] сердечная недостаточность,[53] высокое кровяное давление,[54] заболевание почек,[55] и различные виды стресса.
Феохромоцитома
А феохромоцитома редко встречающаяся опухоль мозговое вещество надпочечников, вызванные генетическими факторами или определенными видами рака. Следствием этого является резкое увеличение количества норадреналина и адреналина, попадающих в кровоток. Наиболее очевидными симптомами являются симптомы гиперактивации симпатической нервной системы, в частности, повышение артериального давления, которое может достигать фатального уровня. Наиболее эффективное лечение - хирургическое удаление опухоли.
Стресс
Стресс Для физиолога означает любую ситуацию, которая угрожает постоянной стабильности тела и его функций.[56] Стресс влияет на самые разные системы организма: две наиболее часто активируются: гипоталамо-гипофизарно-надпочечниковая система и норадреналиновая система, включая как Симпатическая нервная система и голубое пятно -центрированная система в головном мозге.[56] Стрессоры многих типов вызывают усиление норадренергической активности, которая мобилизует мозг и тело на борьбу с угрозой.[56] Хронический стресс, если он продолжается в течение длительного времени, может повредить многие части тела. Значительная часть повреждений вызвана эффектами длительного высвобождения норэпинефрина из-за общей функции норадреналина - направлять ресурсы от поддержания, регенерации и воспроизводства к системам, которые необходимы для активного движения. Последствия могут включать замедление роста (у детей), бессонницу, потерю либидо, проблемы с желудочно-кишечным трактом, снижение сопротивляемости болезням, более медленную скорость заживления травм, депрессию и повышенную уязвимость к зависимости.[56]
СДВГ
Синдром дефицита внимания и гиперактивности это психическое заболевание, сопровождающееся проблемами с вниманием, гиперактивностью и импульсивностью.[57] Чаще всего лечится с помощью стимулятор наркотики, такие как метилфенидат (Риталин), основной эффект которого заключается в увеличении дофамин уровни в мозге, но препараты этой группы также обычно повышают уровень норадреналина в мозге, и было трудно определить, влияют ли эти действия на их клиническую ценность. Есть также веские доказательства того, что многие люди с СДВГ показывают биомаркеры с изменением обработки норэпинефрина.[58] Несколько препаратов, основное действие которых связано с норадреналином, включая гуанфацин, клонидин, и атомоксетин, были опробованы в качестве лечения СДВГ, и было обнаружено, что их действие сопоставимо с действием стимуляторов.[59][60]
Вегетативная недостаточность
Несколько условий, в том числе болезнь Паркинсона, сахарный диабет и так называемые чистая вегетативная недостаточность, может вызвать потерю нейронов, секретирующих норэпинефрин, в симпатической нервной системе. Симптомы широко распространены, наиболее серьезными из которых являются снижение частоты сердечных сокращений и резкое падение артериального давления в состоянии покоя, из-за чего серьезно пострадавшие люди не могут стоять более нескольких секунд без потери сознания. Лечение может включать изменение диеты или прием лекарств.[61]
Сравнительная биология и эволюция
Сообщается, что норэпинефрин существует у самых разных видов животных, включая простейшие,[62] плакозоа и книдария (медузы и родственные им виды),[63] но не в гребневики (гребешки), нервная система которых сильно отличается от нервной системы других животных.[64] Обычно он присутствует в дейтеростомы (позвоночные и др.), но в протостомы (членистоногих, моллюсков, плоских червей, нематод, кольчатых червей и др.) он заменяется на октопамин, тесно связанное химическое вещество с тесно связанным путем синтеза.[62] У насекомых октопамин выполняет функции предупреждения и активации, которые соответствуют (по крайней мере, приблизительно) функциям норадреналина у позвоночных.[65] Утверждалось, что октопамин эволюционировал, чтобы заменить норадреналин, а не наоборот; однако нервная система амфиокс (примитивный хордовый), как сообщается, содержит октопамин, но не норэпинефрин, что представляет трудности для этой гипотезы.[62]
История
В начале двадцатого века Уолтер Кэннон, который популяризировал идею симпатоадреналовая система подготовка тела к борьба и бегство и его коллега Артуро Розенблют разработал теорию двух сочувствующие, симпатин E (возбуждающий) и сочувствующий я (тормозящий), отвечающий за эти действия.[66] Бельгийский фармаколог Зенон Бак а также канадские и американо-американские фармакологи между 1934 и 1938 годами предположили, что норадреналин может быть симпатическим передатчиком.[66] В 1939 году Герман Блашко и Питер Хольц независимо друг от друга определили биосинтетический механизм норадреналина в теле позвоночных.[67][68] В 1945 г. Ульф фон Эйлер опубликовал первую из серии статей, в которых была установлена роль норадреналина как нейромедиатора.[69] Он продемонстрировал присутствие норэпинефрина в симпатически иннервируемых тканях и головном мозге, и привел доказательства того, что это сочувствующий Кэннона и Розенблют.Стэнли Пирт был первым, кто продемонстрировал высвобождение норадреналина после стимуляции симпатических нервов.
Рекомендации
- ^ Аронсон Дж. К. (февраль 2000 г.). "'Где встречаются имя и образ »- аргумент в пользу« адреналина »'". Британский медицинский журнал. 320 (7233): 506–9. Дои:10.1136 / bmj.320.7233.506. ЧВК 1127537. PMID 10678871.
- ^ «(-) - норадреналин». База данных IUPHAR. Международный союз фундаментальной и клинической фармакологии. Получено 2 января 2016.
- ^ а б «Норэпинефрин». PubChem. Получено 6 ноября 2015.
- ^ Гаддум Дж. Х. (июнь 1956 г.). «Приставка« Нор »в химической номенклатуре». Природа. 177 (1046): 1046. Bibcode:1956Натура.177.1046G. Дои:10.1038 / 1771046b0. S2CID 4284979.
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ а б c d е ж грамм Мусаккио JM (2013). «Глава 1: Ферменты, участвующие в биосинтезе и деградации катехоламинов». В Iverson L (ред.). Биохимия биогенных аминов. Springer. С. 1–35. ISBN 978-1-4684-3171-1.
- ^ Гриффит РК (2013). «Глава 10: Адренергические рецепторы и препараты, влияющие на адренергическую нейротрансмиссию». В Lemke TL, Williams DA, Zito SW, Roche VF (ред.). Принципы медицинской химии Фуа (7-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. п. 343. ISBN 978-1-60913-345-0.
- ^ а б c d е ж грамм час я Позвонил в HP, Риттер Дж. М., Флауэр Р., Хендерсон Дж. (2014). «Глава 14: Норадренергическая передача». Фармакология Рэнга и Дейла. Elsevier Health Sciences. С. 177–196. ISBN 978-0-7020-5497-6.
- ^ а б Eiden LE, Schäfer MK, Weihe E, Schütz B (2004). «Семейство везикулярных переносчиков амина (SLC18): аминные / протонные антипортеры, необходимые для накопления везикулярных веществ и регулируемой экзоцитотической секреции моноаминов и ацетилхолина». Арка Пфлюгерса. 447 (5): 636–40. Дои:10.1007 / s00424-003-1100-5. PMID 12827358. S2CID 20764857.
- ^ Торрес Г.Е., Гайнетдинов Р.Р., Карон М.Г. (2003). «Плазматические мембранные переносчики моноаминов: структура, регуляция и функции». Обзоры природы Неврология. 4 (1): 13–25. Дои:10.1038 / nrn1008. PMID 12511858. S2CID 21545649.
- ^ а б c Хэмилл Р. У., Шапиро Р. Э., Виззард М. А. (2012). «Периферическая вегетативная нервная система». В Robertson D, Biaggioni I, et al. (ред.). Праймер на вегетативную нервную систему. Академическая пресса. С. 17–20. ISBN 978-0-12-386525-0.
- ^ а б Шактер Д., Гилберт Д., Вегнер Д., Худ Б. (2011). Психология: европейское издание. Пэлгрейв Макмиллан. п. 93. ISBN 978-0-230-34367-2.
- ^ Дартт Д.А. (май 2009 г.). «Нейронная регуляция секреторных процессов слезной железы: актуальность при заболеваниях сухого глаза». Прогресс в исследованиях сетчатки и глаз. 28 (3): 155–77. Дои:10.1016 / j.preteyeres.2009.04.003. ЧВК 3652637. PMID 19376264.
- ^ Танк А.В., Ли Вонг Д. (январь 2015 г.). «Периферические и центральные эффекты циркулирующих катехоламинов». Комплексная физиология. 5. С. 1–15. Дои:10.1002 / cphy.c140007. ISBN 9780470650714. PMID 25589262. Отсутствует или пусто
| название =(помощь) - ^ Bahler L, Molenaars RJ, Verberne HJ, Holleman F (сентябрь 2015 г.). «Роль вегетативной нервной системы в активации коричневой жировой ткани человека: обзор литературы». Диабет и метаболизм. 41 (6): 437–445. Дои:10.1016 / j.diabet.2015.08.005. PMID 26404650.
- ^ Кенни MJ, Ganta CK (июль 2014 г.). «Взаимодействие вегетативной нервной системы и иммунной системы». Комплексная физиология. 4. С. 1177–200. Дои:10.1002 / cphy.c130051. ISBN 9780470650714. ЧВК 4374437. PMID 24944034. Отсутствует или пусто
| название =(помощь) - ^ Чистяков Д.А., Эшвелл К.В., Орехов А.Н., Бобрышев Ю.В. (2015). «Иннервация артериальной стенки и ее модификация при атеросклерозе». Auton Neurosci. 193: 7–11. Дои:10.1016 / j.autneu.2015.06.005. PMID 26164815. S2CID 8150131.
- ^ а б c d е Торп А.А., Шлайх МП (2015). «Актуальность активации симпатической нервной системы при ожирении и метаболическом синдроме». J Diabetes Res. 2015: 1–11. Дои:10.1155/2015/341583. ЧВК 4430650. PMID 26064978.
- ^ Konturek SJ, Konturek JW, Павлик Т., Бжозовский Т. (2004). «Ось мозг-кишечник и ее роль в контроле за приемом пищи» (PDF). J. Physiol. Pharmacol. 55 (1 Пет 2): 137–54. PMID 15082874.
- ^ Пакдихот П., Данн В. Р., Ралевич В. (ноябрь 2007 г.). «Каннабиноиды подавляют норадренергическую и пуринергическую симпатическую котрансмиссию в изолированном брыжеечном артериальном русле крыс». Британский журнал фармакологии. 152 (5): 725–33. Дои:10.1038 / sj.bjp.0707397. ЧВК 2190027. PMID 17641668.
- ^ Дальстрём А, Фьюкс К (1964). «Доказательства существования моноаминовых нейронов в центральной нервной системе. I. Демонстрация моноаминов в телах клеток стволовых нейронов головного мозга». Acta Physiologica Scandinavica. Дополнение. 232 (Приложение 232): 1–55. PMID 14229500.
- ^ Антунес-Родригес Дж., Де Кастро М., Элиас Л.Л., Валенса М.М., Макканн С.М. (январь 2004 г.). «Нейроэндокринный контроль метаболизма жидкости в организме» (PDF). Физиологические обзоры. 84 (1): 169–208. Дои:10.1152 / физрев.00017.2003. PMID 14715914. S2CID 14046.
- ^ Ринаман Л. (февраль 2011 г.). «Норадренергические нейроны A2 заднего мозга: различные роли в вегетативных, эндокринных, когнитивных и поведенческих функциях». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 300 (2): R222–35. Дои:10.1152 / ajpregu.00556.2010. ЧВК 3043801. PMID 20962208.
- ^ Bruinstroop E, Cano G, Vanderhorst VG, Cavalcante JC, Wirth J, Sena-Esteves M, Saper CB (июнь 2012 г.). «Спинальные проекции групп норадренергических клеток А5, А6 (голубое пятно) и А7 у крыс». Журнал сравнительной неврологии. 520 (9): 1985–2001. Дои:10.1002 / cne.23024. ЧВК 3508755. PMID 22173709.
- ^ а б c Сара SJ, Буре S (2012). «Ориентация и переориентация: голубое пятно опосредует познание через возбуждение». Нейрон. 76 (1): 130–41. Дои:10.1016 / j.neuron.2012.09.011. PMID 23040811.
- ^ а б Берридж К.В., Шмейхель Б.Э., Испания, РА (2012). «Норадренергическая модуляция бодрствования / возбуждения». Sleep Med Rev. 16 (2): 187–97. Дои:10.1016 / j.smrv.2011.12.003. ЧВК 3278579. PMID 22296742.
- ^ Сара SJ (2015). «Locus Coeruleus во времени с созданием воспоминаний». Curr. Мнение. Нейробиол. 35: 87–94. Дои:10.1016 / j.conb.2015.07.004. PMID 26241632. S2CID 206952441.
- ^ Фэн Дж., Ху Х (декабрь 2019 г.). «Новый игрок на поле боя: диск Меркель на связи, зуд и боль». Экспериментальная дерматология. 28 (12): 1412–1415. Дои:10.1111 / exd.13945. ЧВК 6800577. PMID 31001848.
- ^ а б c Гарденшир Д.С. (2013). Фармакология респираторной терапии Рау. Elsevier Health Sciences. п. 88. ISBN 978-0-323-27714-3.
- ^ Родс А., Эванс Л. Е., Альхазани В., Леви М. М., Антонелли М., Феррер Р. и др. (Март 2017 г.). «Кампания по выживанию при сепсисе: Международное руководство по ведению сепсиса и септического шока: 2016 г.» (PDF). Реанимационная медицина. 45 (3): 486–552. Дои:10.1097 / CCM.0000000000002255. PMID 28098591. S2CID 52827184.
Мы рекомендуем норадреналин в качестве вазопрессора первого выбора (сильная рекомендация, среднее качество доказательств).
- ^ а б Deedwania PC (2015). «Ведение пациентов со стабильной стенокардией и диабетом 2 типа». Рев Кардиоваск Мед. 16 (2): 105–13. PMID 26198557.
- ^ Мареев Ю., Клеланд Дж. Г. (2015). «Следует ли использовать β-блокаторы пациентам с сердечной недостаточностью и мерцательной аритмией?». Clin Ther. 37 (10): 2215–24. Дои:10.1016 / j.clinthera.2015.08.017. PMID 26391145.
- ^ Кумар А., Агарвал С. (2014). «Синдром Марфана: синдром зрения». Мета-ген. 2: 96–105. Дои:10.1016 / j.mgene.2013.10.008. ЧВК 4287801. PMID 25606393.
- ^ а б Иноуэ К. (2014). «Управление побочными эффектами лекарств от глаукомы». Клин офтальмол. 8: 903–13. Дои:10.2147 / OPTH.S44708. ЧВК 4025938. PMID 24872675.
- ^ Брюгес АО (2011). «Тревога исполнения музыки - часть 2. Обзор вариантов лечения». Мед Пробл Перформанс. 26 (3): 164–71. Дои:10.21091 / МПа.2011.3026. PMID 21987072.
- ^ Fitch K (2012). «Запрещенные на Олимпийских играх препараты: разрешенное и неправильное употребление (допинг) спортсменами». Clin Med. 12 (3): 257–60. Дои:10.7861 / Clinmedicine.12-3-257. ЧВК 4953490. PMID 22783779.
- ^ а б c d Лилли Л.Л., Коллинз С.Р., Снайдер Дж.С. (2014). Фармакология и сестринский процесс (7-е изд.). Elsevier Health Sciences. С. 313–316. ISBN 978-0-323-29361-7.
- ^ Холлингсуорт Дж. М., Уилт Т. Дж. (Август 2014 г.). «Симптомы нижних мочевыводящих путей у мужчин». BMJ. 349: g4474. Дои:10.1136 / bmj.g4474. ЧВК 4688452. PMID 25125424.
- ^ Campschroer T, Zhu X, Vernooij RW, Lock MT (апрель 2018 г.). «Альфа-адреноблокаторы как лечебная экспульсивная терапия при камнях мочеточника». Кокрановская база данных систематических обзоров. 4: CD008509. Дои:10.1002 / 14651858.CD008509.pub3. ЧВК 6494465. PMID 29620795.
- ^ Зеленый B (июль 2014 г.). «Празосин в лечении посттравматического стрессового расстройства». Журнал психиатрической практики. 20 (4): 253–9. Дои:10.1097 / 01.pra.0000452561.98286.1e. PMID 25036580. S2CID 40069887.
- ^ а б c Корацца О, Мартинотти Дж., Сантакроче Р., Чиллеми Е., Ди Джаннантонио М., Скифано Ф., Целлек С. (2014). «Товары для повышения сексуальности для продажи в Интернете: повышение осведомленности о психоактивных эффектах йохимбина, мака, травы рогатого козла и гинкго билоба». Биомед Рес Инт. 2014: 1–13. Дои:10.1155/2014/841798. ЧВК 4082836. PMID 25025070.
- ^ Панель EFSA по пищевым добавкам и источникам питательных веществ, добавленных в продукты питания (2013 г.). «Научное заключение по оценке безопасности использования Йохимбе». Журнал EFSA. 11 (7): 3302. Дои:10.2903 / j.efsa.2013.3302.
- ^ а б c Лемке К.А. (2004). «Периоперационное применение селективных агонистов и антагонистов альфа-2 у мелких животных». Может. Вет. J. 45 (6): 475–80. ЧВК 548630. PMID 15283516.
- ^ Белкин MR, Шварц Т.Л. (2015). «Агонисты рецепторов альфа-2 для лечения посттравматического стрессового расстройства». Наркотики в контексте. 4: 1–5. Дои:10.7573 / dic.212286. ЧВК 4544272. PMID 26322115.
- ^ Грин С.А., Турмон Дж.С. (1988). «Ксилазин - обзор его фармакологии и использования в ветеринарии». J. Vet. Pharmacol. Ther. 11 (4): 295–313. Дои:10.1111 / j.1365-2885.1988.tb00189.x. PMID 3062194.
- ^ Софуоглу М., Сьюэлл Р.А. (апрель 2009 г.). «Зависимость от норэпинефрина и стимуляторов». Биология зависимости. 14 (2): 119–29. Дои:10.1111 / j.1369-1600.2008.00138.x. ЧВК 2657197. PMID 18811678.
- ^ Heal DJ, Smith SL, Gosden J, Nutt DJ (июнь 2013 г.). «Амфетамин, прошлое и настоящее - фармакологическая и клиническая перспектива». Журнал психофармакологии. 27 (6): 479–96. Дои:10.1177/0269881113482532. ЧВК 3666194. PMID 23539642.
- ^ Финберг Дж. П., Рабей Дж. М. (2016). «Ингибиторы МАО-А и МАО-В в психиатрии и неврологии». Границы фармакологии. 7: 340. Дои:10.3389 / fphar.2016.00340. ЧВК 5067815. PMID 27803666.
Селективное ингибирование МАО-А приводит к повышению уровня нейротрансмиттера в норадренергических (NA-ергических) и 5-HT-ергических нейронах ЦНС, а также к клиническому антидепрессивному действию, в то время как ингибирование МАО-B приводит к повышению уровня DA при паркинсонизме. мозг...
- ^ Комок Д., Мойер М. (2014). «Пароксизмальная симпатическая гиперактивность после тяжелой черепно-мозговой травмы». Curr Neurol Neurosci Rep. 14 (11): 494. Дои:10.1007 / s11910-014-0494-0. PMID 25220846. S2CID 10849388.
- ^ Амзаллаг М (1993). «Вегетативная гиперрефлексия». Int Anesthesiol Clin. 31 (1): 87–102. Дои:10.1097/00004311-199331010-00009. PMID 8440534. S2CID 32173637.
- ^ МакКринк К.А., Брилл А., Лимперопулос А. (2015). «Адреналовый G-белок-связанный рецептор киназы-2 в регуляции активности симпатической нервной системы при сердечной недостаточности». Мир Дж Кардиол. 7 (9): 539–43. Дои:10.4330 / wjc.v7.i9.539. ЧВК 4577680. PMID 26413230.
- ^ Мальпас SC (2010). «Повышенная активность симпатической нервной системы и ее роль в развитии сердечно-сосудистых заболеваний». Physiol. Rev. 90 (2): 513–57. Дои:10.1152 / Physrev.00007.2009. PMID 20393193.
- ^ Ксязек А., Залуска В. (2008). «Симпатическая гиперактивность при уремии». Джей Рен Нутр. 18 (1): 118–21. Дои:10.1053 / j.jrn.2007.10.024. PMID 18089457.
- ^ а б c d Хрусос ГП (2009). «Стресс и нарушения стрессовой системы». Нат Рев Эндокринол. 5 (7): 374–81. Дои:10.1038 / nrendo.2009.106. PMID 19488073. S2CID 2259451.
- ^ Kooij SJ, Bejerot S, et al. (2010). «Заявление европейского консенсуса по диагностике и лечению СДВГ у взрослых: Европейская сеть СДВГ взрослых». BMC Psychiatry. 10: 67. Дои:10.1186 / 1471-244X-10-67. ЧВК 2942810. PMID 20815868.
- ^ Faraone SV, Bonvicini C, Scassellati C (2014). "Biomarkers in the diagnosis of ADHD--promising directions". Curr Psychiatry Rep. 16 (11): 497. Дои:10.1007/s11920-014-0497-1. PMID 25298126. S2CID 36702503.
- ^ Bello NT (2015). "Clinical utility of guanfacine extended release in the treatment of ADHD in children and adolescents". Patient Prefer Adherence. 9: 877–85. Дои:10.2147/PPA.S73167. ЧВК 4494608. PMID 26170637.
- ^ Clemow DB, Bushe CJ (2015). "Atomoxetine in patients with ADHD: A clinical and pharmacological review of the onset, trajectory, duration of response and implications for patients". J. Psychopharmacol. (Оксфорд). 29 (12): 1221–30. Дои:10.1177/0269881115602489. PMID 26349559. S2CID 22649093.
- ^ Shibao C, Okamoto L, Biaggioni I (2012). "Pharmacotherapy of autonomic failure". Pharmacol. Ther. 134 (3): 279–86. Дои:10.1016/j.pharmthera.2011.05.009. ЧВК 3358114. PMID 21664375.
- ^ а б c Pflüger HJ, Stevensonb PA (2005). "Evolutionary aspects of octopaminergic systems with emphasis on arthropods". Строение и развитие членистоногих. 34 (3): 379–396. Дои:10.1016/j.asd.2005.04.004.
- ^ Kass-Simon G, Pierobon P (2007). "Cnidarian chemical neurotransmission, an updated overview". Комп. Biochem. Physiol., Part a Mol. Интегр. Физиол. 146 (1): 9–25. Дои:10.1016/j.cbpa.2006.09.008. PMID 17101286.
- ^ Moroz LL (2015). "Convergent evolution of neural systems in ctenophores". J. Exp. Биол. 218 (Pt 4): 598–611. Дои:10.1242/jeb.110692. ЧВК 4334147. PMID 25696823.
- ^ Verlinden H, Vleugels R, Marchal E, Badisco L, Pflüger HJ, Blenau W, Broeck JV (2010). "The role of octopamine in locusts and other arthropods". J. Insect Physiol. 56 (8): 854–67. Дои:10.1016/j.jinsphys.2010.05.018. PMID 20621695.
- ^ а б Bacq ZM (1983). "Chemical transmission of nerve impulses". In Parnham MJ, Bruinvels J (eds.). Discoveries in Pharmacology, Volume 1. Амстердам: Эльзевир. pp. 49–103. ISBN 978-0-444-80493-8.
- ^ Herman Blaschko (1987). "A half-century of research on catecholamine biosynthesis". Journal of Applied Cardiology: 171–183.
- ^ P. Holtz (1939). "Dopadecarboxylase". Die Naturwissenschaften (на немецком). 27 (43): 724–725. Bibcode:1939NW.....27..724H. Дои:10.1007/bf01494245.
- ^ von Euler US (1945). "A sympathomimetic pressor substance in animal organ extracts". Природа. 156 (3949): 18–19. Bibcode:1945Natur.156...18V. Дои:10.1038/156018b0. S2CID 4100718.