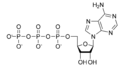
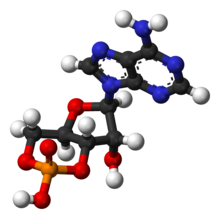
Циклический аденозинмонофосфат - Википедия - Cyclic adenosine monophosphate
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.448 |
| КЕГГ | |
| MeSH | Циклический + AMP |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C10ЧАС11N5О6п | |
| Молярная масса | 329,206 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Циклический аденозинмонофосфат (лагерь, циклический AMP, или же 3 ', 5'-циклический аденозинмонофосфат) это второй посланник важен во многих биологических процессах. цАМФ является производным от аденозинтрифосфат (АТФ) и используется для внутриклеточного преобразование сигнала во многих различных организмах, передавая цАМФ-зависимый путь. Не следует путать с 5'-АМФ-активированная протеинкиназа (АМФ-активированная протеинкиназа ).
История
Эрл Сазерленд из Университет Вандербильта Выиграл Нобелевская премия по физиологии и медицине в 1971 г. «за открытия, касающиеся механизмов действия гормонов», особенно адреналина, через вторые мессенджеры (например, циклический аденозинмонофосфат, циклический АМФ).
Синтез
Циклический AMP синтезируется из АТФ к аденилатциклаза расположен на внутренней стороне плазматической мембраны и закреплен в различных местах внутри клетки.[1] Аденилатциклаза - это активирован посредством ряда сигнальных молекул посредством активации аденилатциклазы, стимулирующей G (граммs ) -белковые рецепторы. Аденилатциклаза - это подавленный агонистами аденилатциклазы, ингибирующими G (Gя) -белковые рецепторы. Аденилатциклаза печени сильнее реагирует на глюкагон, а мышечная аденилатциклаза сильнее реагирует на адреналин.
разложение цАМФ на AMP катализируется ферментом фосфодиэстераза.
Функции
цАМФ - это второй посланник, используемый для передачи внутриклеточного сигнала, например передача в клетки влияние гормоны подобно глюкагон и адреналин, который не может проходить через плазматическую мембрану. Он также участвует в активации протеинкиназы. Кроме того, цАМФ связывается с и регулирует функцию ионные каналы такой как Каналы HCN и еще несколько циклические нуклеотид-связывающие белки Такие как Epac1 и RAPGEF2.
Роль в эукариотических клетках
цАМФ связан с функцией киназ в нескольких биохимических процессах, включая регуляцию гликоген, сахар, и липид метаболизм.[2]
У эукариот циклический АМФ работает путем активации протеинкиназы А (PKA или цАМФ-зависимая протеинкиназа ). ПКА обычно неактивен как тетрамерный холоэнзим, состоящий из двух каталитический и две регулирующие единицы (C2р2), причем регуляторные единицы блокируют каталитические центры каталитических единиц.
Циклический АМФ связывается с определенными участками регуляторных единиц протеинкиназы и вызывает диссоциацию между регуляторными и каталитическими субъединицами, тем самым позволяя этим каталитическим единицам функционировать. фосфорилат субстратные белки.
Активные субъединицы катализируют перенос фосфата от АТФ к специфическим сериновым или треониновым остаткам белковых субстратов. Фосфорилированные белки могут действовать непосредственно на ионные каналы клетки или могут становиться активированными или ингибируемыми ферментами. Протеинкиназа А также может фосфорилировать определенные белки, которые связываются с промоторными участками ДНК, вызывая увеличение транскрипции. Не все протеинкиназы реагируют на цАМФ. Несколько классов протеинкиназы, включая протеинкиназу C, не зависят от цАМФ.
Дальнейшие эффекты в основном зависят от цАМФ-зависимая протеинкиназа, которые различаются в зависимости от типа ячейки.
Тем не менее, существуют некоторые незначительные PKA-независимые функции цАМФ, например, активация кальциевые каналы, обеспечивая второстепенный путь, по которому гормон высвобождения гормона роста вызывает выпуск гормон роста.[3]
Однако мнение о том, что большинство эффектов цАМФ контролируется PKA, является устаревшим. В 1998 году семейство цАМФ-чувствительных белков с фактор обмена гуаниновых нуклеотидов (ГЭФ) активность была обнаружена. Их называют белками обмена, активируемыми цАМФ (Epac), и семейство включает Epac1 и Epac2.[4] Механизм активации аналогичен механизму PKA: домен GEF обычно маскируется N-концевой областью, содержащей домен связывания цАМФ. Когда цАМФ связывается, домен диссоциирует и обнажает теперь активный домен GEF, позволяя Epac активировать небольшие Ras-подобные белки GTPase, такие как Рэп1.
Дополнительная роль секретируемого цАМФ в социальных амебах
В виде Dictyostelium discoideum цАМФ действует вне клетки как секретируемый сигнал. В хемотаксический агрегация клеток организована периодическими волнами цАМФ, которые распространяются между клетками на расстояния до нескольких сантиметров. Волны являются результатом регулируемого производства и секреции внеклеточного цАМФ и спонтанного биологического осциллятора, который инициирует волны в центрах территорий.[нужна цитата ]
Роль в бактериях
В бактерии уровень цАМФ варьируется в зависимости от среды, используемой для роста. В частности, цАМФ низкий, когда источником углерода является глюкоза. Это происходит за счет ингибирования фермента, продуцирующего цАМФ, аденилатциклаза, как побочный эффект транспорта глюкозы в клетку. Фактор транскрипции белок рецептора цАМФ (CRP) также называется CAP (протеин-активатор гена катаболита) образует комплекс с цАМФ и тем самым активируется для связывания с ДНК. CRP-cAMP увеличивает экспрессию большого количества генов, включая некоторые кодирующие ферменты которые могут поставлять энергию независимо от глюкозы.
цАМФ, например, участвует в положительной регуляции лак оперон. В среде с низкой концентрацией глюкозы цАМФ накапливается и связывается с аллостерическим сайтом на CRP (белок рецептора цАМФ ), белок-активатор транскрипции. Белок принимает свою активную форму и связывается со специфическим сайтом перед промотором lac, облегчая связывание РНК-полимеразы с соседним промотором, чтобы начать транскрипцию оперона lac, увеличивая скорость транскрипции оперона lac. При высокой концентрации глюкозы концентрация цАМФ снижается, и CRP отключается от lac-оперона.
Патология
Поскольку циклический AMP является вторым мессенджером и играет жизненно важную роль в передаче сигналов в клетке, он участвует в различных нарушениях, но не ограничивается функциями, указанными ниже:
Роль в развитии карциномы человека
Некоторые исследования показали, что нарушение регуляции путей цАМФ и аберрантная активация генов, контролируемых цАМФ, связаны с ростом некоторых видов рака.[5][6][7]
Роль в нарушениях префронтальной коры
Недавние исследования показывают, что цАМФ влияет на функцию мышления высшего порядка в префронтальная кора через его регулирование ионных каналов, называемых активируемые гиперполяризацией циклические нуклеотидно-управляемые каналы (HCN). Когда цАМФ стимулирует HCN, каналы открываются, закрывая клетку мозга для связи и, таким образом, нарушая функцию префронтальная кора. Это исследование, особенно когнитивный дефицит при возрастных заболеваниях и СДВГ, представляет интерес для исследователей, изучающих мозг.[8]
Смотрите также
- Циклический гуанозинмонофосфат (cGMP)
- 8-бромаденозин 3 ', 5'-циклический монофосфат (8-Br-цАМФ)
- Акразин специфические для хемотаксического использования в Dictyostelium discoideum.
- фосфодиэстераза 4 (PDE 4), который разлагает цАМФ
Рекомендации
- ^ Рахман Н., Бак Дж., Левин Л. Р. (ноябрь 2013 г.). «Определение pH с помощью регулируемой бикарбонатом« растворимой »аденилатциклазы (sAC)». Front Physiol. 4: 343. Дои:10.3389 / fphys.2013.00343. ЧВК 3838963. PMID 24324443.
- ^ Али Е.С., Хуа Дж., Уилсон СН, Таллис Г.А., Чжоу Ф.Х., Рычков Г.Ю., Барритт Г.Дж. (2016). «Аналог глюкагоноподобного пептида-1 эксендин-4 обращает нарушенную внутриклеточную передачу сигналов Ca2 + в стеатотических гепатоцитах». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1863 (9): 2135–46. Дои:10.1016 / j.bbamcr.2016.05.006. PMID 27178543.
- ^ GeneGlobe -> Сигнализация GHRH[постоянная мертвая ссылка ] Проверено 31 мая, 2009 г.
- ^ Бос, Йоханнес Л. (декабрь 2006 г.). «Белки Epac: многоцелевые мишени цАМФ». Тенденции в биохимических науках. 31 (12): 680–686. Дои:10.1016 / j.tibs.2006.10.002. PMID 17084085.
- ^ Американская ассоциация исследований рака (цАМФ-чувствительные гены и прогрессирование опухоли)
- ^ Американская ассоциация исследований рака (нарушение регуляции цАМФ и мелонома)
- ^ Американская ассоциация исследований рака (присутствие цАМФ-связывающих белков в опухолях)
- ^ ScienceDaily :: Мозговые сети укреплены за счет закрытия ионных каналов, исследования могут привести к лечению СДВГ
Дополнительные изображения
цАМФ представлен тремя способами