Нейротрансмиттер - Neurotransmitter
| Структура типового химический синапс |
|---|
Нейротрансмиттеры химические посланники, которые передают сообщение от нервная клетка через синапс в целевую ячейку. Мишенью может быть другая нервная клетка или мышечная клетка, или клетка железы. Они есть химикаты сделано нервной клеткой специально для передать сообщение.[1]
Нейротрансмиттеры высвобождаются из синаптические везикулы в синапсах в синаптическая щель, где их получает рецепторы нейротрансмиттеров на целевой ячейке. Многие нейротрансмиттеры синтезируются из простых и многочисленных прекурсоров, таких как аминокислоты, которые легко доступны и требуют лишь небольшого количества биосинтетический шаги для преобразования. Нейротрансмиттеры необходимы для функционирования сложных нервных систем. Точное количество уникальных нейромедиаторов в организме человека неизвестно, но идентифицировано более 200.[2][3][4]
Механизм
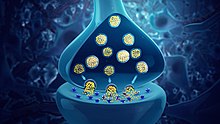
Нейротрансмиттеры хранятся в синаптические везикулы, сгруппированные близко к клеточная мембрана на аксонный терминал пресинаптического нейрона. Нейротрансмиттеры высвобождаются и распространяются через синаптическая щель, где они привязаны к конкретным рецепторы на мембране постсинаптического нейрона.[5] Связывание нейромедиаторов может влиять на постсинаптический нейрон в любом возбуждение или же тормозящий путь, деполяризующий или же переполяризация это соответственно.
Большинство нейротрансмиттеров размером с одну аминокислоту; однако некоторые нейротрансмиттеры могут быть размером с более крупные белки или пептиды. Высвобожденный нейротрансмиттер обычно доступен в синаптической щели в течение короткого времени, прежде чем он метаболизируется ферментами и возвращается в пресинаптический нейрон через обратный захват, или привязанный к постсинаптический рецептор. Тем не менее, кратковременного воздействия на рецептор нейромедиатора обычно достаточно для того, чтобы вызвать постсинаптический ответ в виде синаптическая передача.
Обычно нейротрансмиттер высвобождается на пресинаптическом окончании в ответ на пороговое значение. потенциал действия или же градуированный электрический потенциал в пресинаптическом нейроне. Однако «исходное» высвобождение низкого уровня также происходит без электростимуляции.
Открытие
До начала 20 века ученые предполагали, что большая часть синаптических коммуникаций в головном мозге является электрической. Однако через гистологический экзамены Рамон-и-Кахаль, промежуток от 20 до 40 нм между нейронами, известный сегодня как синаптическая щель, был открыт. Наличие такого разрыва предполагало связь через химические посланники, пересекающие синаптическую щель, и в 1921 году немецкий фармаколог Отто Леви подтвердили, что нейроны могут общаться, выделяя химические вещества. Посредством серии экспериментов с участием блуждающих нервов лягушек Лоуи смог вручную замедлить сердцебиение лягушек, контролируя количество физиологического раствора, присутствующего вокруг блуждающего нерва. По завершении этого эксперимента Леви утверждал, что симпатическая регуляция сердечной функции может быть опосредована изменениями в химических концентрациях. Кроме того, Отто Леви приписывают открытие ацетилхолин (ACh) - первый известный нейротрансмиттер.[6]
Идентификация
Существует четыре основных критерия определения нейромедиаторов:
- Химическое вещество должно быть синтезировано в нейроне или иным образом в нем присутствовать.
- Когда нейрон активен, химическое вещество должно выделяться и вызывать реакцию у некоторых мишеней.
- Такой же ответ должен быть получен, когда химическое вещество экспериментально помещается на мишень.
- Должен существовать механизм для удаления химического вещества с места его активации после того, как его работа будет завершена.
Однако с учетом достижений фармакологии, генетики и химии нейроанатомия, термин «нейромедиатор» может применяться к химическим веществам, которые:
- Передают сообщения между нейронами посредством воздействия на постсинаптическую мембрану.
- Имеют незначительное влияние или не влияют на напряжение мембраны, но имеют общую несущую функцию, такую как изменение структуры синапса.
- Общайтесь, отправляя сообщения в обратном направлении, которые влияют на освобождение или повторный захват передатчиков.
Анатомическая локализация нейротрансмиттеров обычно определяется с помощью иммуноцитохимических методов, которые определяют местоположение либо самих медиаторных веществ, либо ферментов, участвующих в их синтезе. Иммуноцитохимические методы также показали, что многие передатчики, особенно нейропептиды, совместно локализованы, то есть нейрон может высвобождать более одного передатчика со своего синаптического конца.[7] Различные методы и эксперименты, такие как окрашивание, стимуляция и сбор, могут использоваться для идентификации нейротрансмиттеров по всему телу. Центральная нервная система.[8]
Типы
Есть много разных способов классификации нейротрансмиттеров. Разделив их на аминокислоты, пептиды, и моноамины достаточно для некоторых целей классификации.[9]
Основные нейротрансмиттеры:
- Аминокислоты: глутамат,[10] аспартат, D-серин, гамма-аминомасляная кислота (ГАМК),[nb 1] глицин
- Газотрансмиттеры: оксид азота (НЕТ), монооксид углерода (CO), сероводород (ЧАС2S)
- Моноамины: дофамин (DA), норэпинефрин (норадреналин; NE, NA), адреналин (адреналин), гистамин, серотонин (SER, 5-HT)
- Следы аминов: фенэтиламин, N-метилфенэтиламин, тирамин, 3-йодтиронамин, октопамин, триптамин, так далее.
- Пептиды: окситоцин, соматостатин, вещество P, транскрипт, регулируемый кокаином и амфетамином, опиоидные пептиды[11]
- Пурины: аденозинтрифосфат (АТФ), аденозин
- Катехоламины: дофамин, норэпинефрин (норадреналин), адреналин (адреналин)
- Другие: ацетилхолин (АЧ), анандамид, так далее.
Кроме того, более 50 нейроактивных пептиды были обнаружены, и регулярно открываются новые.[нужна цитата ] Многие из них выпускаются совместно с низкомолекулярным трансмиттером. Тем не менее, в некоторых случаях пептид является первичным передатчиком в синапсе. Бета-эндорфин является относительно известным примером пептидного нейромедиатора, поскольку он вступает в высокоспецифические взаимодействия с опиоидные рецепторы в Центральная нервная система.
Одинокий ионы (например, синаптически выпущенный цинк ) также считаются нейротрансмиттерами некоторыми,[12] а также некоторые газообразные молекулы, такие как оксид азота (НЕТ), монооксид углерода (CO), и сероводород (ЧАС2S).[13] Газы производятся в нервной цитоплазме и немедленно диффундируют через клеточную мембрану во внеклеточную жидкость и в соседние клетки, чтобы стимулировать производство вторичных мессенджеров. Нейромедиаторы растворимых газов трудно изучать, поскольку они действуют быстро и сразу же разрушаются, существуя всего несколько секунд.
Наиболее распространенным передатчиком является глутамат, который возбуждает более 90% синапсов человеческого мозга.[10] Следующей по распространенности является гамма-аминомасляная кислота, или ГАМК, которая ингибирует более 90% синапсов, не использующих глутамат. Хотя другие передатчики используются в меньшем количестве синапсов, они могут иметь очень важное функциональное значение: подавляющее большинство психоактивных препаратов проявляют свое действие, изменяя действие некоторых систем нейротрансмиттеров, часто действуя через передатчики, отличные от глутамата или ГАМК. Наркотики, вызывающие привыкание, такие как кокаин и амфетамины, оказывают свое действие в первую очередь на дофаминовую систему. Захватывающий опиум лекарственные препараты проявляют свое действие в первую очередь как функциональные аналоги опиоидные пептиды, которые, в свою очередь, регулируют уровень дофамина.
Список нейротрансмиттеров, пептидов и газообразных сигнальных молекул
Действия
Нейроны образуют сложные сети, через которые нервные импульсы:потенциалы действия -путешествовать. Каждый нейрон имеет до 15 000 связей с соседними нейронами.
Нейроны не соприкасаются друг с другом (за исключением случая электрического синапса через щелевой переход); вместо этого нейроны взаимодействуют в точках контакта, называемых синапсами: соединение внутри двух нервных клеток, состоящее из миниатюрной щели, внутри которой импульсы переносятся нейротрансмиттером. Нейрон передает свою информацию посредством нервного импульса, называемого потенциалом действия. Когда потенциал действия достигает пресинаптической терминальной кнопки синапса, он может стимулировать высвобождение нейромедиаторов. Эти нейротрансмиттеры высвобождаются в синаптическую щель, чтобы связываться с рецепторами постсинаптической мембраны и влиять на другую клетку либо ингибирующим, либо возбуждающим образом. Следующий нейрон может быть связан со многими другими нейронами, и если общая сумма возбуждающих воздействий минус тормозные воздействия достаточно велика, он также будет «срабатывать». Другими словами, он создаст новый потенциал действия на холме своего аксона, высвобождая нейротрансмиттеры и передавая информацию еще одному соседнему нейрону.
Возбуждающий и тормозящий
Нейромедиатор может влиять на функцию нейрона посредством значительного количества механизмов. В его прямом воздействии на нейрон электрическая возбудимость однако нейротрансмиттер действует только одним из двух способов: возбуждающим или тормозящим. Нейротрансмиттер влияет на трансмембранный ионный поток, увеличивая (возбуждая) или уменьшая (подавляя) вероятность того, что клетка, с которой он вступает в контакт, будет производить потенциал действия. Таким образом, несмотря на большое разнообразие синапсов, все они передают сообщения только этих двух типов, и они обозначены как таковые. Синапсы типа I возбуждающий в своих действиях, тогда как синапсы типа II тормозящий. Каждый тип имеет различный внешний вид и располагается в разных частях нейронов, находящихся под его влиянием.
Синапсы типа I (возбуждающие) обычно расположены на стержнях или шипах дендритов, тогда как синапсы типа II (тормозящие) обычно расположены на теле клетки. Кроме того, синапсы типа I имеют круглые синаптические пузырьки, тогда как пузырьки синапсов типа II уплощены. Материал на пресинаптических и постсинаптических мембранах более плотный в синапсе I типа, чем в синапсе II типа, а синаптическая щель I типа шире. Наконец, активная зона в синапсе I типа больше, чем в синапсе II типа.
Различное расположение синапсов типа I и типа II делит нейрон на две зоны: дендритное дерево возбуждения и тело тормозящей клетки. С тормозящей точки зрения возбуждение проникает через дендриты и распространяется на аксональный бугорок вызвать потенциал действия. Если сообщение должно быть остановлено, лучше всего остановить его, применив ингибирование к телу клетки, близко к бугорку аксона, где возникает потенциал действия. Другой способ концептуализировать возбуждающе-тормозное взаимодействие - представить себе возбуждение, преодолевающее торможение. Если тело клетки обычно находится в подавленном состоянии, единственный способ создать потенциал действия на бугорке аксона - это уменьшить подавление тела клетки. В этой стратегии «откройте ворота» возбуждающее сообщение похоже на скаковую лошадь, готовую бежать по трассе, но сначала нужно удалить препятствующие стартовые ворота.[17]
Примеры важных действий нейротрансмиттеров
Как объяснялось выше, единственное прямое действие нейротрансмиттера - активация рецептора. Следовательно, эффекты системы нейротрансмиттеров зависят от соединений нейронов, которые используют передатчик, и химических свойств рецепторов, с которыми передатчик связывается.
Вот несколько примеров важных действий нейротрансмиттеров:
- Глутамат используется в подавляющем большинстве быстрых возбуждающих синапсов головного и спинного мозга. Он также используется в большинстве синапсов, которые являются «модифицируемыми», то есть способными увеличиваться или уменьшаться в силе. Модифицируемые синапсы считаются основными элементами памяти в мозгу. Чрезмерное высвобождение глутамата может чрезмерно стимулировать мозг и приводить к эксайтотоксичность вызывая гибель клеток, приводящую к судорогам или инсультам.[18] Эксайтотоксичность связана с некоторыми хроническими заболеваниями, включая ишемический приступ, эпилепсия, боковой амиотрофический склероз, Болезнь Альцгеймера, Болезнь Хантингтона, и болезнь Паркинсона.[19]
- ГАМК используется в подавляющем большинстве быстрых тормозных синапсов практически в каждой части мозга. Много седативные / транквилизирующие препараты действуют, усиливая эффекты ГАМК.[20] Соответственно, глицин тормозящий передатчик в спинной мозг.
- Ацетилхолин был первым нейротрансмиттером, обнаруженным в периферической и центральной нервной системах. Он активирует скелетные мышцы соматической нервной системы и может возбуждать или подавлять внутренние органы вегетативной системы.[8] Он отличается как передатчик на нервномышечное соединение соединение двигательных нервов с мышцами. Паралитическая стрела-яд кураре действует, блокируя передачу в этих синапсах. Ацетилхолин также действует во многих областях мозга, но с помощью разные типы рецепторов, включая никотиновый и мускариновый рецепторы.[21]
- Дофамин выполняет ряд важных функций в головном мозге; это включает регуляцию моторного поведения, удовольствия, связанные с мотивацией, а также эмоциональное возбуждение. Он играет важную роль в система вознаграждений; болезнь Паркинсона был связан с низким уровнем дофамина и шизофрения был связан с высоким уровнем дофамина.[22]
- Серотонин это моноаминный нейромедиатор. Большая часть вырабатывается и обнаруживается в кишечнике (примерно 90%), а остальная часть - в кишечнике. Центральная нервная система нейроны. Он регулирует аппетит, сон, память и обучение, температуру, настроение, поведение, сокращение мышц и функцию сердечно-сосудистая система и эндокринная система. Предполагается, что он играет роль в депрессии, поскольку у некоторых пациентов с депрессией наблюдаются более низкие концентрации метаболитов серотонина в их организме. спинномозговая жидкость и ткани мозга.[23]
- Норэпинефрин который синтезируется в центральной нервной системе и симпатических нервах, модулирует реакции вегетативной нервной системы, режим сна, концентрацию внимания и бдительность. Он синтезируется из тирозин.
- Адреналин который также синтезируется из тирозина, выделяется в надпочечниках и стволе мозга. Он играет роль во сне, в способности человека сохранять бдительность и борьба или бегство.
- Гистамин работает с центральной нервной системой (ЦНС), особенно с гипоталамусом (туберомаммиллярное ядро ) и ЦНС тучные клетки.
Системы нейротрансмиттеров головного мозга
Нейроны, экспрессирующие определенные типы нейротрансмиттеров, иногда образуют отдельные системы, активация которых затрагивает большие объемы мозга, называемые объемная передача. Основные системы нейротрансмиттеров включают норадреналин (норэпинефриновая) система, дофамин система, серотонин система, а холинергический система, среди прочего. Следы аминов оказывают модулирующее действие на нейротрансмиссию в моноамин пути (то есть пути дофамина, норадреналина и серотонина) по всему мозгу посредством передачи сигналов через следовой амин-ассоциированный рецептор 1.[24][25] Ниже приводится краткое сравнение этих систем:
| Система | Происхождение и проекции пути | Регулируемые когнитивные процессы и поведение |
|---|---|---|
| Норадреналиновая система [26][27][28][29][30][31] | Норадренергические пути:
|
|
| Дофаминовая система [28][29][30][32][33][34] | Дофаминергические пути:
|
|
| Гистаминовая система [29][30][35] | Гистаминергические пути:
|
|
| Серотониновая система [26][28][29][30][36][37][38] | Серотонинергические пути: Каудальные ядра (CN):
Ростральные ядра (RN):
|
|
| Ацетилхолиновая система [26][28][29][30][39] | Холинергические пути: Холинергические ядра переднего мозга (FCN):
Холинергические ядра ствола мозга (BCN):
|
|
Эффекты лекарств
Понимание воздействия лекарств на нейротрансмиттеры составляет значительную часть исследовательских инициатив в области нейробиология. Большинство нейробиологов, занимающихся этой областью исследований, считают, что такие усилия могут способствовать дальнейшему углублению нашего понимания цепей, ответственных за различные неврологические заболевания и расстройства, а также способов эффективного лечения, а когда-нибудь, возможно, предотвращения или лечения таких заболеваний.[40][требуется медицинская цитата ]
Наркотики могут влиять на поведение, изменяя активность нейромедиатора. Например, лекарства могут снижать скорость синтеза нейромедиаторов, воздействуя на синтетический фермент (ы) этого нейротрансмиттера. Когда синтез нейротрансмиттеров блокируется, количество нейротрансмиттеров, доступных для высвобождения, становится значительно ниже, что приводит к снижению активности нейромедиатора. Некоторые препараты блокируют или стимулируют высвобождение определенных нейротрансмиттеров. В качестве альтернативы лекарства могут предотвратить накопление нейротрансмиттеров в синаптических везикулах, вызывая утечку мембран синаптических везикул. Лекарства, препятствующие связыванию нейромедиатора с его рецептором, называются антагонисты рецепторов. Например, препараты, используемые для лечения пациентов с шизофренией, такие как галоперидол, хлорпромазин и клозапин, являются антагонистами рецепторов дофамина в головном мозге. Другие препараты действуют путем связывания с рецептором и имитируют нормальный нейромедиатор. Такие препараты называют рецепторными. агонисты. Примером агониста рецептора является морфий, опиат, имитирующий действие эндогенного нейромедиатора β-эндорфин чтобы облегчить боль. Другие препараты препятствуют деактивации нейромедиатора после его высвобождения, тем самым продлевая действие нейромедиатора. Это может быть достигнуто путем блокирования повторного захвата или ингибирования ферментов деградации. Наконец, лекарственные препараты также могут предотвращать возникновение потенциала действия, блокируя нейрональную активность в центральных и периферических отделах. нервная система. Такие лекарства, как тетродотоксин, блокирующие нервную активность, обычно смертельны.
Лекарства, нацеленные на нейротрансмиттер основных систем, влияют на всю систему, что может объяснить сложность действия некоторых лекарств. Кокаин, например, блокирует повторный прием дофамин обратно в пресинаптический нейрон, оставляя молекулы нейротрансмиттера в синаптическая щель в течение длительного периода времени. Поскольку дофамин дольше остается в синапсе, нейромедиатор продолжает связываться с рецепторами на постсинаптический нейрон, вызывающий приятную эмоциональную реакцию. Физическая зависимость от кокаина может быть результатом длительного воздействия избытка дофамина в синапсах, что приводит к подавление некоторых постсинаптических рецепторов. После того, как действие препарата прекратится, человек может впасть в депрессию из-за снижения вероятности связывания нейромедиатора с рецептором. Флуоксетин представляет собой селективный ингибитор обратного захвата серотонина (СИОЗС), который блокирует повторный захват серотонина пресинаптической клеткой, что увеличивает количество серотонина, присутствующего в синапсе, и, кроме того, позволяет ему оставаться там дольше, обеспечивая потенциал для эффекта естественного высвобождения серотонин.[41] AMPT предотвращает превращение тирозина в L-ДОПА, предшественник дофамина; Резерпин предотвращает накопление дофамина в пузырьки; и депренил подавляет моноаминоксидаза (MAO) -B и, таким образом, увеличивает уровень дофамина.
| Препарат, средство, медикамент | Взаимодействует с: | Рецепторное взаимодействие: | Тип | Последствия |
|---|---|---|---|---|
| Ботулинический токсин (Ботокс) | Ацетилхолин | – | Антагонист | Блокирует выброс ацетилхолина в ПНС Предотвращает сокращение мышц |
| Яд паука черной вдовы | Ацетилхолин | – | Агонист | Способствует высвобождению ацетилхолина в ПНС Стимулирует сокращение мышц |
| Неостигмин | Ацетилхолин | – | – | Нарушает активность ацетилхолинеразы Увеличивает эффекты АХ на рецепторы Используется для лечения миастении. |
| Никотин | Ацетилхолин | Никотиновый (скелетные мышцы) | Агонист | Повышает активность АХ Повышает внимание Усиливающие эффекты |
| d-тубокурарин | Ацетилхолин | Никотиновый (скелетные мышцы) | Антагонист | Снижает активность рецептора |
| Кураре | Ацетилхолин | Никотиновый (скелетные мышцы) | Антагонист | Снижает активность АХ Предотвращает сокращение мышц |
| Мускарин | Ацетилхолин | Мускариновый (сердце и гладкие мышцы) | Агонист | Повышает активность АХ Токсичный |
| Атропин | Ацетилхолин | Мускариновый (сердце и гладкие мышцы) | Антагонист | Блокирует сужение зрачка Блокирует выработку слюны |
| Скополамин (Гиосцин ) | Ацетилхолин | Мускариновый (сердце и гладкие мышцы) | Антагонист | Лечит укачивание, послеоперационную тошноту и рвоту. |
| AMPT | Допамин / норэпинефрин | – | – | Инактивирует тирозингидроксилазу и подавляет выработку дофамина. |
| Резерпин | Дофамин | – | – | Предотвращает накопление дофамина и других моноаминов в синаптических везикулах Вызывает седативный эффект и депрессию |
| Апоморфин | Дофамин | D2 рецептор (пресинаптические ауторецепторы / постсинаптические рецепторы) | Антагонист (низкая доза) / прямой агонист (высокая доза) | Низкая доза: блокирует ауторецепторы Высокая доза: стимулирует постсинаптические рецепторы. |
| Амфетамин | Допамин / норэпинефрин | – | Косвенный агонист | Высвобождает дофамин, норадреналин и серотонин. |
| Метамфетамин | Допамин / норэпинефрин | – | – | Высвобождает дофамин и норадреналин Блокирует обратный захват |
| Метилфенидат | Дофамин | – | – | Блокирует обратный захват Повышает внимание и контроль над импульсами при СДВГ |
| Кокаин | Дофамин | – | Косвенный агонист | Блокирует обратный захват в пресинапс Блокирует зависимые от напряжения натриевые каналы Может использоваться как местное обезболивающее (глазные капли) |
| Депренил | Дофамин | – | Агонист | Подавляет МАО-В Предотвращает разрушение дофамина |
| Хлорпромазин | Дофамин | Рецепторы D2 | Антагонист | Блокирует рецепторы D2 Снимает галлюцинации |
| MPTP | Дофамин | – | – | Приводит к симптомам, подобным болезни Паркинсона |
| PCPA | Серотонин (5-HT) | – | Антагонист | Нарушает синтез серотонина, блокируя активность триптофангидроксилаза |
| Ондансетрон | Серотонин (5-HT) | 5-HT3 рецепторы | Антагонист | Уменьшает побочные эффекты химиотерапии и облучения Уменьшает тошноту и рвоту |
| Буспирон | Серотонин (5-HT) | 5-HT1А рецепторы | Частичный агонист | Лечит симптомы тревоги и депрессии |
| Флуоксетин | Серотонин (5-HT) | поддерживает 5-HT обратный захват | СИОЗС | Подавляет обратный захват серотонина Лечит депрессию, некоторые тревожные расстройства и ОКР[41] Общие примеры: Прозак и Сарафем. |
| Фенфлурамин | Серотонин (5-HT) | – | – | Вызывает выброс серотонина Подавляет обратный захват серотонина Используется как подавитель аппетита |
| Диэтиламид лизергиновой кислоты | Серотонин (5-HT) | Постсинаптический 5-HT2А рецепторы | Прямой агонист | Вызывает искажения зрительного восприятия Стимулирует 5-HT2А рецепторы в переднем мозге |
| Метилендиоксиметамфетамин (МДМА ) | Серотонин (5-HT) / норэпинфрин | – | – | Стимулирует высвобождение серотонина и норэпинефрина и препятствует обратному захвату Вызывает возбуждающее и галлюциногенное действие. |
| Стрихнин | Глицин | – | Антагонист | Вызывает сильные мышечные спазмы[43] |
| Дифенгидрамин | Гистамин | Пересекает гематоэнцефалический барьер, вызывая сонливость | ||
| Тетрагидроканнабинол (THC) | Эндоканнабиноиды | Каннабиноидные (CB) рецепторы | Агонист | Обладает обезболивающим и седативным действием Повышает аппетит Когнитивные эффекты |
| Римонабант | Эндоканнабиноиды | Каннабиноидные (CB) рецепторы | Антагонист | Подавляет аппетит Используется для отказа от курения |
| MAFP | Эндоканнабиноиды | – | – | Подавляет FAAH Используется в исследованиях для повышения активности каннабиноидной системы |
| AM1172 | Эндоканнабиноиды | – | – | Блокирует обратный захват каннабиноидов Используется в исследованиях для повышения активности каннабиноидной системы |
| Анандамид (эндогенный) | – | Каннабиноидные (CB) рецепторы; 5-HT3 рецепторы | – | Уменьшить тошноту и рвоту |
| Кофеин | Аденозин | Аденозиновые рецепторы | Антагонист | Блокирует аденозиновые рецепторы Повышает бодрствование |
| PCP | Глутамат | Рецептор NMDA | Косвенный антагонист | Блокирует сайт связывания PCP Предотвращает попадание ионов кальция в нейроны Ухудшает обучение |
| AP5 | Глутамат | Рецептор NMDA | Антагонист | Блокирует сайт связывания глутамата на рецепторе NMDA Нарушает синаптическую пластичность и определенные формы обучения |
| NMDA | Глутамат | Рецептор NMDA | Агонист | Используется в исследованиях для изучения рецептора NMDA Ионотропный рецептор |
| AMPA | Глутамат | Рецептор AMPA | Агонист | Используется в исследованиях для изучения рецептора AMPA Ионотропный рецептор |
| Кетамин | Глутамат | Каинатный рецептор | Антагонист | Используется в исследованиях для изучения рецептора каината Вызывает состояние транса, облегчает боль и успокаивает |
| Аллиглицин | ГАМК | – | – | Подавляет синтез ГАМК Вызывает судороги |
| Muscimol | ГАМК | Рецептор ГАМК | Агонист | Вызывает седативный эффект |
| Бикукулин | ГАМК | Рецептор ГАМК | Антагонист | Причины судорог |
| Бензодиазепины | ГАМК | ГАМКА рецептор | Непрямые агонисты | Анксиолитик, седативный эффект, нарушение памяти, расслабление мышц |
| Барбитураты | ГАМК | ГАМКА рецептор | Непрямые агонисты | Седативный эффект, нарушение памяти, расслабление мышц |
| Алкоголь | ГАМК | Рецептор ГАМК | Косвенный агонист | Седативный эффект, нарушение памяти, расслабление мышц |
| Пикротоксин | ГАМК | ГАМКА рецептор | Косвенный антагонист | Высокие дозы вызывают судороги |
| Тиагабин | ГАМК | – | Антагонист | Антагонист транспортера ГАМК Повышение доступности ГАМК Снижает вероятность судорог |
| Моклобемид | Норэпинефрин | – | Агонист | Блокирует МАО-А для лечения депрессии |
| Идазоксан | Норэпинефрин | альфа-2 адренергические ауторецепторы | Агонист | Блокирует ауторецепторы альфа-2 Используется для изучения норадреналиновой системы |
| Фузариновая кислота | Норэпинефрин | – | – | Подавляет активность дофамин-бета-гидроксилазы, которая блокирует выработку норэпинефрина. Используется для изучения норадреналиновой системы, не влияя на дофаминовую систему. |
| Опиаты (Опиум, морфий, героин,и оксикодон ) | Опиоиды | Опиоидный рецептор[44] | Агонисты | Обезболивающий, седативный и усиливающий эффекты |
| Налоксон | Опиоиды | – | Антагонист | Снимает симптомы опиатной интоксикации или передозировки (например, проблемы с дыханием) |
Агонисты
Эта секция нуждается в расширении с: охват полных агонистов и их отличие от частичных агонистов и обратных агонистов. Вы можете помочь добавляя к этому. (Август 2015 г.) |
Агонист - это химическое вещество, способное связываться с рецептором, таким как рецептор нейромедиатора, и инициировать ту же реакцию, которая обычно вызывается связыванием эндогенного вещества.[45] Таким образом, агонист нейротрансмиттера инициирует тот же рецепторный ответ, что и передатчик. В нейронах лекарственный препарат-агонист может активировать рецепторы нейромедиаторов прямо или косвенно. Агонисты прямого связывания можно далее охарактеризовать как полные агонисты, частичные агонисты, обратные агонисты.[нужна цитата ][46]
Прямые агонисты действуют аналогично нейротрансмиттеру, связываясь непосредственно с ассоциированным с ним рецепторным сайтом (ами), который может быть расположен на пресинаптическом нейроне или постсинаптическом нейроне, или на обоих.[47] Обычно рецепторы нейротрансмиттеров расположены на постсинаптическом нейроне, в то время как нейромедиатор ауторецепторы расположены на пресинаптическом нейроне, как и в случае моноаминовые нейротрансмиттеры;[24] в некоторых случаях нейротрансмиттер использует ретроградная нейротрансмиссия, тип обратной связи в нейронах, при котором нейротрансмиттер высвобождается постсинаптически и связывается с рецепторами-мишенями, расположенными на пресинаптическом нейроне.[48][примечание 1] Никотин, соединение, обнаруженное в табак, является прямым агонистом большинства никотиновые рецепторы ацетилхолина, в основном расположен в холинергические нейроны.[44] Опиаты, Такие как морфий, героин, гидрокодон, оксикодон, кодеин, и метадон, находятся μ-опиоидный рецептор агонисты; это действие опосредует их эйфорический и облегчение боли характеристики.[44]
Непрямые агонисты увеличивают связывание нейромедиаторов с их рецепторами-мишенями, стимулируя высвобождение или предотвращая обратный захват нейротрансмиттеров.[47] Некоторые непрямые агонисты запускать высвобождение нейромедиатора и предотвратить обратный захват нейротрансмиттера. Амфетамин, например, является непрямым агонистом постсинаптических рецепторов дофамина, норэпинефрина и серотонина в каждом из соответствующих нейронов;[24][25] он производит высвобождение нейротрансмиттеров в пресинаптическом нейроне, а затем в синаптическую щель и предотвращает их обратный захват из синаптической щели, активируя TAAR1, пресинаптический Рецептор, связанный с G-белком, и привязка к сайту на VMAT2, тип транспортер моноаминов расположен на синаптические везикулы в моноаминовые нейроны.[24][25]
Антагонисты
Антагонист - это химическое вещество, которое действует в организме, снижая физиологическую активность другого химического вещества (как опиата); особенно тот, который противодействует действию на нервную систему лекарства или вещества, встречающегося в организме естественным образом, путем объединения и блокирования его нервного рецептора.[49]
Существует два основных типа антагонистов: антагонисты прямого действия и антагонисты непрямого действия:
- Антагонист прямого действия, который занимает место на рецепторах, которые в противном случае занимают сами нейротрансмиттеры. Это приводит к тому, что нейротрансмиттеры блокируются от связывания с рецепторами. Наиболее распространен атропин.
- Антагонисты непрямого действия - препараты, подавляющие высвобождение / производство нейротрансмиттеров (например, Резерпин ).
Антагонисты лекарств
Антагонистическое лекарство - это лекарство, которое прикрепляется (или связывается) к участку, называемому рецептором, без активации этого рецептора для получения биологической реакции. Поэтому говорят, что он не обладает внутренней активностью. Антагонист может также называться «блокатором» рецептора, потому что он блокирует действие агониста на сайте. Фармакологические эффекты антагониста, таким образом, приводят к предотвращению связывания агонистов соответствующего рецепторного сайта (например, лекарств, гормонов, нейромедиаторов) с ним и его активации. Антагонисты могут быть «конкурентными» или «необратимыми».
Конкурентный антагонист конкурирует с агонистом за связывание с рецептором. По мере увеличения концентрации антагониста связывание агониста прогрессивно ингибируется, что приводит к снижению физиологического ответа. Высокая концентрация антагониста может полностью подавить ответ. Однако это ингибирование можно обратить вспять путем повышения концентрации агониста, поскольку агонист и антагонист конкурируют за связывание с рецептором. Следовательно, конкурентных антагонистов можно охарактеризовать как сдвигающих зависимость доза-реакция для агониста справа. В присутствии конкурентного антагониста требуется повышенная концентрация агониста, чтобы вызвать тот же ответ, который наблюдается в отсутствие антагониста.
Необратимый антагонист настолько сильно связывается с рецептором, что делает рецептор недоступным для связывания с агонистом. Необратимые антагонисты могут даже образовывать ковалентные химические связи с рецептором. В любом случае, если концентрация необратимого антагониста достаточно высока, количество несвязанных рецепторов, остающихся для связывания агониста, может быть настолько низким, что даже высокие концентрации агониста не вызывают максимального биологического ответа.[50]
Прекурсоры
При приеме нейромедиатора предшественники увеличивает синтез нейротрансмиттеров, доказательства неоднозначны относительно того, выпуск нейротрансмиттера и повышается активизация постсинаптических рецепторов. Даже при повышенном высвобождении нейротрансмиттеров неясно, приведет ли это к долгосрочному увеличению силы сигнала нейромедиатора, поскольку нервная система может адаптироваться к таким изменениям, как усиление синтеза нейротрансмиттеров, и поэтому может поддерживать постоянную активность.[54][ненадежный медицинский источник? ] Некоторые нейротрансмиттеры могут играть роль в депрессии, и есть некоторые данные, позволяющие предположить, что прием предшественников этих нейромедиаторов может быть полезным при лечении легкой и умеренной депрессии.[54][ненадежный медицинский источник? ][55]
Катехоламины и предшественники следов аминов
L-ДОПА, предшественник дофамин что пересекает гематоэнцефалический барьер, используется при лечении болезнь Паркинсона. Для пациентов с депрессией, у которых низкая активность нейромедиатора. норэпинефрин Имеется очень мало доказательств пользы от введения предшественников нейромедиаторов. L-фенилаланин и L-тирозин оба являются предшественниками дофамин, норэпинефрин, и адреналин. Эти преобразования требуют витамин B6, Витамин С, и S-аденозилметионин. Несколько исследований предполагают потенциальные антидепрессивные эффекты L-фенилаланина и L-тирозина, но есть много возможностей для дальнейших исследований в этой области.[54][ненадежный медицинский источник? ]
Предшественники серотонина
Администрация L-триптофан, предшественник серотонин, увеличивает производство серотонина в головном мозге вдвое. Он значительно более эффективен, чем плацебо, при лечении легкой и умеренной депрессии.[54][ненадежный медицинский источник? ] Это преобразование требует Витамин С.[23] 5-гидрокситриптофан (5-HTP), также является прекурсором для серотонин, более эффективен, чем плацебо.[54][ненадежный медицинский источник? ]
Заболевания и расстройства
Заболевания и расстройства также могут влиять на определенные системы нейротрансмиттеров. Ниже перечислены нарушения, связанные с увеличением, уменьшением или дисбалансом определенных нейротрансмиттеров.
Дофамин:
Например, проблемы с выработкой дофамина (в основном в черная субстанция ) может привести к болезнь Паркинсона, расстройство, которое влияет на способность человека двигаться так, как он хочет, в результате чего возникает скованность, тремор или тряска и другие симптомы. Некоторые исследования показывают, что слишком мало или слишком много дофамина или проблемы с его использованием в мыслящих и чувственных областях мозга могут играть роль в таких расстройствах, как шизофрения или же Синдром дефицита внимания и гиперактивности (СДВГ). Дофамин также вызывает привыкание и употребление наркотиков, поскольку большинство рекреационных наркотиков вызывают приток дофамина в мозг (особенно опиоид и метамфетамины ), доставляющее удовольствие, поэтому потребители постоянно испытывают тягу к наркотикам.
Серотонин:
Аналогичным образом, после того, как некоторые исследования показали, что препараты, блокирующие рециркуляцию или обратный захват серотонина, похоже, помогают некоторым людям с диагнозом депрессия, было высказано предположение, что люди с депрессия может иметь уровень серотонина ниже нормы. Несмотря на широкую популяризацию, эта теория не получила подтверждения в последующих исследованиях.[56] Следовательно, селективные ингибиторы обратного захвата серотонина (СИОЗС) используются для увеличения количества серотонина в синапсах.
Глутамат:
Более того, проблемы с производством или использованием глутамата предположительно и предположительно связаны со многими психическими расстройствами, включая аутизм, обсессивно-компульсивное расстройство (ОКР), шизофрения, и депрессия.[57] Избыток глутамата был связан с неврологическими заболеваниями, такими как болезнь Паркинсона, рассеянный склероз, Болезнь Альцгеймера, Инсульт, и ALS (боковой амиотрофический склероз).[58]

Дисбаланс нейротрансмиттеров
Как правило, не существует научно установленных «норм» для соответствующих уровней или «балансов» различных нейротрансмиттеров. В большинстве случаев прагматично невозможно даже измерить уровни нейромедиаторов в мозге или теле в какие-либо определенные моменты времени. Нейротрансмиттеры регулируют высвобождение друг друга, и слабый постоянный дисбаланс в этой взаимной регуляции был связан с темпераментом у здоровых людей.[59][60][61][62][63] Сильный дисбаланс или сбои в работе нейротрансмиттерных систем были связаны со многими заболеваниями и психическими расстройствами. К ним относятся болезнь Паркинсона, депрессия, бессонница, синдром дефицита внимания и гиперактивности (СДВГ), беспокойство, потеря памяти, резкие изменения веса и зависимости. Хронический физический или эмоциональный стресс может способствовать изменениям в нейромедиаторной системе. Генетика также играет роль в активности нейротрансмиттеров. Помимо использования в рекреационных целях, лекарства, которые прямо или косвенно взаимодействуют с одним или несколькими передатчиком или его рецептором, обычно назначаются при психиатрических и психологических проблемах. В частности, препараты, взаимодействующие с серотонин и норэпинефрин прописываются пациентам с такими проблемами, как депрессия и тревожность, хотя представление о том, что существует множество веских медицинских доказательств в поддержку таких вмешательств, подвергалось широкой критике.[64] Исследования показали, что дисбаланс дофамина влияет на рассеянный склероз и другие неврологические расстройства.[65]
Устранение нейротрансмиттеров
Нейромедиатор должен быть разрушен, как только он достигнет постсинаптической клетки, чтобы предотвратить дальнейшую передачу возбуждающего или тормозящего сигнала. Это позволяет производить новые сигналы от соседних нервных клеток. Когда нейротрансмиттер секретируется в синаптическую щель, он связывается со специфическими рецепторами постсинаптической клетки, тем самым генерируя постсинаптический электрический сигнал. Затем передатчик должен быть быстро удален, чтобы постсинаптическая клетка могла участвовать в другом цикле высвобождения, связывания и генерации сигнала нейромедиатора. Нейротрансмиттеры терминируются тремя разными способами:
- Диффузия - нейротрансмиттер отделяется от рецептора, выходя из синаптической щели, здесь он поглощается глиальные клетки.
- Расщепление ферментов - специальные химические вещества, называемые ферменты Сломай. Обычно, астроциты абсорбируют избыточные нейротрансмиттеры и передают их ферментам или перекачивают непосредственно в пресинаптический нейрон.
- Reuptake - повторное поглощение нейромедиатора нейроном. Транспортеры, или мембранные транспортные белки, перекачивают нейротрансмиттеры из синаптической щели обратно в терминалы аксонов (пресинаптический нейрон), где они хранятся.[66]
Например, холин поглощается и повторно используется пресинаптическим нейроном для синтеза большего количества ACh. Другие нейротрансмиттеры, такие как дофамин способны размытый далеко от целевых синаптических соединений и выводятся из организма через почки или разрушаются в печени. Каждый нейротрансмиттер имеет очень специфические пути деградации в регуляторных точках, на которые может воздействовать регуляторная система организма или лекарства.
Смотрите также
Примечания
- ^ В центральной нервной системе анандамид Другой эндоканнабиноиды используют ретроградную нейротрансмиссию, поскольку их высвобождение является постсинаптическим, а их рецептор-мишень, каннабиноидный рецептор 1 (CB1), пресинаптический.[48] В каннабис растение содержит Δ9-тетрагидроканнабинол, который является прямым агонистом CB1.[48]
- ^ ГАМК - это не протеиногенный аминокислота
Рекомендации
- ^ Lodish, H .; Берк, А .; Зипурский, С. (2000). Молекулярная клеточная биология: Раздел 21.4 Нейротрансмиттеры, синапсы и передача импульсов (4-е изд.). Нью-Йорк: У. Х. Фриман.
- ^ Черри, Кендра. "Что такое нейротрансмиттер?". Получено 6 октября 2014.
- ^ «База данных нейропептидов».
- ^ «Нейропептиды. Руководство IUPHAR / BPS по фармакологии».
- ^ Элиас, Л. Дж., И Сосье, Д. М. (2005). Нейропсихология: клинические и экспериментальные основы. Бостон: Пирсон
- ^ Саладин, Кеннет С. Анатомия и физиология: единство формы и функции. Макгроу Хилл. 2009 г. ISBN 0-07-727620-5
- ^ Университет, С. Марк Бридлав, Университет штата Мичиган, Нил В. Уотсон, Саймон Фрейзер (2013). Биологическая психология: введение в поведенческую, когнитивную и клиническую нейробиологию (Седьмое изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0878939275.
- ^ а б Уишоу, Брайан Колб, Ян К. (2014). Введение в мозг и поведение (4-е изд.). Нью-Йорк, Нью-Йорк: Издательство Worth. С. 150–151. ISBN 978-1429242288.
- ^ Барре Виджая Прасад (2020). Изучение биологических основ человеческого поведения. Соединенные Штаты Америки: IGI Global. п. 81. ISBN 978-1799-8286-17.
- ^ а б Роберт Сапольски (2005). «Биология и поведение человека: неврологические истоки индивидуальности, 2-е издание». Обучающая компания.
см. страницы 13 и 14 Путеводителя
- ^ Снайдер SH, Innis RB (1979). «Пептидные нейротрансмиттеры». Анну. Преподобный Biochem. 48: 755–82. Дои:10.1146 / annurev.bi.48.070179.003543. PMID 38738.
- ^ Кодиров Содикджон А., Такидзава Шуичи, Джозеф Джейми, Кандел Эрик Р., Шумяцкий Глеб П., Большаков Вадим Ю. (2006). «Синаптически высвобождаемые цинковые ворота обеспечивают долгосрочное усиление путей кондиционирования страха». PNAS. 103 (41): 15218–23. Дои:10.1073 / pnas.0607131103. ЧВК 1622803. PMID 17005717.CS1 maint: несколько имен: список авторов (связь)
- ^ «Международный симпозиум по оксиду азота - доктор Джон Эндрюс - MaRS». Марс. Архивировано из оригинал 14 октября 2014 г.
- ^ «Дофамин: биологическая активность». IUPHAR / BPS руководство по фармакологии. Международный союз фундаментальной и клинической фармакологии. Получено 29 января 2016.
- ^ Гранди Д. К., Миллер Г. М., Ли Дж. Х. (февраль 2016 г.). ""TAARgeting Addiction "- Аламо стал свидетелем еще одной революции: обзор пленарного симпозиума конференции по поведению, биологии и химии 2015 г.". Зависимость от наркотиков и алкоголя. 159: 9–16. Дои:10.1016 / j.drugalcdep.2015.11.014. ЧВК 4724540. PMID 26644139.
TAAR1 представляет собой рецептор с высоким сродством к МЕТ / АМФН и ДА.
- ^ Лин Й, Холл РА, Кухар MJ (октябрь 2011 г.). «CART-пептидная стимуляция передачи сигналов, опосредованной G-белком, в дифференцированных клетках PC12: идентификация PACAP 6–38 как антагониста рецептора CART». Нейропептиды. 45 (5): 351–358. Дои:10.1016 / j.npep.2011.07.006. ЧВК 3170513. PMID 21855138.
- ^ Уишоу, Брайан Колб, Ян К. (2014). Введение в мозг и поведение (4-е изд.). Нью-Йорк, Нью-Йорк: Издательство Worth. ISBN 978-1429242288.
- ^ Валовой L (2006). ""Поддержка «игроки берут на себя инициативу по защите чрезмерно возбужденного мозга». ПЛОС Биол. 4 (11): e371. Дои:10.1371 / journal.pbio.0040371. ЧВК 1609133. PMID 20076484.
- ^ Ян Дж. Л., Сикора П., Уилсон Д. М., Маттсон М. П., Бор В. А. (август 2011 г.). «Возбуждающий нейротрансмиттер глутамат стимулирует восстановление ДНК, повышая сопротивляемость нейронов». Мех. Старение Дев. 132 (8–9): 405–11. Дои:10.1016 / j.mad.2011.06.005. ЧВК 3367503. PMID 21729715.
- ^ Антагонисты рецепторов орексина - новый класс снотворных, Национальный фонд сна.
- ^ «Рецепторы ацетилхолина». Ebi.ac.uk. Получено 25 августа 2014.
- ^ Шактер, Гилберт и Вегер. Психология. Соединенные Штаты Америки, 2009. Вып.
- ^ а б Бристольский университет. «Введение в серотонин». Получено 15 октября 2009.
- ^ а б c d е Миллер GM (январь 2011 г.). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности». J. Neurochem. 116 (2): 164–176. Дои:10.1111 / j.1471-4159.2010.07109.x. ЧВК 3005101. PMID 21073468.
- ^ а б c d Эйден Л. Е., Вэйхэ Э (январь 2011 г.). «VMAT2: динамический регулятор моноаминергической нейрональной функции мозга, взаимодействующий с наркотиками, вызывающими злоупотребление». Анна. Акад. Наука. 1216 (1): 86–98. Bibcode:2011НЯСА1216 ... 86Е. Дои:10.1111 / j.1749-6632.2010.05906.x. ЧВК 4183197. PMID 21272013.
VMAT2 является везикулярным переносчиком ЦНС не только для биогенных аминов DA, NE, EPI, 5-HT и HIS, но, вероятно, также для следовых аминов TYR, PEA и тиронамина (THYR) ... [Следы аминергических] нейронов в ЦНС млекопитающих можно идентифицировать как нейроны, экспрессирующие VMAT2 для хранения, и биосинтетический фермент декарбоксилазу ароматических аминокислот (AADC).
- ^ а б c Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. п. 155. ISBN 9780071481274.
Различные субрегионы VTA получают глутаматергические входы от префронтальной коры, орексинергические входы от латерального гипоталамуса, холинергические, а также глутаматергические и ГАМКергические входные сигналы от латеродорсального тегментального ядра и педункулопонтинного ядра, норадренергические входные сигналы от серозного ядра, серотонинергического ядра, серо-рапинергического ядра и ГАМКергические входы из прилежащего ядра и вентрального паллидума.
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 145, 156–157. ISBN 9780071481274.
Нисходящие волокна NE модулируют афферентные болевые сигналы. ... Голубое пятно (ЦК), расположенное на дне четвертого желудочка в ростральном мосту, содержит более 50% всех норадренергических нейронов головного мозга; он иннервирует как передний мозг (например, он обеспечивает практически весь НЭ в коре головного мозга), так и области ствола и спинного мозга. ... Другие норадренергические нейроны в головном мозге встречаются в рыхлых скоплениях клеток в стволе мозга, включая латеральные тегментальные области. Эти нейроны в основном проецируются в ствол мозга и спинной мозг. NE, наряду с 5HT, ACh, гистамином и орексином, является важным регулятором цикла сна-бодрствования и уровней возбуждения. ... возбуждение LC может также усилить тревогу ... Стимуляция β-адренорецепторов в миндалине приводит к усилению памяти на стимулы, закодированные под сильными отрицательными эмоциями ... Адреналин встречается только в небольшом количестве центральных нейронов, все они расположены в мозгового вещества. Адреналин участвует в висцеральных функциях, таких как контроль дыхания.
- ^ а б c d Ранг, Х. П. (2003). Фармакология. Эдинбург: Черчилль Ливингстон. стр. 474 для норадреналиновой системы, стр. 476 для дофаминовой системы, стр. 480 для серотониновой системы и стр. 483 для холинергической системы. ISBN 978-0-443-07145-4.
- ^ а б c d е Iwańczuk W, Guźniczak P (2015). «Нейрофизиологические основы феноменов сна, возбуждения, осознавания и сознания. Часть 1». Анестезиол Интенсив Тер. 47 (2): 162–167. Дои:10.5603 / AIT.2015.0015. PMID 25940332.
Восходящая ретикулярная активирующая система (ВРАС) отвечает за длительное состояние бодрствования. ... В таламической проекции преобладают холинергические нейроны, происходящие из педункулопонтинного тегментального ядра моста и среднего мозга (PPT) и латеродорсального тегментального ядра моста и ядер среднего мозга (LDT) [17, 18]. Гипоталамическая проекция включает норадренергические нейроны голубого пятна (LC) и серотонинергические нейроны дорсального и срединного ядер шва (DR), которые проходят через латеральный гипоталамус и достигают аксонов гистаминергического туберомамиллярного ядра (TMN), вместе формируя путь, идущий в передний мозг, кору и гиппокамп. Кортикальное возбуждение также использует дофаминергические нейроны черной субстанции (SN), вентральной области надкрылий (VTA) и периакведуктальной серой зоны (PAG). Меньшее количество холинергических нейронов моста и среднего мозга посылает проекции в передний мозг по вентральному пути, минуя таламус [19, 20].
- ^ а б c d е Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 12: Сон и возбуждение». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк, США: McGraw-Hill Medical. п. 295. ISBN 9780071481274.
ARAS - это сложная структура, состоящая из нескольких различных цепей, включая четыре моноаминергических пути ... Путь норэпинефрина берет свое начало из голубого пятна (LC) и связанных ядер ствола мозга; серотонинергические нейроны также происходят из ядер шва в стволе мозга; дофаминергические нейроны берут начало в вентральной тегментальной области (VTA); а гистаминергический путь происходит от нейронов туберомаммиллярного ядра (TMN) заднего гипоталамуса. Как обсуждалось в главе 6, эти нейроны широко распространяются по всему мозгу из ограниченных скоплений клеточных тел. Норэпинефрин, серотонин, дофамин и гистамин обладают сложными модулирующими функциями и в целом способствуют бодрствованию. PT в стволе мозга также является важным компонентом ARAS. Активность холинергических нейронов PT (REM-on-клетки) способствует быстрому сну. Во время бодрствования REM-клетки ингибируются подмножеством ARAS норэпинефриновых и серотониновых нейронов, называемых REM-off клетками.
- ^ Ринаман Л. (февраль 2011 г.). «Норадренергические нейроны A2 заднего мозга: различные роли в вегетативных, эндокринных, когнитивных и поведенческих функциях». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 300 (2): Р222-35. Дои:10.1152 / ajpregu.00556.2010. ЧВК 3043801. PMID 20962208.
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 147–148, 154–157. ISBN 9780071481274.
Нейроны из SNc плотно иннервируют дорсальное полосатое тело, где они играют решающую роль в обучении и выполнении моторных программ. Нейроны из VTA иннервируют вентральное полосатое тело (прилежащее ядро), обонятельную луковицу, миндалину, гиппокамп, орбитальную и медиальную префронтальную кору и поясную извилину. Нейроны VTA DA играют решающую роль в мотивации, поведении, связанном с вознаграждением, внимании и множественных формах памяти. ... Таким образом, действуя в различных конечных областях, дофамин придает мотивационную значимость ("желание") самой награде или связанным с ней сигналам (область оболочки прилежащего ядра), обновляет значение, придаваемое различным целям в свете этого нового опыта (орбитальная префронтальная cortex), помогает консолидировать несколько форм памяти (миндалевидное тело и гиппокамп) и кодирует новые моторные программы, которые облегчат получение этой награды в будущем (область ядра прилежащего ядра и дорсальное полосатое тело). ... DA имеет несколько действий в префронтальной коре. Он способствует «когнитивному контролю» поведения: отбору и успешному мониторингу поведения для облегчения достижения выбранных целей. Аспекты когнитивного контроля, в которых DA играет роль, включают рабочую память, способность удерживать информацию «в режиме онлайн», чтобы направлять действия, подавление доминирующего поведения, которое конкурирует с целенаправленными действиями, и контроль внимания и, следовательно, способность преодолеть отвлекающие факторы. ... Таким образом, норадренергические проекции из LC взаимодействуют с дофаминергическими проекциями из VTA, чтобы регулировать когнитивный контроль. ...
- ^ Калипари Е.С., Багот Р.К., Пурушотаман И., Дэвидсон Т.Дж., Йоргасон Д.Т., Пенья С.Дж., Уокер Д.М., Пирпиниас С.Т., Гиз К.Г., Рамакришнан С., Дейссерот К., Нестлер Е.Д. (февраль 2016 г.). «Визуализация in vivo идентифицирует временную сигнатуру шиповидных нейронов D1 и D2 в кокаиновой награде». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 113 (10): 2726–31. Bibcode:2016PNAS..113.2726C. Дои:10.1073 / pnas.1521238113. ЧВК 4791010. PMID 26831103.
Предыдущая работа продемонстрировала, что оптогенетическая стимуляция MSN D1 способствует вознаграждению, тогда как стимуляция MSN D2 вызывает отвращение.
- ^ Икемото S (2010). «Схема вознаграждения мозга за пределами мезолимбической дофаминовой системы: нейробиологическая теория». Neurosci Biobehav Rev. 35 (2): 129–50. Дои:10.1016 / j.neubiorev.2010.02.001. ЧВК 2894302. PMID 20149820.
Недавние исследования внутричерепного самостоятельного введения нейрохимических веществ (лекарств) показали, что крысы учатся самостоятельно вводить различные препараты в мезолимбические структуры дофамина - заднюю вентральную тегментальную область, прилежащее ядро медиальной оболочки и медиальный обонятельный бугорок. ... В 1970-х годах было признано, что обонятельный бугорок содержит стриарный компонент, который заполнен ГАМКергическими средними шиповидными нейронами, получающими глутаматергические входные сигналы от кортикальных областей и дофаминергические входные сигналы от ВТА и проецирующиеся в вентральный паллидум так же, как прилежащее ядро.
Рисунок 3: Вентральное полосатое тело и самостоятельное введение амфетамина - ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 175–176. ISBN 9780071481274.
В головном мозге гистамин синтезируется исключительно нейронами с их клеточными телами в туберомаммиллярном ядре (TMN), которое находится в задней части гипоталамуса. У человека примерно 64000 гистаминергических нейронов на каждой стороне. Эти клетки проецируются по всему головному и спинному мозгу. Области, которые получают особенно плотные проекции, включают кору головного мозга, гиппокамп, неостриатум, прилежащее ядро, миндалевидное тело и гипоталамус. ... В то время как наиболее охарактеризованная функция гистаминовой системы в головном мозге - регуляция сна и возбуждения, гистамин также участвует в обучении и памяти ... Также оказывается, что гистамин участвует в регуляции питания и энергетического баланса.
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 158–160. ISBN 9780071481274.
[] Дорсальный шов преимущественно иннервирует кору головного мозга, таламус, полосатое тело (хвостатое ядро и прилежащее ядро) и дофаминергические ядра среднего мозга (например, черная субстанция и вентральная тегментальная область), в то время как средний шов иннервирует гиппокамп. septum и другие структуры лимбического отдела переднего мозга. ... очевидно, что 5HT влияет на сон, возбуждение, внимание, обработку сенсорной информации в коре головного мозга, а также на важные аспекты эмоций (вероятно, включая агрессию) и регуляцию настроения. ... Ростральные ядра, которые включают в себя линейное ядро, дорсальный шов, медиальный шов и понтийный шов, иннервируют большую часть мозга, включая мозжечок. Хвостовые ядра, которые включают raphe magnus, raphe pallidus и raphe obscuris, имеют более ограниченные выступы, которые заканчиваются в мозжечке, стволе мозга и спинном мозге.
- ^ Нестлер, Эрик Дж. "ПУТИ ВОЗНАГРАЖДЕНИЯ МОЗГА". Медицинская школа Икана на горе Синай. Nestler Lab. Получено 16 августа 2014.
Дорсальный шов является основным местом расположения серотонинергических нейронов в головном мозге, которые, как и норадренергические нейроны, всесторонне модулируют функцию мозга, регулируя состояние активации и настроение организма.
- ^ Марстон О.Дж., Гарфилд А.С., Хейслер Л.К. (июнь 2011 г.). «Роль центральных систем серотонина и меланокортина в контроле энергетического баланса». Европейский журнал фармакологии. 660 (1): 70–79. Дои:10.1016 / j.ejphar.2010.12.024. PMID 21216242.
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 167–175. ISBN 9780071481274.
Базальные холинергические ядра переднего мозга состоят из медиального ядра перегородки (Ch1), вертикального ядра диагональной перемычки (Ch2), горизонтального отгиба диагональной перемычки (Ch3) и базального ядра Мейнерта (Ch4). Холинергические ядра ствола мозга включают педункулопонтинное ядро (Ch5), латеродорсальное тегментальное ядро (Ch6), медиальную габенюлю (Ch7) и парабигеминальное ядро (Ch8).
- ^ "Разговоры нейронов: как клетки мозга общаются". Brainfacts.org. Получено 2 декабря 2014.
- ^ а б Yadav VK, Ryu JH, Suda N, Tanaka KF, Gingrich JA, Schütz G, Glorieux FH, Chiang CY, Zajac JD, Insogna KL, Mann JJ, Hen R, Ducy P, Karsenty G (ноябрь 2008 г.). «Lrp5 контролирует образование костей, подавляя синтез серотонина в двенадцатиперстной кишке». Клетка. 135 (5): 825–37. Дои:10.1016 / j.cell.2008.09.059. ЧВК 2614332. PMID 19041748.
- ^ Карлсон, Н. Р., и Биркетт, М. А. (2017). Физиология поведения (12-е изд.). Пирсон, стр. 100–115. ISBN 978-0134080918
- ^ "Центр контроля заболеваний Стрихнин | Факты о Стрихнине | Готовность к чрезвычайным ситуациям в области общественного здравоохранения и меры реагирования". Emergency.cdc.gov. Получено 7 мая 2018.
- ^ а б c «Таблица нейротрансмиттеров и лекарственных препаратов». Ocw.mit.edu. Получено 25 августа 2014.
- ^ «Агонист - определение и многое другое из бесплатного словаря Merriam-Webster». Merriam-webster.com. Получено 25 августа 2014.
- ^ Рот, Брайан Л. (17 февраля 2016 г.). «СТРАДЫ ДЛЯ Нейробиологов». Нейрон. 89 (4): 683–694. Дои:10.1016 / j.neuron.2016.01.040. ЧВК 4759656. PMID 26889809.
- ^ а б Ричард К. Райс; Дэвид А. Фьеллин; Шеннон С. Миллер (2009). Принципы наркологической медицины (4-е изд.). Филадельфия: Уолтерс Клувер / Липпинкотт Уильямс и Уилкинс. С. 709–710. ISBN 9780781774772. Получено 16 августа 2015.
- ^ а б c Флорес А., Мальдонадо Р., Беррендеро Ф (2013). «Перекрестный разговор между каннабиноидом и гипокретином в центральной нервной системе: что мы знаем до сих пор». Front Neurosci. 7: 256. Дои:10.3389 / fnins.2013.00256. ЧВК 3868890. PMID 24391536.
• Рисунок 1: Схема экспрессии CB1 мозга и орексинергических нейронов, экспрессирующих OX1 или OX2.
• Рисунок 2: Синаптические сигнальные механизмы в каннабиноидных и орексиновых системах. - ^ «Антагонист». Медицинское определение антагониста. Получено 5 ноября 2014.
- ^ Годерс, Ник Э. (2001). «Антагонист». Энциклопедия наркотиков, алкоголя и привыкания. Получено 2 декабря 2014.
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ а б c d е Мейерс, Стивен (2000). «Использование прекурсоров нейротрансмиттеров для лечения депрессии» (PDF). Обзор альтернативной медицины. 5 (1): 64–71. PMID 10696120. Архивировано из оригинал (PDF) 5 августа 2004 г.
- ^ Ван Прааг, HM (1981). «Управление депрессией с помощью предшественников серотонина». Биологическая психиатрия. 16 (3): 291–310. PMID 6164407.
- ^ Хили, Дэвид (21 апреля 2015 г.). «Серотонин и депрессия». BMJ. 350: h1771. Дои:10.1136 / bmj.h1771. ISSN 1756-1833. PMID 25900074. S2CID 38726584.
- ^ "Основы мозга NIMH". Национальные институты здравоохранения США. Получено 29 октября 2014.
- ^ Bittigau, P .; Ikonomidou, C. (ноябрь 1997 г.). «Глутамат при неврологических заболеваниях». Журнал детской неврологии. 12 (8): 471–485. Дои:10.1177/088307389701200802. ISSN 0883-0738. PMID 9430311. S2CID 1258390.
- ^ Неттер, П. (1991) Биохимические переменные в изучении темперамента. В Strelau, J. & Angleitner, A. (Eds.), Исследования темперамента: Международные перспективы теории и измерения 147–161. Нью-Йорк: Пленум Пресс.
- ^ Трофимова И., Роббинс Т.В. (2016). «Темперамент и системы возбуждения: новый синтез дифференциальной психологии и функциональной нейрохимии». Неврология и биоповеденческие обзоры. 64: 382–402. Дои:10.1016 / j.neubiorev.2016.03.008. PMID 26969100. S2CID 13937324.
- ^ Cloninger CR, Svrakic DM, Przybeck TR. Психобиологическая модель темперамента и характера » Arch Gen Psychiatry 1993; 50:975-990.
- ^ Трофимова И.Н. (2016). «Взаимосвязь между функциональными аспектами деятельности и нейрохимической моделью темперамента взрослого». В: Arnold, M.C. (Ред.) Темпераменты: индивидуальные различия, социальное и экологическое влияние и влияние на качество жизни. Нью-Йорк: Nova Science Publishers, Inc.: 77–147.
- ^ Депуэ Р.А., Морроне-Струпинский СП (2005). «Нейроповеденческая модель аффилированных связей: последствия для концептуализации человеческой черты принадлежности». Поведенческие науки и науки о мозге. 28 (3): 313–350. Дои:10.1017 / s0140525x05000063. PMID 16209725.
- ^ Лео Дж. И Лакасс Дж. (10 октября 2007 г.). СМИ и теория химического дисбаланса депрессии. Проверено 1 декабря 2014 г., из http://psychrights.org/articles/TheMediaandChemicalImbalanceTheoryofDepression.pdf
- ^ Добрякова, Екатерина; Генова, Елена М .; ДеЛука, Джон; Уайли, Гленн Р. (12 марта 2015 г.). "Гипотеза дофаминового дисбаланса усталости при рассеянном склерозе и других неврологических расстройствах". Границы неврологии. 6: 52. Дои:10.3389 / fneur.2015.00052. ЧВК 4357260. PMID 25814977.
- ^ Карен К. Тимберлейк "Общая, органическая и биологическая химия структур жизни" с.661
внешняя ссылка
- Молекулярная клеточная биология. 4-е издание. Раздел 21.4: Нейротрансмиттеры, синапсы и передача импульсов
- Фотогалерея молекулярных выражений: Коллекция нейротрансмиттеров
- Нейротрансмиттеры головного мозга
- Эндогенные нейроактивные внеклеточные преобразователи сигналов
- Нейротрансмиттер в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- сайт нейробиологии для детей
- сайт исследователя мозга



