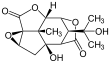
Пикротоксин - Picrotoxin
Пикротоксинин (слева) и пикротин (справа) | |||
| Клинические данные | |||
|---|---|---|---|
| Код УВД |
| ||
| Идентификаторы | |||
| Количество CAS | |||
| PubChem CID | |||
| IUPHAR / BPS | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| КЕГГ | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| Панель управления CompTox (EPA) | |||
| ECHA InfoCard | 100.004.288 | ||
| Химические и физические данные | |||
| 3D модель (JSmol ) | |||
| |||
| |||
| | |||
Пикротоксин, также известный как коккулин, является ядовитым кристаллическим растительным соединением. Впервые он был выделен французским фармацевтом и химиком Пьером Франсуа Гийомом Булле (1777–1869) в 1812 году.[1] Название «пикротоксин» представляет собой сочетание греческих слов «пикрос» (горький) и «токсикон» (яд).[2] Смесь двух различных соединений, пикротоксин естественным образом содержится в плодах растения. Anamirta cocculus растение, хотя его также можно синтезировать химическим путем.
Благодаря взаимодействию с тормозным нейротрансмиттером ГАМК, пикротоксин действует как стимулятор и конвульсант. В основном он влияет на центральную нервную систему, вызывая судороги и паралич дыхания в достаточно высоких дозах.
Химическая структура и синтез
Пикротоксин - эквикоренной зуб смесь двух соединений, пикротоксинин (C15ЧАС16О6; CAS № 17617-45-7) и пикротин (C15ЧАС18О7; CAS № 21416-53-5).[3] Из двух соединений пикротин менее активен.[4]
Пикротоксин естественным образом содержится в плодах Anamirta cocculusвьющееся растение из Индии и других частей Юго-Восточной Азии. Это растение известно своими большими стеблями из белого дерева и ароматными цветами. Он дает небольшие косточковые плоды, Cocculus indicus, которые обычно сушат.[нужна цитата ]
В настоящее время существует целых пять полных синтезов пикротоксинина, один из которых был опубликован в июне 2020 года лабораторией Шенви в Скриппе.[5] Этот синтез, как и большинство других молекул этой молекулы, включал использование карвона в качестве стереохимического шаблона. Стратегия использовала быстрое образование полициклического ядра с последующим изменением степеней окисления ключевых атомов углерода для получения целевой молекулы. Некоторые исследования предполагают, что это может происходить путем циклофункционализации циклоалкенильных систем. В кинетически контролируемых условиях этот процесс обычно приводит к экзо циклизация и образует мостиковые кольцевые системы, подобные тем, которые обнаружены в пикротоксине.[6] Кроме того, было предложено несколько вариантов синтеза пикротоксинина и пикротина, двух молекул, из которых состоит пикротоксин. В 1980 году был открыт процесс преобразования пикротоксинина в пикротин. Этот синтез начинается с обработки пикротоксина трифторуксусным ангидридом в пиридине для разделения компонентов.[7]
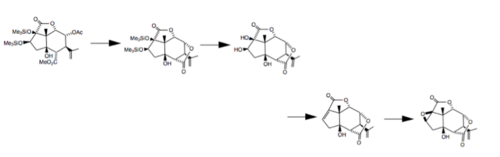
В 1988 году исследователи из Университета Тохоку в Японии завершили полный стереоселективный синтез как (-) - пикротоксинина, так и (-) - пикротина, начиная с (+) - 5β-гидроксиCarvone. В этом синтезе восемь асимметричных центров были стереоселективно получены на цис-конденсированной гидриндановой кольцевой системе с использованием нескольких различных реакций: перегруппировка Клайзена для введения четвертичного центра, опосредованное селеном восстановление эпоксикетона и стереоспецифическая конструкция сложного эфира глицидной кислоты. .[8] Последние шаги этого процесса показаны ниже.[9]

Пикротоксин также использовался в качестве исходного материала в нескольких синтетических процессах, включая создание дл-пикротоксадиен, который сохраняет определенные особенности пикротоксинового скелета.[10]
Механизм действия
Некоторые мышечные волокна ракообразных обладают возбуждающей и тормозной иннервацией. Пикротоксин блокирует торможение. [11] Были предложены две разные, но связанные теории механизма действия пикротоксина на синапсы. Одна теория состоит в том, что он действует как неконкурентный блокировщик каналов за ГАМКА рецептор хлоридные каналы,[12] в частности, хлорид-ионофор, активированный гамма-аминомасляной кислотой.[13] Исследование 2006 года показало, что, хотя пикротоксин структурно не похож на ГАМК, он предотвращает поток ионов через хлоридные каналы, активируемые ГАМК. Вероятно, он действует внутри самих ионных каналов, а не на сайтах узнавания ГАМК. Поскольку он ингибирует каналы, активируемые ГАМК, препараты, усиливающие ГАМК, такие как барбитураты и бензодиазепины, могут использоваться в качестве противоядия.[14]
Другое исследование предполагает, что токсин действует как неконкурентный антагонист или ингибитор рецепторов ГАМК. Исследование Newland и Cull-Candy показало, что в достаточно высоких концентрациях пикротоксин снижает амплитуду токов ГАМК. Их данные показали, что маловероятно, чтобы пикротоксин действовал просто как блокатор каналов с регулируемым напряжением, хотя он действительно уменьшал частоту открытия каналов. Скорее, они обнаружили, что пикротоксин «связывается преимущественно с формой рецептора, связанной с агонистом». Это означает, что даже в присутствии низких концентраций пикротоксина ответ нейронов на ГАМК снижается.[15]
Токсичность
Пикротоксин действует как стимулятор центральной нервной системы и дыхания. Он чрезвычайно токсичен для рыб и людей, а также для грызунов и других млекопитающих. Согласно Регистру токсических эффектов химических веществ, LDLo, или самая низкая зарегистрированная летальная доза, составляет 0,357 мг / кг. Симптомы отравления пикротоксином включают кашель, затрудненное дыхание, головную боль, головокружение, спутанность сознания, желудочно-кишечные расстройства, тошноту или рвоту, а также изменения частоты сердечных сокращений и артериального давления. Хотя это особенно опасно при проглатывании, системные эффекты также могут возникать в результате вдыхания или всасывания в кровоток через повреждения на коже.[16] Пикротоксин также действует как судорожное средство. Было обнаружено, что в больших дозах он вызывает клонические судороги или сердечную аритмию, причем особенно высокие дозы в конечном итоге приводят к летальному исходу, как правило, из-за паралича дыхания.[17]
Клинические приложения и другое использование
Из-за своей токсичности пикротоксин сейчас чаще всего используется в качестве инструмента исследования. Однако из-за его антагонистического действия на рецепторы ГАМК он использовался в качестве стимулятора центральной нервной системы. Ранее он также использовался в качестве антидота при отравлении депрессантами ЦНС, особенно барбитураты.[18]
Хотя пикротоксин обычно не используется, он эффективен как пестицид и педикулицид. В 19 веке его использовали при приготовлении крепкого мута, который добавляли в пиво, чтобы сделать его более опьяняющим. Этот препарат с тех пор объявлен вне закона.[нужна цитата ]
Несмотря на его потенциальную токсичность для млекопитающих в достаточно больших дозах, пикротоксин также иногда используется в качестве усилителя производительности у лошадей. Он классифицируется как незаконное «вещество класса I» Американская ассоциация четвертичных лошадей. Вещества, которые классифицируются как «Класс I», могут повлиять на работоспособность и не имеют терапевтического применения в медицине лошадей.[19] В 2010 году дрессировщик лошадей Роберт Димитт был отстранен от занятий после того, как его лошадь Stoli Signature дала положительный результат на это вещество. Как и у людей, он используется для противодействия отравлению барбитуратами.[20]
Смотрите также
Рекомендации
- ^ Булле П.Ф. (1812 г.). «Проанализировать химический состав Кок дю Леван, Menispermum cocculus». Bulletin de Pharmacie (На французском). 4: 5–34.
Menispermum cocculus »был переименован в« Anamirta cocculus ».
- ^ (Boullay, 1812), стр. 31.
- ^ Ло В, Нокс С., Джумбоу Й., Джуисон Т., Го А.С., Лю И и др. «Пикротоксин». DrugBank. DrugBank. Получено 26 апреля, 2017.
- ^ Гэмилл Р., Тулинский Дж. (1994). «Химия и фармакология ГАМКА и ГАМКB Лиганды ». Современная лекарственная химия. 1 (3): 242. Получено 26 апреля, 2017.
- ^ Crossley SW, Tong G, Lambrecht MJ, Burdge HE, Shenvi RA (июль 2020 г.). «Синтез (-) - пикротоксинина с помощью поздней стадии активации сильной связи». Журнал Американского химического общества. 142 (26): 11376–11381. Дои:10.1021 / jacs.0c05042. PMID 32573211.
- ^ Трост Б., Флеминг I (1991). Комплексный органический синтез (Том 4-е изд.). Оксфорд, Великобритания: Pergamon Press. п. 373. ISBN 9780080405957. Получено 7 мая, 2017.
- ^ Кори Э., Пирс Х (1980). «Тотальный синтез пикротина». Буквы Тетраэдра. 21 (19): 1823–1824. Дои:10.1016 / s0040-4039 (00) 92789-8.
- ^ Мияшита М., Судзуки Т., Йошикоши А. (май 1989 г.). «Стереоселективный тотальный синтез (-) - пикротоксинина и (-) - пикротина». Журнал Американского химического общества. 111 (10): 3728–3734. Дои:10.1021 / ja00192a035.
- ^ Trost B, Крише М (1996). «Пикротоксинин». Журнал Американского химического общества. 118: 233. Дои:10.1021 / ja953060r. Получено 7 мая, 2017.
- ^ Конрой Х (июнь 1952 г.). «Пикротоксин. II. Скелет пикротоксинина. Полный синтез dl-пикротоксадиена». Журнал Американского химического общества. 74 (12): 3046–3051. Дои:10.1021 / ja01132a028.
- ^ В. Г. Ван дер Клоот; Дж. Роббинс; И. Кук (1958). «Блокирование пикротоксином периферического торможения у раков». Наука. 127: 52l – 522.
- ^ Ро Дж. М., Доневан С. Д., Рогавски М. А. (декабрь 1996 г.). «Прямая активация рецепторов ГАМКа барбитуратами в культивируемых нейронах гиппокампа крыс». Журнал физиологии. 497 (Pt 2) (2): 509–22. Дои:10.1113 / jphysiol.1996.sp021784. ЧВК 1161000. PMID 8961191.
- ^ Ло В, Нокс С., Джумбоу Й., Джуисон Т., Го А.С., Лю И и др. «Пикротоксин». DrugBank. DrugBank. Получено 26 апреля, 2017.
- ^ Olsen RW (апрель 2006 г.). «Блокаторы пикротоксиноподобных каналов ГАМК-рецепторов». Труды Национальной академии наук Соединенных Штатов Америки. 103 (16): 6081–2. Bibcode:2006PNAS..103.6081O. Дои:10.1073 / pnas.0601121103. ЧВК 1458832. PMID 16606858.
- ^ Newland CF, Cull-Candy SG (февраль 1992 г.). «О механизме действия пикротоксина на каналы рецепторов ГАМК в диссоциированных симпатических нейронах крысы». Журнал физиологии. 447: 191–213. Дои:10.1113 / jphysiol.1992.sp018998. ЧВК 1176032. PMID 1317428.
- ^ «Пикротоксин» (PDF). Санта-Крус Биотехнологии. Получено 26 апреля, 2017.
- ^ «Пикротоксин». Toxnet. Национальная медицинская лаборатория США. Получено 26 апреля, 2017.
- ^ Нильссон Э, Эйрих Б (2009). «О лечении отравления барбитуратами». Acta Medica Scandinavica. 137 (6): 381–9. Дои:10.1111 / j.0954-6820.1950.tb12129.x. PMID 15432128.
- ^ «Единое руководство по классификации посторонних веществ, рекомендуемые наказания и типовое правило» (PDF). Международная ассоциация гоночных комиссаров, Inc.. Получено 26 апреля, 2017.
- ^ Lemoreaux P (2 сентября 2017 г.). «Два дрессировщика Квортер-Хорса отстранены от занятий за нарушение правил обращения с наркотиками в Прери-Мидоуз». Ежедневная гоночная форма. Ежедневная гоночная форма. Получено 26 апреля, 2017.
дальнейшее чтение
- Эренбергер К., Бенко Э, Феликс Д. (1982). «Подавляющее действие пикротоксина, антагониста ГАМК, на лабиринтный спонтанный нистагм и головокружение у человека». Acta Oto-Laryngologica. 93 (1–6): 269–73. Дои:10.3109/00016488209130882. PMID 7064710.
- Дюпон Л., Дидеберг О., Ламот-Брассер Дж, Ангено Л. (1976). "Структура кристаллического и молекулярного пикротоксина, C15ЧАС16О6· C15ЧАС18О7". Acta Crystallographica B (На французском). 32 (11): 2987–2993. Дои:10.1107 / S0567740876009424.
- Олсен RW, DeLorey TM (1999). «Физиология и фармакология рецепторов ГАМК». В Siegel GJ, Agranoff BW, Albers RW и др. (ред.). Основы нейрохимии: молекулярные, клеточные и медицинские аспекты (6-е изд.). Филадельфия, Пенсильвания, США: Липпинкотт-Рэйвен.