Цезий - Википедия - Caesium
 | ||||||||||||||||||||||||||||
| Цезий | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | /ˈsяzяəм/ | |||||||||||||||||||||||||||
| альтернативное имя | цезий (США, неофициальный) | |||||||||||||||||||||||||||
| Внешность | бледное золото | |||||||||||||||||||||||||||
| Стандартный атомный вес Аг, стд(Cs) | 132.90545196(6)[1] | |||||||||||||||||||||||||||
| Цезий в периодическая таблица | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Атомный номер (Z) | 55 | |||||||||||||||||||||||||||
| Группа | группа 1: H и щелочные металлы | |||||||||||||||||||||||||||
| Период | период 6 | |||||||||||||||||||||||||||
| Блокировать | s-блок | |||||||||||||||||||||||||||
| Категория элемента | Щелочной металл | |||||||||||||||||||||||||||
| Электронная конфигурация | [Xe ] 6s1 | |||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||
| Фаза вSTP | твердый | |||||||||||||||||||||||||||
| Температура плавления | 301.7 K (28,5 ° С, 83,3 ° F) | |||||||||||||||||||||||||||
| Точка кипения | 944 К (671 ° С, 1240 ° F) | |||||||||||||||||||||||||||
| Плотность (возлеr.t.) | 1,93 г / см3 | |||||||||||||||||||||||||||
| в жидком состоянии (приm.p.) | 1,843 г / см3 | |||||||||||||||||||||||||||
| Критическая точка | 1938 К, 9,4 МПа[2] | |||||||||||||||||||||||||||
| Теплота плавления | 2.09 кДж / моль | |||||||||||||||||||||||||||
| Теплота испарения | 63,9 кДж / моль | |||||||||||||||||||||||||||
| Молярная теплоемкость | 32,210 Дж / (моль · К) | |||||||||||||||||||||||||||
Давление газа
| ||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||
| Состояния окисления | −1, +1[3] (сильно базовый окись) | |||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 0,79 | |||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||
| Радиус атома | эмпирические: 265вечера | |||||||||||||||||||||||||||
| Ковалентный радиус | 244 ± 11 вечера | |||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 343 вечера | |||||||||||||||||||||||||||
| Другие свойства | ||||||||||||||||||||||||||||
| Естественное явление | изначальный | |||||||||||||||||||||||||||
| Кристальная структура | объемно-центрированный кубический (скрытая копия) | |||||||||||||||||||||||||||
| Тепловое расширение | 97 мкм / (м · К) (при 25 ° C) | |||||||||||||||||||||||||||
| Теплопроводность | 35,9 Вт / (м · К) | |||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 205 нОм · м (при 20 ° C) | |||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный[4] | |||||||||||||||||||||||||||
| Модуль для младших | 1,7 ГПа | |||||||||||||||||||||||||||
| Объемный модуль | 1,6 ГПа | |||||||||||||||||||||||||||
| Твердость по Моосу | 0.2 | |||||||||||||||||||||||||||
| Твердость по Бринеллю | 0,14 МПа | |||||||||||||||||||||||||||
| Количество CAS | 7440-46-2 | |||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||
| Именование | с латыни цезий, небесно-голубой, за его спектральные цвета | |||||||||||||||||||||||||||
| Открытие | Роберт Бунзен и Густав Кирхгоф (1860) | |||||||||||||||||||||||||||
| Первая изоляция | Карл Сеттерберг (1882) | |||||||||||||||||||||||||||
| Главный изотопы цезия | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Цезий (ИЮПАК написание[6]) (также пишется цезий в Американский английский )[примечание 1] это химический элемент с символ CS и атомный номер 55. Это мягкий, серебристо-золотой щелочной металл с температурой плавления 28,5 ° C (83,3 ° F), что делает его одним из пяти элементарных металлы которые жидкие в или около комнатная температура.[заметка 2] Цезий имеет физические и химические свойства, аналогичные свойствам рубидий и калий. Самый реактивный из всех металлов, это пирофорный и реагирует с водой даже при -116 ° C (-177 ° F). Это наименьшее электроотрицательный элемент со значением 0,79 на Шкала Полинга. В нем есть только один стабильный изотоп, цезий-133. Цезий добывается в основном из поллюцит, в то время как радиоизотопы, особенно цезий-137, а продукт деления, извлекаются из отходов производства ядерные реакторы.
Немецкий химик Роберт Бунзен и физик Густав Кирхгоф открыл цезий в 1860 г. по новому разработанному методу спектроскопия пламени. Первые небольшие применения цезия были как "добытчик " в вакуумные трубки И в фотоэлементы. В 1967 г. Эйнштейна доказательство того, что скорость света - самое постоянное измерение во Вселенной, Международная система единиц использовали два конкретных волновых счета от спектр излучения цезия-133 для определения второй и метр. С тех пор цезий широко используется в высокоточных атомные часы.
С 1990-х годов крупнейшая применение элемента был как формиат цезия за буровые растворы, но он имеет ряд применений в производстве электроэнергии, в электронике и химии. Радиоактивный изотоп цезий-137 имеет период полураспада около 30 лет и используется в медицине, промышленных приборах и гидрологии. Нерадиоактивные соединения цезия лишь незначительно токсичный, но склонность чистого металла к взрывной реакции с водой означает, что цезий считается опасным материалом, а радиоизотопы представляют значительную опасность для здоровья и окружающей среды.
Характеристики
Физические свойства

Цезий - самый мягкий элемент (его твердость 0,2 по шкале Мооса). Это очень пластичный, бледный металл, который темнеет в присутствии следовых количеств кислород.[11][12][13] Когда в присутствии минеральное масло (там, где его лучше всего хранить во время транспортировки), он теряет металлический блеск и приобретает более тусклый, серый вид. Оно имеет температура плавления 28,5 ° C (83,3 ° F), что делает его одним из немногих элементарных металлов, находящихся в жидком состоянии вблизи комнатная температура. Меркурий это единственный стабильный элементарный металл с известной температурой плавления ниже, чем цезий.[заметка 3][15] К тому же металл имеет довольно низкую точка кипения, 641 ° C (1186 ° F), самый низкий всех металлов, кроме ртути.[16] Его соединения горят синим[17][18] или фиолетовый[18] цвет.

Формы цезия сплавы с другими щелочными металлами, золото, и ртуть (амальгамы ). При температурах ниже 650 ° C (1202 ° F) он не сплавится с кобальт, утюг, молибден, никель, платина, тантал, или же вольфрам. Он образует четко определенные интерметаллические соединения с сурьма, галлий, индий, и торий, которые светочувствительный.[11] Он смешивается со всеми другими щелочными металлами (кроме лития); сплав с коренной зуб распределение 41% цезия, 47% калий, и 12% натрий имеет самую низкую температуру плавления среди всех известных металлических сплавов при -78 ° C (-108 ° F).[15][19] Были изучены несколько амальгам: CsHg
2 черный с пурпурным металлом блеск, а CsHg имеет золотистый цвет, также с металлическим блеском.[20]
Золотой цвет цезия происходит из-за уменьшения частоты света, необходимого для возбуждения электронов щелочных металлов по мере того, как группа передается по наследству. Для лития через рубидий эта частота находится в ультрафиолете, но для цезия она входит в сине-фиолетовый конец спектра; другими словами, плазмонная частота щелочных металлов становится ниже от лития до цезия. Таким образом, цезий преимущественно пропускает и частично поглощает фиолетовый свет, тогда как другие цвета (имеющие более низкую частоту) отражаются; поэтому он кажется желтоватым.[21]
Химические свойства
Металлический цезий очень реакционноспособен и очень пирофорный. Он самовоспламеняется на воздухе и взрывоопасно реагирует с водой даже при низких температурах, в большей степени, чем другие щелочные металлы (первая группа из периодическая таблица ).[11] Он вступает в реакцию со льдом при температурах до -116 ° C (-177 ° F).[15] Из-за этой высокой реакционной способности металлический цезий классифицируется как Опасный материал. Он хранится и отправляется в сухих насыщенных углеводородах, таких как минеральное масло. С ним можно справиться только под инертный газ, Такие как аргон. Однако взрыв цезий-вода часто бывает менее мощным, чем взрыв натрий -водяной взрыв с таким же количеством натрия. Это связано с тем, что цезий мгновенно взрывается при контакте с водой, оставляя мало времени для накопления водорода.[22] Цезий можно хранить в вакуумной упаковке. боросиликатное стекло ампулы. В количествах более 100 граммов (3,5 унции) цезий поставляется в герметично закрытых контейнерах из нержавеющей стали.[11]
Химический состав цезия подобен химическому составу других щелочных металлов, в частности рубидий, элемент выше цезия в периодической таблице.[23] Как и ожидалось для щелочного металла, единственная обычная степень окисления +1.[примечание 4] Некоторые небольшие различия возникают из-за того, что он имеет более высокую атомная масса и больше электроположительный чем другие (нерадиоактивные) щелочные металлы.[25] Цезий - самый электроположительный химический элемент.[примечание 5][15] Ион цезия также больше и менее "жесткий" чем у зажигалок щелочных металлов.
Соединения
Большинство соединений цезия содержат элемент в виде катион CS+
, который связывается ионно к широкому кругу анионы. Одно примечательное исключение - caeside анион (CS−
),[3] и другие - несколько субоксидов (см. раздел об оксидах ниже).
Соли Cs+ обычно бесцветны, если сам анион не окрашен. Многие из простых солей гигроскопичный, но в меньшей степени, чем соответствующие соли более легких щелочных металлов. В фосфат,[27] ацетат, карбонат, галогениды, окись, нитрат, и сульфат соли водорастворимы. Двойные соли часто менее растворимы, и низкая растворимость сульфата цезия-алюминия используется при очистке Cs из руд. Двойная соль с сурьмой (например, CsSbCl
4), висмут, кадмий, медь, утюг, и вести также плохо растворимый.[11]
Гидроксид цезия (CsOH) гигроскопичен и сильно базовый.[23] Это быстро травления поверхность полупроводники Такие как кремний.[28] CsOH ранее считался химиками «сильнейшим основанием», что отражает относительно слабое притяжение между большими группами Cs+ ион и ОН−;[17] это действительно самый сильный База Аррениуса, но ряд соединений, не растворяющихся в воде, таких как п-бутиллитий и амид натрия,[23] более простые.
А стехиометрический смесь цезия и золото будет реагировать на образование желтого цвета аурид цезия (Cs+Au−) при нагревании. Аурид-анион здесь ведет себя как псевдогалоген. Соединение бурно реагирует с водой, давая гидроксид цезия, металлическое золото и водород; в жидком аммиаке он может реагировать с цезий-специфической ионообменной смолой с образованием аурида тетраметиламмония. Аналогичный платина соединение, красный платинид цезия (Cs2Pt), содержит ион платинида, который ведет себя как псевдохалькоген.[29]
Комплексы
Как и все катионы металлов, Cs+ образует комплексы с Базы Льюиса в растворе. Из-за большого размера Cs+ обычно принимает координационные номера больше 6, число, характерное для катионов щелочных металлов меньшего размера. Это различие проявляется в 8-координации CsCl. Это высокое координационное число и мягкость (тенденция к образованию ковалентных связей) - это свойства, используемые при разделении Cs+ от других катионов при восстановлении ядерных отходов, где 137CS+ должны быть отделены от больших количеств нерадиоактивного K+.[30]
Галогениды
Фторид цезия (CsF) - это гигроскопичный белое твердое вещество, которое широко используется в фторорганическая химия как источник фторид анионы.[32] Фторид цезия имеет структуру галита, что означает, что Cs+ и F− упаковать в кубическая плотнейшая упаковка массив как Na+ и Cl− в хлорид натрия.[23] Примечательно, что цезий и фтор имеют самые низкие и самые высокие электроотрицательность соответственно среди всех известных элементов.
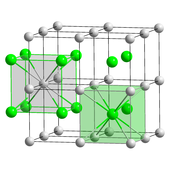
Хлорид цезия (CsCl) кристаллизуется в простом кубическая кристаллическая система. Также называется «структура хлорида цезия»,[25] этот структурный мотив состоит из примитивный кубическая решетка с двухатомным базисом, каждая из которых имеет восьмеричный координация; атомы хлора лежат в узлах решетки на краях куба, а атомы цезия - в отверстиях в центре куба. Эта структура используется совместно с CsBr и CsI, и многие другие соединения, не содержащие Cs. Напротив, большинство других щелочных галогенидов имеют хлорид натрия (NaCl) структура.[25] Структура CsCl предпочтительна, потому что Cs+ имеет ионный радиус из 174вечера и Cl−
181 вечера.[33]
Оксиды

11О
3 кластер
В большей степени, чем другие щелочные металлы, цезий образует многочисленные бинарные соединения с кислород. Когда цезий горит на воздухе, супероксид CSO
2 это основной продукт.[34] Нормальный" оксид цезия (CS
2О) образует желто-оранжевый шестиугольник кристаллы[35] и является единственным оксидом анти-CdCl
2 тип.[36] Он испаряется при 250 ° C (482 ° F) и разлагается на металлический цезий и перекись CS
2О
2 при температуре выше 400 ° C (752 ° F). Помимо супероксида и озонид CSO
3,[37][38] несколько ярких субоксиды также были изучены.[39] К ним относятся CS
7О, CS
4О, CS
11О
3, CS
3О (темно-зеленый[40]), CsO, CS
3О
2,[41] а также CS
7О
2.[42][43] Последний можно нагреть в вакууме для получения CS
2О.[36] Бинарные соединения с сера, селен, и теллур тоже существуют.[11]
Изотопы
Цезий имеет 39 известных изотопы, начиная с массовое число (т.е. количество нуклоны в ядре) от 112 до 151. Некоторые из них синтезируются из более легких элементов в процессе медленного захвата нейтронов (S-процесс ) внутри старых звезд[44] и по R-процесс в сверхновая звезда взрывы.[45] Единственный стабильный изотоп цезия 133Cs, с 78 нейтроны. Хотя у него большой ядерное вращение (7/2+), ядерный магнитный резонанс исследования могут использовать этот изотоп на резонансной частоте 11,7МГц.[46]

Радиоактивный 135CS имеет очень длительный период полураспада около 2,3 миллиона лет, самый длинный из всех радиоактивных изотопов цезия. 137CS и 134CS имеют период полураспада 30 и два года соответственно. 137Cs разлагается на недолговечный 137 кв.м.Ба к бета-распад, а затем в нерадиоактивный барий, а 134Cs превращается в 134Ба прямо. Изотопы с массовыми числами 129, 131, 132 и 136 имеют период полураспада от дня до двух недель, в то время как большинство других изотопов имеют период полураспада от нескольких секунд до долей секунды. По крайней мере 21 метастабильный ядерные изомеры существовать. Кроме как 134 кв.м.Cs (с периодом полураспада чуть менее 3 часов), все очень нестабильны и распадаются с периодом полураспада несколько минут или меньше.[47][48]
Изотоп 135Cs является одним из долгоживущие продукты деления из уран произведено в ядерные реакторы.[49] Однако это выход продуктов деления уменьшается в большинстве реакторов, потому что предшественник, 135Xe, это мощный нейтронный яд и часто превращается в стабильный 136Xe прежде чем он сможет распасться 135Cs.[50][51]
В бета-распад из 137CS к 137 кв.м.Ba - сильное излучение гамма-излучение.[52] 137CS и 90Sr являются главными средножитный продукты ядерное деление, и первоисточники радиоактивность из отработанное ядерное топливо после нескольких лет охлаждения, длящегося несколько сотен лет.[53] Эти два изотопа являются крупнейшим источником остаточной радиоактивности в районе Чернобыльская катастрофа.[54] Из-за низкой скорости захвата утилизация 137Cs через захват нейтронов это неосуществимо, и единственное текущее решение - позволить ему распадаться со временем.[55]
Почти весь цезий, образующийся при делении ядер, происходит из бета-распад первоначально более богатых нейтронами продуктов деления, проходящих через различные изотопы йода и ксенон.[56] Поскольку йод и ксенон летучие и могут диффундировать через ядерное топливо или воздух, радиоактивный цезий часто образуется далеко от исходного места деления.[57] С испытания ядерного оружия в 1950-1980-х гг., 137CS был выпущен в атмосфера и вернулся на поверхность земли в составе радиоактивные осадки. Это готовый маркер движения почвы и наносов тех времен.[11]
Вхождение

Цезий - относительно редкий элемент, по оценкам в среднем 3частей на миллион в земной коры.[58] Это 45-й элемент по распространенности и 36-й среди металлов. Тем не менее, он более распространен, чем такие элементы, как сурьма, кадмий, банка, и вольфрам, и на два порядка больше, чем ртуть и серебро; это на 3,3% больше, чем рубидий, с которым он тесно связан химически.[11]
Из-за большого ионный радиус, цезий является одним из "несовместимые элементы ".[59] В течение кристаллизация магмы, цезий концентрируется в жидкой фазе и кристаллизуется в последнюю очередь. Поэтому крупнейшие месторождения цезия - зональные. пегматит рудные тела, образованные в результате этого процесса обогащения. Поскольку цезий не заменяет калий так же легко, как рубидий, щелочные минералы эвапорита сильвит (KCl) и карналлит (KMgCl
3· 6H
2О) может содержать всего 0,002% цезия. Следовательно, цезий содержится в нескольких минералах. Процентные количества цезия могут быть найдены в берилл (Быть
3Al
2(SiO
3)
6) и авогадрит ((K, Cs) BF
4), до 15 мас.% Cs2O в близком минерале пеццоттаит (Cs (Be
2Ли) Аль
2Si
6О
18), до 8,4 мас.% Cs2O в редком минерале лондонит ((Cs, K) Al
4Быть
4(B, Be)
12О
28), и меньше в более распространенных родизит.[11] Единственная экономически важная руда для цезия - это поллюцит Cs (AlSi
2О
6), который встречается в нескольких местах по всему миру в зональных пегматитах, связанных с более коммерчески важными литий минералы, лепидолит и петалит. В пегматитах крупный размер зерна и сильное разделение минералов приводят к получению руды с высоким содержанием для добычи.[60]
Самым значительным и богатым известным источником цезия в мире является Танко Шахта в Bernic Lake в Манитоба, Канада, насчитывает 350 000метрических тонн поллуцитовой руды, составляющей более двух третей мировых запасов.[60][61] Хотя стехиометрическое содержание цезия в поллуците составляет 42,6%, чистые образцы поллуцита из этого месторождения содержат только около 34% цезия, в то время как среднее содержание составляет 24 мас.%.[61] Промышленный поллуцит содержит более 19% цезия.[62] В Бикита месторождение пегматита в Зимбабве добывается для его петалита, но он также содержит значительное количество поллуцита. Еще один заметный источник поллуцита находится в Пустыня Карибиб, Намибия.[61] При нынешних темпах добычи в мире от 5 до 10 метрических тонн в год запасов хватит на тысячи лет.[11]
Производство
Добыча и переработка поллуцитовой руды - это селективный процесс, который ведется в меньших масштабах, чем для большинства других металлов. Руда дробится, сортируется вручную, но обычно не концентрируется, а затем измельчается. Затем цезий извлекается из поллуцита в основном тремя способами: кислотным разложением, щелочным разложением и прямым восстановлением.[11][63]
При кислотном пищеварении силикат поллуцит растворяется сильными кислотами, такими как соляной (HCl), серный (ЧАС
2ТАК
4), бромистоводородный (HBr), или плавиковый (HF) кислоты. С соляной кислотой образуется смесь растворимых хлоридов, и нерастворимые хлоридные двойные соли цезия осаждаются в виде хлорида цезия и сурьмы (CS
4SbCl
7), цезия йода хлорид (CS
2ICl) или гексахлорцерат цезия (CS
2(CeCl
6)). После разделения чистая осажденная двойная соль разлагается, а чистый CsCl осаждается путем испарения воды.
Метод серной кислоты дает нерастворимую двойную соль непосредственно в виде цезия. квасцы (CsAl (SO
4)
2· 12H
2О). В сульфат алюминия компонент превращается в нерастворимый оксид алюминия обжаривая квасцы с углерод, и полученный продукт выщелоченный с водой, чтобы получить CS
2ТАК
4 решение.[11]
Обжарка поллуцита с карбонат кальция и хлорид кальция дает нерастворимые силикаты кальция и растворимый хлорид цезия. Выщелачивание водой или разбавленным аммиак (NH
4ОЙ) дает разбавленный раствор хлорида (CsCl). Этот раствор можно упарить для получения хлорида цезия или превратить в квасцы цезия или карбонат цезия. Хотя это и нецелесообразно с коммерческой точки зрения, руда может быть восстановлена напрямую калием, натрием или кальцием в вакууме, что позволяет получить металлический цезий напрямую.[11]
Большая часть добытого цезия (в виде солей) напрямую превращается в формиат цезия (HCOO−CS+) для таких приложений, как бурение нефтяных скважин. Для обеспечения развивающегося рынка, Cabot Corporation построил производственный завод в 1997 году на руднике Танко около озера Берник в Манитобе, мощностью 12000 баррелей (1900 м3) в год раствора формиата цезия.[64] Основными коммерческими соединениями цезия в небольших масштабах являются: хлорид цезия и нитрат.[65]
Альтернативно металлический цезий может быть получен из очищенных соединений, полученных из руды. Хлорид цезия и другие галогениды цезия можно восстановить при температуре от 700 до 800 ° C (от 1292 до 1472 ° F) с помощью кальция или барий, и металлический цезий, полученный дистилляцией. Таким же образом алюминат, карбонат или гидроксид могут быть восстановлены путем магний.[11]
Металл также можно изолировать электролиз плавленого цезия цианид (CsCN). Исключительно чистый и безгазовый цезий можно получить путем термического разложения цезия при температуре 390 ° C (734 ° F). азид CsN
3, который может быть получен из водного сульфата цезия и азида бария.[63] В вакуумных приложениях цезий дихромат можно отреагировать с цирконий для производства чистого металлического цезия без других газообразных продуктов.[65]
- CS
2Cr
2О
7 + 2 Zr → 2 CS + 2 ZrO
2+ Cr
2О
3
Цена на цезий с чистотой 99,8% (металлическая основа) в 2009 году составляла около 10 долларов за грамм (280 долларов за унцию), но эти соединения значительно дешевле.[61]
История

В 1860 г. Роберт Бунзен и Густав Кирхгоф открыл цезий в минеральная вода из Дюркгейм, Германия. Из-за ярких синих линий на спектр излучения, они получили название от латинский слово цезий, что означает небесно-голубой.[примечание 6][66][67][68] Цезий был первым элементом, обнаруженным с спектроскоп, который был изобретен Бунзеном и Кирхгофом всего год назад.[15]
Чтобы получить чистый образец цезия, 44 000 литров (9 700 имп галлонов; 12 000 галлонов США) необходимо было выпарить, чтобы получить 240 килограммов (530 фунтов) концентрированного солевого раствора. В щелочноземельные металлы осаждались либо в виде сульфатов, либо оксалаты, оставляя щелочной металл в растворе. После преобразования в нитраты и добыча с этиловый спирт была получена смесь без натрия. Из этой смеси литий осаждали карбонат аммония. Калий, рубидий и цезий образуют нерастворимые соли с платинохлористоводородная кислота, но эти соли имеют небольшую разницу в растворимости в горячей воде, а менее растворимые гексахлороплатинаты цезия и рубидия ((Cs, Rb)2PtCl6) были получены фракционная кристаллизация. После восстановления гексахлороплатината с помощью водород, цезий и рубидий были разделены по разнице растворимости их карбонатов в спирте. В результате получено 9,2 грамма (0,32 унции) рубидий хлорид и 7,3 грамма (0,26 унции) хлорида цезия из первоначальных 44 000 литров минеральной воды.[67]
Из хлорида цезия двое ученых оценили атомный вес нового элемента на уровне 123,35 (по сравнению с принятым в настоящее время значением 132,9).[67] Они пытались получить элементарный цезий электролизом расплавленного хлорида цезия, но вместо металла они получили синее гомогенное вещество, которое «ни под невооруженным глазом, ни под микроскопом не показало ни малейшего следа металлического вещества»; в результате они присвоили ему статус субхлорид (CS
2Cl). На самом деле продукт, вероятно, был коллоидный смесь металла и хлорида цезия.[69] Электролиз водного раствора хлорида с ртутным катодом дает амальгаму цезия, которая легко разлагается в водных условиях.[67] В конечном итоге чистый металл был выделен немецким химиком. Карл Сеттерберг во время работы над докторской степенью с Кекуле и Бунзен.[68] В 1882 году он произвел металлический цезий электролизом. цианид цезия, избегая проблем с хлоридом.[70]
Исторически наиболее важным применением цезия были исследования и разработки, прежде всего в химической и электрической областях. До 1920-х годов, когда цезий начал использоваться в радио, было очень мало приложений. вакуумные трубки, где у него было две функции; как добытчик, он удалял избыток кислорода после производства и в качестве покрытия на нагретом катод, это увеличило электрическая проводимость. Цезий не считался промышленным металлом с высокими характеристиками до 1950-х годов.[71] Приложения для нерадиоактивного цезия включены фотоэлементы, фотоумножитель трубки, оптические компоненты инфракрасные спектрофотометры, катализаторы нескольких органических реакций, кристаллы для сцинтилляционные счетчики, И в магнитогидродинамические генераторы энергии.[11] Цезий также использовался и остается источником положительных ионов в вторично-ионная масс-спектрометрия (SIMS).
С 1967 г. Международная система измерений основал вторую единицу времени на свойствах цезия. Международная система единиц (СИ) определяет вторую как продолжительность 9 192 631 770 циклов в микроволновая печь частота из спектральная линия соответствует переходу между двумя сверхтонкий уровни энергии из основное состояние из цезий-133.[72] 13-й Генеральная конференция по мерам и весам 1967 года определил секунду как: «продолжительность 9 192 631 770 циклов микроволнового света, поглощаемого или испускаемого сверхтонким переходом атомов цезия-133 в их основном состоянии, не нарушенном внешними полями».
Приложения
Разведка нефти
Наибольшее количество нерадиоактивного цезия в настоящее время используется в формиат цезия буровые растворы для добывающая нефтяная промышленность.[11] Водные растворы формиата цезия (HCOO−CS+) - образуется при взаимодействии гидроксида цезия с муравьиная кислота - были разработаны в середине 1990-х годов для использования при бурении нефтяных скважин и жидкости заканчивания. Буровой раствор предназначен для смазки буровых долот, вывода выбуренной породы на поверхность и поддержания давления на пласт во время бурения скважины. Жидкости для заканчивания способствуют установке контрольного оборудования после бурения, но до начала добычи, поддерживая давление.[11]
Высокая плотность рассола формиата цезия (до 2,3 г / см3, или 19,2 фунта на галлон),[73] в сочетании с относительно безвредной природой большинства соединений цезия снижает потребность в токсичных взвешенных твердых частицах высокой плотности в буровом растворе - значительное технологическое, инженерное и экологическое преимущество. В отличие от компонентов многих других тяжелых жидкостей, формиат цезия относительно безопасен для окружающей среды.[73] Рассол формиата цезия можно смешивать с формиатами калия и натрия для уменьшения плотности жидкости до плотности воды (1,0 г / см3, или 8,3 фунта на галлон). Кроме того, он поддается биологическому разложению и может быть переработан, что важно ввиду его высокой стоимости (около 4000 долларов за штуку). бочка в 2001).[74] Формиаты щелочей безопасны в обращении и не повреждают продуктивный пласт или забойные металлы в качестве коррозионной альтернативы, рассолы высокой плотности (такие как бромид цинка ZnBr
2 решения) иногда делают; они также требуют меньшего количества очистки и сокращают затраты на утилизацию.[11]
Атомные часы


На основе цезия атомные часы использовать электромагнитные переходы в сверхтонкая структура атомов цезия-133 в качестве ориентира. Первые точные цезиевые часы были построены Луи Эссен в 1955 г. на Национальная физическая лаборатория в Соединенном Королевстве.[75] Цезиевые часы улучшились за последние полвека и считаются «наиболее точной реализацией единицы измерения, которую человечество когда-либо достигло».[72] Эти часы измеряют частоту с погрешностью от 2 до 3 частей из 10.14, что соответствует точности 2наносекунды в сутки, или одну секунду за 1,4 миллиона лет. Последние версии точнее, чем 1 часть из 1015, примерно 1 секунда за 20 миллионов лет.[11] В цезиевый стандарт является основным стандартом для измерения времени и частоты в соответствии со стандартами.[76] Цезиевые часы регулируют синхронизацию сетей сотовой связи и Интернета.[77]
Единицы СИ
Второй символ s - это единица времени в системе СИ. Он определяется путем принятия фиксированного числового значения частоты цезия. ΔνCS, невозмущенная частота сверхтонкого перехода в основное состояние атома цезия-133 должна быть 9192631770 при выражении в единицах Гц, что равно s−1.
Электроэнергетика и электроника
Пары цезия термоэмиссионные генераторы маломощные устройства, преобразующие тепловую энергию в электрическую. В двухэлектродном вакуумная труба В преобразователе цезий нейтрализует объемный заряд возле катода и усиливает ток.[78]
Цезий также важен для фотоэмиссионный свойства, превращающие свет в электронный поток. Он используется в фотоэлементы потому что катоды на основе цезия, такие как интерметаллид K
2CsSb, имеют низкое пороговое напряжение для излучения электроны.[79] Спектр фотоэмиссионных устройств, использующих цезий, включает: оптическое распознавание символов устройства, фотоумножители, и трубки видеокамеры.[80][81] Тем не менее, германий рубидий, селен, кремний, теллур и некоторые другие элементы могут заменять цезий в светочувствительных материалах.[11]
Йодид цезия (CsI), бромид (CsBr) и кристаллы фторида цезия (CsF) используются для сцинтилляторы в сцинтилляционные счетчики широко используется при разведке полезных ископаемых и исследованиях физики частиц для обнаружения гамма и рентгеновский снимок радиация. Как тяжелый элемент, цезий обеспечивает хорошую останавливающую способность с лучшим обнаружением. Соединения цезия могут обеспечивать более быстрый отклик (CsF) и быть менее гигроскопичными (CsI).
Пары цезия используются во многих магнитометры.[82]
Элемент используется как внутренний стандарт в спектрофотометрия.[83] Как и другие щелочных металлов, цезий имеет большое сродство к кислород и используется как "добытчик " в вакуумные трубки.[84] Другие области применения металла включают высокоэнергетические лазеры, паровые лампы накаливания, и пар выпрямители.[11]
Жидкости для центрифугирования
Высокая плотность иона цезия делает растворы хлорида цезия, сульфата цезия и цезия трифторацетат (Cs (O
2CCF
3)) полезно в молекулярной биологии для градиента плотности ультрацентрифугирование.[85] Эта технология используется в первую очередь для изоляции вирусные частицы, субклеточный органеллы и дроби, и нуклеиновые кислоты из биологических образцов.[86]
Химическое и медицинское использование

Относительно небольшое количество химических применений используют цезий.[87] Допирование соединениями цезия повышает эффективность некоторых металло-ионных катализаторов химического синтеза, таких как акриловая кислота, антрахинон, окись этилена, метанол, фталевый ангидрид, стирол, метилметакрилат мономеры и различные олефины. Он также используется в каталитической конверсии диоксид серы в триоксид серы в производстве серная кислота.[11]
Фторид цезия пользуется нишей в органическая химия как основание[23] и как безводный источник фторид ион.[88] Соли цезия иногда заменяют соли калия или натрия в органический синтез, Такие как циклизация, этерификация, и полимеризация. Цезий также использовался в термолюминесцентном излучении. дозиметрия (TLD): Под воздействием радиации он приобретает дефекты кристаллов, которые при нагревании меняют вид с испусканием света пропорционально полученной дозе. Таким образом, измерение светового импульса с помощью фотоумножитель может позволить количественно оценить накопленную дозу облучения.
Ядерные и изотопные приложения
Цезий-137 это радиоизотоп обычно используется как гамма -эмиттер в промышленных приложениях. Его преимущества включают период полураспада примерно 30 лет, его доступность из ядерный топливный цикл, и имея 137Ба как стабильный конечный продукт. Высокая растворимость в воде является недостатком, из-за которого он несовместим с облучателями больших бассейнов для пищевых продуктов и медицинских принадлежностей.[89] Он использовался в сельском хозяйстве, лечении рака и стерилизация пищевых продуктов, осадка сточных вод и хирургического оборудования.[11][90] Радиоактивный изотопы цезия в радиационные устройства использовались в медицине для лечения некоторых видов рака,[91] но появление более эффективных альтернатив и использование водорастворимого хлорида цезия в источниках, что могло вызвать широкомасштабное загрязнение, постепенно привело к прекращению использования некоторых из этих источников цезия.[92][93] Цезий-137 используется в различных промышленных измерительных приборах, включая датчики влажности, плотности, нивелирования и толщины.[94] Он также использовался в каротаж устройства для измерения электронная плотность скальных образований, что аналогично насыпной плотности образований.[95]
Цезий-137 использовался в гидрологический исследования, аналогичные тем с тритий. В качестве дочернего продукта испытаний бомбы деления с 1950-х до середины 1980-х цезий-137 был выпущен в атмосферу, где он легко поглощался в раствор. Известные межгодовые колебания в течение этого периода позволяют коррелировать с слоями почвы и отложений. Цезий-134 и, в меньшей степени, цезий-135 также использовались в гидрологии для измерения выхода цезия в атомной энергетике. Хотя они менее распространены, чем цезий-133 или цезий-137, эти опорные изотопы производятся исключительно из антропогенных источников.[96]
Другое использование

Цезий и ртуть использовались в качестве топлива в начале ионные двигатели предназначен для двигательная установка космического корабля в очень длительных межпланетных или внепланетных миссиях. Ионизация топлива происходила при контакте с заряженным вольфрам электрод. Но коррозия компонентов космических аппаратов цезием подтолкнула разработку в направлении создания ракетного топлива инертного газа, такого как ксенон, с которыми легче справиться при наземных испытаниях и которые наносят меньший ущерб космическому кораблю.[11] Ксенон использовался в экспериментальном космическом корабле Глубокий космос 1 запущен в 1998 году.[97][98] Тем не менее, автоэмиссионная электрическая силовая установка были построены двигатели, которые ускоряют ионы жидких металлов, таких как цезий.[99]
Нитрат цезия используется как окислитель и пиротехнический краситель сжечь кремний в инфракрасный вспышки,[100] такие как вспышка ЛУУ-19,[101] потому что он излучает большую часть своего света в ближний инфракрасный спектр.[102] Цезий, возможно, был разработан для уменьшения радиолокационная сигнатура из выхлопные шлейфы в Локхид А-12 ЦРУ самолет-разведчик.[103] Цезий и рубидий добавлены в качестве карбонат к стеклу, потому что они уменьшают электропроводность и улучшают стабильность и долговечность волоконная оптика и ночное видение устройств. Фторид цезия или фторид цезия-алюминия используются во флюсах, разработанных для пайки. алюминий сплавы, содержащие магний.[11]
Магнитогидродинамическая (МГД) мощность -генерирующие системы были исследованы, но не получили широкого распространения.[104] Металлический цезий также считается рабочим телом в высокотемпературных Цикл Ренкина турбогенераторы.[105]
Соли цезия были оценены как противошоковые реагенты после введения мышьяковые препараты. Однако из-за их влияния на сердечный ритм они реже используются, чем соли калия или рубидия. Их также использовали для лечения эпилепсия.[11]
Цезий-133 может быть с лазерным охлаждением и используется для исследования фундаментальных и технологический проблемы в квантовая физика. Имеет особенно удобный Фешбах спектр для изучения ультрахолодные атомы требующие настраиваемых взаимодействий.[106]
Опасности для здоровья и безопасности
| Опасности | |
|---|---|
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H260, H314 | |
| P223, P231 + 232, P280, P305 + 351 + 338, P370 + 378, P422[107] | |
| NFPA 704 (огненный алмаз) | |

Нерадиоактивные соединения цезия только умеренно токсичны, а нерадиоактивный цезий не представляет значительной опасности для окружающей среды. Поскольку биохимические процессы могут спутать цезий и заменить его калий избыток цезия может привести к гипокалиемия, аритмия, и острый остановка сердца.[109] Но такие количества обычно не встречаются в природных источниках.[110]
В средняя смертельная доза (LD50) за хлорид цезия у мышей составляет 2,3 г на килограмм, что сопоставимо с LD50 ценности хлорид калия и хлорид натрия.[111] В основном нерадиоактивный цезий используется в качестве формиата цезия в нефти. буровые растворы потому что он гораздо менее токсичен, чем альтернативы, хотя и дороже.[73]
Металлический цезий является одним из наиболее реактивных элементов и очень взрывной в присутствии воды. Газообразный водород, образующийся в результате реакции, нагревается за счет одновременно выделяющейся тепловой энергии, вызывая возгорание и сильный взрыв. Это может происходить с другими щелочными металлами, но цезий настолько силен, что эту взрывную реакцию может вызвать даже холодная вода.[11]
Это очень пирофорный: the температура самовоспламенения цезия составляет -116 ° C (-177 ° F), и он взрывается на воздухе с образованием гидроксид цезия и различные оксиды. Гидроксид цезия - очень сильный основание, и быстро разъедает стекло.[16]
В изотопы 134 и 137 присутствуют в биосфера в небольших количествах в результате деятельности человека, различающихся по местонахождению. Радиоцезий накапливается в организме не так быстро, как другие продукты деления (например, радиоактивный йод и радиостронций). Около 10% поглощенного радиоактивного цезия относительно быстро вымывается из организма с потом и мочой. Остальные 90% имеют биологический период полураспада от 50 до 150 дней.[112] Радиоцезий следует за калием и имеет тенденцию накапливаться в тканях растений, включая фрукты и овощи.[113][114][115] Растения сильно различаются по усвоению цезия, иногда проявляя к нему большую устойчивость. Также хорошо известно, что грибы из загрязненных лесов накапливают радиоактивный цезий (цезий-137) в грибковых спорокарпий.[116] Накопление цезия-137 в озерах стало серьезной проблемой после Чернобыльская катастрофа.[117][118] Эксперименты с собаками показали, что разовая доза 3,8 милликюри (140 МБк, 4,1 мкг цезия-137) на килограмм летально в течение трех недель;[119] меньшие количества могут вызвать бесплодие и рак.[120] В Международное агентство по атомной энергии и другие источники предупреждали, что радиоактивные материалы, такие как цезий-137, могут использоваться в устройствах для рассеивания радиации, или "грязные бомбы ".[121]
Смотрите также
- Гоянская авария, крупный инцидент с радиоактивным загрязнением цезием-137 в 1987 году.
- Краматорская радиационная авария, еще один 137Инцидент с CS между 1980 и 1989 годами.
- Авария с Acerinox, авария с загрязнением цезием-137 в 1998 году.
Примечания
- ^ Цезий орфография рекомендуется Международный союз теоретической и прикладной химии (ИЮПАК).[7] В Американское химическое общество (ACS) использовал написание цезий с 1921 г.,[8][9] следующий Новый международный словарь Вебстера. Элемент назван в честь латинского слова цезий, что означает «голубовато-серый».[10] В средневековых и ранних произведениях Нового времени цезий был написан с лигатура æ в качестве Цезий; следовательно, альтернативой, но теперь уже старомодной орфографии является цезий. Более подробное объяснение правописания на ae / oe vs e.
- ^ Вместе с рубидий 39 ° С (102 ° F), франций (расчетная при 27 ° C [81 ° F]), Меркурий (-39 ° C [-38 ° F]), и галлий (30 ° C [86 ° F]); бром также является жидким при комнатной температуре (плавится при -7,2 ° C [19,0 ° F]), но это галоген а не металл. Предварительная работа с Copernicium и флеровий предполагает, что они являются газообразными металлами при комнатной температуре.
- ^ Радиоактивный элемент франций может также иметь более низкую точку плавления, но его радиоактивность не позволяет выделить его достаточное количество для прямого тестирования.[14] Копернициум и флеровий может также иметь более низкие температуры плавления.
- ^ Он отличается от этого значения тем, что содержат Cs− анион и, следовательно, цезий в степени окисления -1.[3] Кроме того, расчеты Мао-шэн Мяо за 2013 год показывают, что в условиях экстремального давления (более 30ГПа ), внутренние 5p-электроны могут образовывать химические связи, где цезий будет вести себя как седьмой 5p-элемент. Это открытие указывает на то, что высшие фториды цезия с цезием в степенях окисления от +2 до +6 могут существовать в таких условиях.[24]
- ^ Франций Электроположительность не измерялась экспериментально из-за высокой радиоактивности. Измерения первого энергия ионизации франция предполагают, что его релятивистские эффекты может снизить его реактивность и повысить его электроотрицательность выше ожидаемой периодические тенденции.[26]
- ^ Цитаты Бунзена Авл Геллий Ноктес Аттический II, 26 автор: Нигидиус Фигул: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
Рекомендации
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press. п. 4.121. ISBN 1439855110.
- ^ а б c Краситель, Дж. Л. (1979). «Соединения анионов щелочных металлов». Angewandte Chemie International Edition. 18 (8): 587–598. Дои:10.1002 / anie.197905871.
- ^ «Магнитная восприимчивость элементов и неорганических соединений». Справочник по химии и физике (PDF) (87-е изд.). CRC Press. ISBN 0-8493-0487-3. Получено 2010-09-26.
- ^ «Измерения периода полураспада радионуклидов NIST». NIST. Получено 2011-03-13.
- ^ «Периодическая таблица элементов ИЮПАК». Международный союз теоретической и прикладной химии.
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. С. 248–49. Электронная версия..
- ^ Coghill, Anne M .; Гарсон, Лоррин Р., ред. (2006). Руководство по стилю ACS: эффективная передача научной информации (3-е изд.). Вашингтон, округ Колумбия: Американское химическое общество. п.127. ISBN 978-0-8412-3999-9.
- ^ Coplen, T. B .; Пейзер, Х.С. (1998). «История рекомендуемых значений атомной массы с 1882 по 1997 год: сравнение отличий от текущих значений с оценочными неопределенностями более ранних значений» (PDF). Pure Appl. Chem. 70 (1): 237–257. Дои:10.1351 / pac199870010237.
- ^ Запись OED для "цезия". Издание второе, 1989 г .; онлайн-версия, июнь 2012 г. Дата обращения 7 сентября 2012 г. Более ранняя версия впервые опубликована в Новый английский словарь, 1888.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа Баттерман, Уильям С .; Брукс, Уильям Э .; Риз-младший, Роберт Г. (2004). «Профиль минерального сырья: цезий» (PDF). Геологическая служба США. Архивировано из оригинал (PDF) 7 февраля 2007 г.. Получено 2009-12-27.
- ^ Хейзерман, Дэвид Л. (1992). Изучение химических элементов и их соединений. Макгроу-Хилл. стр.201 –203. ISBN 978-0-8306-3015-8.
- ^ Аддисон, К. С. (1984). Химия жидких щелочных металлов.. Вайли. ISBN 978-0-471-90508-0. Получено 2012-09-28.
- ^ «Франций». Periodic.lanl.gov. Получено 2010-02-23.
- ^ а б c d е Канер, Ричард (2003). "C&EN: It's Elemental: Периодическая таблица - цезий". Американское химическое общество. Получено 2010-02-25.
- ^ а б «Химические данные - Цезий - Cs». Королевское химическое общество. Получено 2010-09-27.
- ^ а б Линч, Чарльз Т. (1974). Справочник CRC по материаловедению. CRC Press. п. 13. ISBN 978-0-8493-2321-8.
- ^ а б Кларк, Джим (2005). «Испытания пламенем». Chemguide. Получено 2012-01-29.
- ^ Таова, Т. М .; и другие. (22 июня 2003 г.). «Плотность расплавов щелочных металлов и их тройных систем Na-K-Cs и Na-K-Rb» (PDF). Пятнадцатый симпозиум по теплофизическим свойствам, Боулдер, Колорадо, США. Архивировано из оригинал (PDF) 9 октября 2006 г.. Получено 2010-09-26.
- ^ Дайзерот, Х. Дж. (1997). «Амальгамы щелочных металлов, группа необычных сплавов». Прогресс в химии твердого тела. 25 (1–2): 73–123. Дои:10.1016 / S0079-6786 (97) 81004-7.
- ^ Аддисон, К. С. (1984). Химия жидких щелочных металлов. Вайли. п. 7. ISBN 9780471905080.
- ^ Грей, Теодор (2012) Элементы, Black Dog & Leventhal Publishers, стр. 131, ISBN 1-57912-895-5.
- ^ а б c d е Greenwood, N. N .; Эрншоу, А. (1984). Химия элементов. Оксфорд, Великобритания: Pergamon Press. ISBN 978-0-08-022057-4.
- ^ Московиц, Клара. «Основное правило химии может быть нарушено, как показывают расчеты». Scientific American. Получено 2013-11-22.
- ^ а б c Холлеман, Арнольд Ф .; Виберг, Эгон; Виберг, Нильс (1985). "Vergleichende Übersicht über die Gruppe der Alkalimetalle". Lehrbuch der Anorganischen Chemie (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. С. 953–955. ISBN 978-3-11-007511-3.
- ^ Андреев, С. В .; Летохов, В. С .; Мишин, В. И. (1987). «Лазерная резонансная фотоионизационная спектроскопия ридберговских уровней в Fr». Письма с физическими проверками. 59 (12): 1274–76. Bibcode:1987ПхРвЛ..59.1274А. Дои:10.1103 / PhysRevLett.59.1274. PMID 10035190.
- ^ Хоган, К. М. (2011)."Фосфат". Архивировано из оригинал на 2012-10-25. Получено 2012-06-17. в Энциклопедия Земли. Йоргенсен, А. и Кливленд, Си-Джей (ред.). Национальный совет по науке и окружающей среде. Вашингтон, округ Колумбия
- ^ Келер, Майкл Дж. (1999). Травление в микросистемной технике. Wiley-VCH. п. 90. ISBN 978-3-527-29561-6.
- ^ Янсен, Мартин (30 ноября 2005 г.). «Влияние релятивистского движения электронов на химию золота и платины». Науки о твердом теле. 7 (12): 1464–1474. Bibcode:2005SSSci ... 7.1464J. Дои:10.1016 / j.solidstatesciences.2005.06.015.
- ^ Мойер, Брюс А .; Бердвелл, Джозеф Ф .; Боннесен, Петр V .; Дельмау, Летиция Х. (2005). Использование макроциклов в очистке ядерных отходов: практическое применение каликсроны в технологии разделения цезия. Макроциклическая химия. С. 383–405. Дои:10.1007/1-4020-3687-6_24. ISBN 978-1-4020-3364-3..
- ^ Сенга, Рёске; Суэнага, Кадзу (2015). «Спектроскопия одноатомных электронных потерь энергии легких элементов». Nature Communications. 6: 7943. Bibcode:2015НатКо ... 6.7943S. Дои:10.1038 / ncomms8943. ЧВК 4532884. PMID 26228378.
- ^ Evans, F.W .; Litt, M. H .; Вайдлер-Кубанек, А. М .; Авонда, Ф. П. (1968). «Реакции, катализируемые фторидом калия. 111. Реакция Кневенагеля». Журнал органической химии. 33 (5): 1837–1839. Дои:10.1021 / jo01269a028.
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия (5-е изд.). Оксфордские научные публикации. ISBN 978-0-19-855370-0.
- ^ Коттон, Ф. Альберт; Уилкинсон, Г. (1962). Продвинутая неорганическая химия. John Wiley & Sons, Inc. стр. 318. ISBN 978-0-471-84997-1.
- ^ Лиде, Дэвид Р., изд. (2006). CRC Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press. С. 451, 514. ISBN 0-8493-0487-3.
- ^ а б Цай, Хи-Руэй; Harris, P.M .; Лассетр, Э. Н. (1956). «Кристаллическая структура монооксида цезия». Журнал физической химии. 60 (3): 338–344. Дои:10.1021 / j150537a022.
- ^ Вольнов, И. И .; Матвеев, В. В. (1963). «Синтез озонида цезия через супероксид цезия». Вестник Академии наук Отделения химических наук СССР.. 12 (6): 1040–1043. Дои:10.1007 / BF00845494.
- ^ Токарева, С. А. (1971). «Озониды щелочных и щелочноземельных металлов». Российские химические обзоры. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. Дои:10.1070 / RC1971v040n02ABEH001903.
- ^ Саймон, А. (1997). «Субоксиды и субнитриды групп 1 и 2 - металлы с отверстиями и туннелями атомного размера». Обзоры координационной химии. 163: 253–270. Дои:10.1016 / S0010-8545 (97) 00013-1.
- ^ Цай, Хи-Руэй; Harris, P.M .; Лассетр, Э. Н. (1956). «Кристаллическая структура монооксида тризисия». Журнал физической химии. 60 (3): 345–347. Дои:10.1021 / j150537a023.
- ^ Окамото, Х. (2009). «Cs-O (Цезий-Кислород)». Журнал фазового равновесия и диффузии. 31: 86–87. Дои:10.1007 / s11669-009-9636-5.
- ^ Band, A .; Альбу-Ярон, А .; Ливнех, Т .; Cohen, H .; Feldman, Y .; Шимон, Л .; Popovitz-Biro, R .; Ляховицкая, В .; Тенн, Р. (2004). «Характеристика оксидов цезия». Журнал физической химии B. 108 (33): 12360–12367. Дои:10.1021 / jp036432o.
- ^ Брауэр, Г. (1947). "Untersuchungen ber das System Csium-Sauerstoff". Zeitschrift für Anorganische Chemie. 255 (1–3): 101–124. Дои:10.1002 / zaac.19472550110.
- ^ Буссо, М .; Галлино, Р .; Вассербург, Г. Дж. (1999). "Нуклеосинтез в асимптотических звездах-гигантах: актуальность для обогащения галактик и формирования Солнечной системы" (PDF). Ежегодный обзор астрономии и астрофизики. 37: 239–309. Bibcode:1999ARA & A..37..239B. Дои:10.1146 / annurev.astro.37.1.239. Получено 2010-02-20.
- ^ Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез: исследование истории материи от Большого взрыва до наших дней. Издательство Принстонского университета. п. 527. ISBN 978-0-691-01147-9.
- ^ Goff, C .; Матчетт, Майкл А .; Шабестари, Нахид; Хазаэли, Садех (1996). «Комплексообразование катионов цезия и рубидия с краун-эфирами в N, N-диметилформамиде». Многогранник. 15 (21): 3897–3903. Дои:10.1016/0277-5387(96)00018-6.
- ^ Brown, F .; Холл, G. R .; Уолтер, А. Дж. (1955). «Период полураспада Cs137». Журнал неорганической и ядерной химии. 1 (4–5): 241–247. Bibcode:1955PhRv ... 99..188Вт. Дои:10.1016/0022-1902(55)80027-9.
- ^ Сонзони, Алехандро. «Интерактивная карта нуклидов». Национальный центр ядерных данных: Брукхейвенская национальная лаборатория. Получено 2008-06-06.
- ^ Оки, Шигео; Такаки, Наоюки (14–16 октября 2002 г.). Трансмутация цезия-135 с помощью быстрых реакторов (PDF). Седьмое совещание по обмену информацией о разделении и трансмутации актинидов и продуктов деления. Чеджу, Корея. Получено 2010-09-26.
- ^ «20 Ксенон: яд продукта деления». Основы CANDU (PDF) (Отчет). Группа владельцев CANDU Inc. Архивировано из оригинал (PDF) 23 июля 2011 г.. Получено 2010-09-15.
- ^ Тейлор, В. Ф .; Evans, R.D .; Корнетт, Р. Дж. (2008). "Предварительная оценка 135Cs /137Cs как судебно-медицинский инструмент для выявления источника радиоактивного загрязнения ». Журнал экологической радиоактивности. 99 (1): 109–118. Дои:10.1016 / j.jenvrad.2007.07.006. PMID 17869392.
- ^ «Цезий | Радиационная защита». Агентство по охране окружающей среды США. 2006-06-28. Архивировано из оригинал 15 марта 2011 г.. Получено 2010-02-15.
- ^ Зерриффи, Хишам (24 мая 2000 г.). Отчет IEER: Трансмутация - Игра ядерной алхимии (Отчет). Институт энергетики и экологических исследований. Получено 2010-02-15.
- ^ Наследие Чернобыля: воздействие на здоровье, окружающую среду и социально-экономическое положение и рекомендации правительствам Беларуси, Российской Федерации и Украины (PDF) (Отчет). Международное агентство по атомной энергии. Архивировано из оригинал (PDF) на 2010-02-15. Получено 2010-02-18.
- ^ Касе, Такеши; Конаши, Кендзи; Такахаши, Хироши; Хирао, Ясуо (1993). «Трансмутация цезия-137 с помощью ускорителя протонов». Журнал ядерной науки и технологий. 30 (9): 911–918. Дои:10.3327 / jnst.30.911.
- ^ Книф, Рональд Аллен (1992). «Осколки деления». Ядерная инженерия: теория и технология коммерческой ядерной энергетики. Тейлор и Фрэнсис. п. 42. ISBN 978-1-56032-088-3.
- ^ Ishiwatari, N .; Нагаи, Х. «Высвобождение ксенона-137 и йода-137 из таблеток UO2 при импульсном нейтронном облучении в NSRR». Ниппон Генширёку Гаккаиси. 23 (11): 843–850. OSTI 5714707.
- ^ Турекян, К. К .; Ведепол, К. Х. (1961). «Распределение элементов в некоторых крупных единицах земной коры». Бюллетень Геологического общества Америки. 72 (2): 175–192. Bibcode:1961ГСАБ ... 72..175Т. Дои:10.1130 / 0016-7606 (1961) 72 [175: DOTEIS] 2.0.CO; 2. ISSN 0016-7606.
- ^ Роуленд, Саймон (1998-07-04). «Цезий как сырье: появление и использование». Международное общество Артемиды. Получено 2010-02-15.
- ^ а б Черный, Петр; Симпсон, Ф. М. (1978). "Пегматит Танко на озере Берник, Манитоба: X. Поллюцит" (PDF). Канадский минералог. 16: 325–333. Получено 2010-09-26.
- ^ а б c d Поляк, Дезире Э. «Цезий» (PDF). Геологическая служба США. Получено 2009-10-17.
- ^ Нортон, Дж. Дж. (1973). «Литий, цезий и рубидий - редкие щелочные металлы». In Brobst, D. A .; Пратт, У. П. (ред.). Минеральные ресурсы США. Документ 820. Специалист по геологической службе США. стр. 365–378. Получено 2010-09-26.
- ^ а б Берт, Р. О. (1993). «Цезий и соединения цезия». Кирк-Отмер энциклопедия химической технологии. 5 (4-е изд.). Нью-Йорк: John Wiley & Sons, Inc., стр. 749–764. ISBN 978-0-471-48494-3.
- ^ Бентон, Уильям; Тернер, Джим (2000). «Жидкость формиата цезия успешно прошла полевые испытания HPHT в Северном море» (PDF). Подрядчик по бурению (Май / июнь): 38–41. Получено 2010-09-26.
- ^ а б Иглсон, Мэри, изд. (1994). Краткая энциклопедия химии. Иглсон, Мэри. Берлин: де Грюйтер. п. 198. ISBN 978-3-11-011451-5.
- ^ Оксфордский словарь английского языка, 2-е издание
- ^ а б c d Кирхгоф, Г.; Бунзен, Р. (1861). "Chemische Analyze durch Spectralbeobachtungen" (PDF). Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP ... 189..337K. Дои:10.1002 / andp.18611890702. HDL:2027 / hvd.32044080591324.
- ^ а б Недели, Мэри Эльвира (1932). «Открытие элементов. XIII. Некоторые спектроскопические открытия». Журнал химического образования. 9 (8): 1413–1434. Bibcode:1932JChEd ... 9.1413W. Дои:10.1021 / ed009p1413.
- ^ Жигмонди, Ричард (2007). Коллоиды и ультрамикроскоп. Читать книги. п. 69. ISBN 978-1-4067-5938-9.
- ^ Сеттерберг, Карл (1882). "Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst". Annalen der Chemie Юстуса Либиха. 211: 100–116. Дои:10.1002 / jlac.18822110105.
- ^ Строд, А. Дж. (1957). «Цезий - новый промышленный металл». Американский керамический бюллетень. 36 (6): 212–213.
- ^ а б «Атомы цезия в действии». Департамент службы времени - США. Военно-морская обсерватория - ВМФ. Архивировано из оригинал 23 февраля 2015 г.. Получено 2009-12-20.
- ^ а б c Даунс, Дж. Д .; Blaszczynski, M .; Тернер, Дж .; Харрис, М. (февраль 2006 г.). Бурение и заканчивание сложных скважин высокого и высокого давления с использованием рассолов на основе формиата цезия - Обзор производительности. Конференция IADC / SPE по бурению. Майами, Флорида, Общество инженеров-нефтяников США. Дои:10.2118 / 99068-МС. Архивировано из оригинал на 2007-10-12.
- ^ Флатерн, Рик (2001). «Сохранение прохлады в среде HPHT». Офшорный инженер (Февраль): 33–37.
- ^ Essen, L .; Парри, Дж. В. Л. (1955). «Атомный эталон частоты и временного интервала: цезиевый резонатор». Природа. 176 (4476): 280–282. Bibcode:1955Натура.176..280E. Дои:10.1038 / 176280a0.
- ^ Марковиц, В .; Холл, р .; Essen, L .; Парри, Дж. (1958). «Частота цезия в эфемеридном времени». Письма с физическими проверками. 1 (3): 105–107. Bibcode:1958ПхРвЛ ... 1..105М. Дои:10.1103 / PhysRevLett.1.105.
- ^ Катушка, Монте (22.07.2003). "Где время действительно все". Вашингтон Пост. п. B1. Архивировано из оригинал на 2013-04-29. Получено 2010-01-26.
- ^ Rasor, Ned S .; Уорнер, Чарльз (сентябрь 1964 г.). «Корреляция эмиссионных процессов для адсорбированных щелочных пленок на металлических поверхностях». Журнал прикладной физики. 35 (9): 2589–2600. Bibcode:1964JAP .... 35.2589R. Дои:10.1063/1.1713806.
- ^ «Поставщик цезия и техническая информация». Американские элементы. Получено 2010-01-25.
- ^ Смедли, Джон; Рао, Тривени; Ван, Эрдонг (2009). "K2Разработка катода CsSb ". Материалы конференции AIP. 1149 (1): 1062–1066. Bibcode:2009AIPC.1149.1062S. Дои:10.1063/1.3215593.
- ^ Герлих, П. (1936). "Über zusammengesetzte, durchsichtige Photokathoden". Zeitschrift für Physik. 101 (5–6): 335–342. Bibcode:1936ZPhy..101..335G. Дои:10.1007 / BF01342330.
- ^ Groeger, S .; Пазгалев, А. С .; Вайс, А. (2005). «Сравнение газоразрядных ламп и цезиевых магнитометров с лазерной накачкой». Прикладная физика B. 80 (6): 645–654. arXiv:физика / 0412011. Bibcode:2005АпФБ..80..645Г. Дои:10.1007 / s00340-005-1773-х.
- ^ Хейвен, Мэри С .; Тетро, Грегори А .; Шенкен, Джеральд Р. (1994). «Внутренние стандарты». Лабораторное оборудование. Нью-Йорк: Джон Уайли и сыновья. п. 108. ISBN 978-0-471-28572-4.
- ^ Макги, Джеймс Д. (1969). Фотоэлектронные устройства изображения: материалы четвертого симпозиума, проходившего в Имперском колледже, Лондон, 16–20 сентября 1968 г.. 1. Академическая пресса. п. 391. ISBN 978-0-12-014528-7.
- ^ Манфред Бик, Хорст Принц, «Цезий и соединения цезия» в Энциклопедии промышленной химии Ульмана 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a06_153.
- ^ Десаи, Мохамед А., изд. (2000). «Градиентные материалы». Методы последующей обработки. Тотова, Нью-Джерси: Humana Press. С. 61–62. ISBN 978-0-89603-564-5.
- ^ Берт, Р. О. (1993). «Цезий и соединения цезия». Кирк-Отмер энциклопедия химической технологии. 5 (4-е изд.). Нью-Йорк: Джон Вили и сыновья. п. 759. ISBN 978-0-471-15158-6.
- ^ Фристад, Грегори К .; Браншо, Брюс П .; Наваррини, Уолтер и Сансотера, Маурицио (2007) «Фторид цезия» в Энциклопедия реагентов для органического синтеза, Джон Уайли и сыновья. Дои:10.1002 / 047084289X.rc050.pub2
- ^ Окумура, Такеши (2003-10-21). «Материальный поток радиоактивного цезия-137 в США в 2000 году» (PDF). Агентство по охране окружающей среды США. Архивировано из оригинал (PDF) 20 июля 2011 г.. Получено 2009-12-20.
- ^ Дженсен, Н. Л. (1985). «Цезий». Минеральные факты и проблемы. Бюллетень 675. Горное управление США. С. 133–138.
- ^ «Медицинский изотоп цезия-131 IsoRay, используемый в важной процедуре лечения рака глаз в Медицинском центре Тафтс-Новая Англия». Медицинские новости сегодня. 2007-12-17. Получено 2010-02-15.
- ^ Бентел, Гунилла Карлесон (1996). «Машины с цезием-137». Планирование лучевой терапии. McGraw-Hill Professional. С. 22–23. ISBN 978-0-07-005115-7. Получено 2010-09-26.
- ^ Национальный исследовательский совет (США). Комитет по использованию и замене источников излучения (2008 г.). Использование и замена источников излучения: сокращенная версия. Национальная академия прессы. ISBN 978-0-309-11014-3.
- ^ Loxton, R .; Поуп, П., ред. (1995). «Измерение уровня и плотности с помощью бесконтактных ядерных датчиков». Инструментарий: Читатель. Лондон: Чепмен и Холл. С. 82–85. ISBN 978-0-412-53400-3.
- ^ Тимур, А .; Токсоз, М. Н. (1985). «Скважинный геофизический каротаж». Ежегодный обзор наук о Земле и планетах. 13: 315–344. Bibcode:1985AREPS..13..315T. Дои:10.1146 / annurev.ea.13.050185.001531.
- ^ Кендалл, Кэрол. «Проект изотопных индикаторов - Ресурсы по изотопам - Цезий». Национальная исследовательская программа - Геологическая служба США. Получено 2010-01-25.
- ^ Marcucci, M. G .; Полк, Дж. Э. (2000). «Ксенон-ионный двигатель NSTAR в глубоком космосе 1: наземные и летные испытания (приглашены)». Обзор научных инструментов. 71 (3): 1389–1400. Bibcode:2000РНКИ ... 71.1389М. Дои:10.1063/1.1150468.
- ^ Sovey, James S .; Роулин, Винсент К .; Паттерсон, Майкл Дж. "Краткий обзор проектов разработки ионных двигателей в Соединенных Штатах: от SERT I до Deep Space I" (PDF). НАСА. Архивировано из оригинал (PDF) 29 июня 2009 г.. Получено 2009-12-12.
- ^ Marrese, C .; Polk, J .; Mueller, J .; Оуэнс, А .; Tajmar, M .; Финк Р. и Спиндт К. (октябрь 2001 г.). Нейтрализация ионного пучка двигателя In-FEEP с термоэлектронными и автоэмиссионными катодами. 27-я Международная конференция по электродвигателям. Пасадена, Калифорния. С. 1–15. Архивировано из оригинал (PDF) на 2010-05-27. Получено 2010-01-25.
- ^ «Композиции для инфракрасного освещения и изделия, содержащие их». Патент США 6230628. Freepatentsonline.com. Получено 2010-01-25.
- ^ «Факел ЛУУ-19». Федерация американских ученых. 2000-04-23. Архивировано из оригинал на 2010-08-06. Получено 2009-12-12.
- ^ Charrier, E .; Charsley, E.L .; Laye, P. G .; Markham, H.M .; Berger, B .; Гриффитс, Т. Т. (2006). «Определение температуры и энтальпии фазового перехода твердое тело – твердое тело нитрата цезия методом дифференциальной сканирующей калориметрии». Термохимика Акта. 445: 36–39. Дои:10.1016 / j.tca.2006.04.002.
- ^ Крикмор, Пол Ф. (2000). Lockheed SR-71: раскрыты секретные миссии. Скопа. п. 47. ISBN 978-1-84176-098-8.
- ^ Национальный исследовательский совет (США) (2001). Энергетические исследования в Министерстве энергетики - оно того стоило?. Национальная академия прессы. С. 190–194. Дои:10.17226/10165. ISBN 978-0-309-07448-3. Получено 2010-09-26.
- ^ Информационные службы Роскилла (1984). Экономика цезия и рубидия (отчеты по металлам и минералам). Лондон, Соединенное Королевство: Информационные службы Роскилла. п. 51. ISBN 978-0-86214-250-6.
- ^ Чин, Ченг; Гримм, Рудольф; Жюльен, Поль; Тиесинга, Эйте (29 апреля 2010 г.). «Резонансы Фешбаха в ультрахолодных газах». Обзоры современной физики. 82 (2): 1225–1286. arXiv:0812.1496. Bibcode:2010RvMP ... 82.1225C. Дои:10.1103 / RevModPhys.82.1225.
- ^ «Цезий 239240».
- ^ Данные из Радиохимическое руководство и Уилсон, Б. Дж. (1966) Радиохимическое руководство (2-е изд.).
- ^ Мельников, П .; Занони, Л. З. (июнь 2010 г.). «Клинические эффекты от приема цезия». Биологические исследования микроэлементов. 135 (1–3): 1–9. Дои:10.1007 / s12011-009-8486-7. PMID 19655100.
- ^ Пинский, Карл; Бос, Ранджан; Taylor, J. R .; Макки, Джаспер; Лапоант, Клод; Бирчалл, Джеймс (1981). «Цезий у млекопитающих: острая токсичность, изменения органов и скопление тканей». Журнал экологической науки и здоровья, часть A. 16 (5): 549–567. Дои:10.1080/10934528109375003.
- ^ Джонсон, Гарланд Т .; Льюис, Трент Р .; Вагнер, Д. Вагнер (1975). «Острая токсичность соединений цезия и рубидия». Токсикология и прикладная фармакология. 32 (2): 239–245. Дои:10.1016 / 0041-008X (75) 90216-1. PMID 1154391.
- ^ Рундо, Дж. (1964). «Обзор метаболизма цезия в человеке». Британский журнал радиологии. 37 (434): 108–114. Дои:10.1259/0007-1285-37-434-108. PMID 14120787.
- ^ Nishita, H .; Диксон, Д .; Ларсон, К. Х. (1962). «Накопление Cs и K и рост растений фасоли в питательном растворе и почве». Растение и почва. 17 (2): 221–242. Дои:10.1007 / BF01376226.
- ^ Эйвери, С. (1996). «Судьба цезия в окружающей среде: распределение между абиотическими и биотическими компонентами водных и наземных экосистем». Журнал экологической радиоактивности. 30 (2): 139–171. Дои:10.1016 / 0265-931X (96) 89276-9.
- ^ Салбу, Брит; Остби, Георг; Garmo, Torstein H .; Хоув, Кнут (1992). «Доступность изотопов цезия в растительности по результатам экспериментов по инкубации и экстракции». Аналитик. 117 (3): 487–491. Bibcode:1992Ана ... 117..487С. Дои:10.1039 / AN9921700487. PMID 1580386.
- ^ Виничук, М. (2010). «Накопление калия, рубидия и цезия (133CS и 137Cs) в различных фракциях почвы и грибов в шведском лесу ». Наука об окружающей среде в целом. 408 (12): 2543–2548. Bibcode:2010ScTEn.408.2543V. Дои:10.1016 / j.scitotenv.2010.02.024. PMID 20334900.
- ^ Смит, Джим Т .; Бересфорд, Николас А. (2005). Чернобыль: катастрофа и последствия. Берлин: Springer. ISBN 978-3-540-23866-9.
- ^ Еремеев, В. Н .; Чудиновских, Т. В .; Батраков, Г. Ф .; Иванова, Т. М. (1991). «Радиоактивные изотопы цезия в водах и приводном слое атмосферы Черного моря». Физическая океанография. 2 (1): 57–64. Дои:10.1007 / BF02197418.
- ^ Redman, H.C .; McClellan, R.O .; Jones, R.K .; Boecker, B. B .; Chiffelle, T. L .; Пикрелл, Дж. А .; Рыпка, Э. У. (1972). «Токсичность 137-CsCl на гончих. Ранние биологические эффекты». Радиационные исследования. 50 (3): 629–648. Bibcode:1972РадР ... 50..629Р. Дои:10.2307/3573559. JSTOR 3573559. PMID 5030090.
- ^ "Китайцы" находят "радиоактивный шар". Новости BBC. 2009-03-27. Получено 2010-01-25.
- ^ Шарбонно, Луи (2003-03-12). «Директор МАГАТЭ предупреждает об опасности« грязной бомбы »». Вашингтон Пост. Рейтер. п. A15. Архивировано из оригинал на 2008-12-05. Получено 2010-04-28.
внешняя ссылка
- Цезий или цезий в Периодическая таблица видео (Ноттингемский университет)
- Просмотрите реакцию цезия (наиболее реактивного металла в периодической таблице) с фтором (наиболее реактивным неметаллом) любезно предоставлено Королевским институтом.
- Рогачев Андрей Юрьевич; Мяо, Мао-Шэн; Мерино, Габриэль; Хоффманн, Роальд (2015). «Молекулярный CsF5 и CsF2 +». Angewandte Chemie. 127 (28): 8393–8396. Дои:10.1002 / ange.201500402.


