Менделевий - Mendelevium
Менделевий это синтетический элемент с символ Мкр (ранее Mv ) и атомный номер 101. Металлик радиоактивный трансурановый элемент в актинид серии, это первый элемент по атомному номеру, который в настоящее время не может быть произведен в макроскопических количествах с помощью нейтрон бомбардировка более легких элементов. Это предпоследний актинид и девятый трансурановый элемент. Его можно производить только в ускорители частиц путем бомбардировки более легких элементов заряженными частицами. Всего семнадцать изотопы менделевия известны, наиболее стабильное существо 258Мкр с период полураспада 51 день; тем не менее, более короткоживущие 256Md (период полураспада 1,17часы ) чаще всего используется в химии, поскольку его можно производить в более крупных масштабах.
Менделевий был обнаружен при бомбардировке эйнштейний с альфа-частицы в 1955 году тот же метод используется для производства и сегодня. Он был назван в честь Дмитрий Менделеев, отец периодическая таблица химических элементов. Использование доступных микрограмм количества изотопа эйнштейний-253, более миллиона атомов менделевия могут производиться каждый час. Химический состав менделевия типичен для поздних актинидов с преобладанием степени окисления +3, но также доступной степенью окисления +2. Все известные изотопы менделевия имеют относительно короткие периоды полураспада; в настоящее время он не используется вне фундаментальных научных исследований, и производится лишь в небольших количествах.
Открытие

Менделевий был девятым трансурановый элемент быть синтезированным. Это был первый синтезированный к Альберт Гиорсо, Гленн Т. Сиборг, Грегори Роберт Чоппин, Бернард Г. Харви и руководитель группы Стэнли Г. Томпсон в начале 1955 года в Калифорнийском университете в Беркли. Команда произвела 256Md (период полураспада 77 минут[3]) когда они обстреляли 253Es цель, состоящая только из миллиард (109) атомы эйнштейния с альфа-частицы (гелий ядер) в Радиационная лаборатория Беркли 60-дюймовый циклотрон, таким образом увеличивая атомный номер цели на два. 256Таким образом, Md стал первым изотопом любого элемента, который можно было синтезировать по одному атому за раз. Всего было произведено семнадцать атомов менделевия.[4] Это открытие было частью программы, начатой в 1952 г., по облучению плутоний с нейтронами, чтобы превратить его в более тяжелые актиниды.[5] Этот метод был необходим, так как предыдущий метод использовался для синтеза трансурановых элементов, захват нейтронов, не мог работать из-за отсутствия известных бета-распад изотопы фермия который будет производить изотопы следующего элемента, менделевия, а также из-за очень короткого периода полураспада до спонтанное деление из 258FM это, таким образом, является жестким пределом успеха процесса захвата нейтронов.[3]
| Внешнее видео | |
|---|---|
Чтобы предсказать, возможно ли производство менделевия, команда использовала грубый расчет. Количество образовавшихся атомов было бы примерно равно произведению количества атомов материала мишени, поперечного сечения мишени, интенсивности ионного пучка и времени бомбардировки; этот последний фактор был связан с периодом полураспада продукта при бомбардировке в течение времени, равного его периоду полураспада. Это давало один атом на эксперимент. Таким образом, в оптимальных условиях можно было ожидать получения только одного атома 101-го элемента за эксперимент. Этот расчет показал, что эксперимент можно продолжить.[4] Материал мишени, эйнштейний-253, может быть легко получен путем облучения плутоний: один год облучения даст миллиард атомов, а его трехнедельное период полураспада означало, что эксперименты с элементом 101 можно было провести через одну неделю после того, как произведенный эйнштейний был отделен и очищен, чтобы сделать мишень. Однако потребовалось модернизировать циклотрон для получения необходимой интенсивности 1014 альфа-частицы в секунду; Сиборг запросил необходимые средства.[5]

Пока Сиборг подал заявку на финансирование, Харви работал над целью эйнштейния, а Томсон и Чоппин сосредоточились на методах химической изоляции. Чоппин предложил использовать α-гидроксиизомасляная кислота для отделения атомов менделевия от атомов более легких актинидов.[5] Фактический синтез был сделан методом отдачи, введенным Альбертом Гиорсо. В этом методе эйнштейний помещался на противоположной стороне мишени от луча, так что отскакивающие атомы менделевия получали достаточно импульс покинуть цель и попасться на ловушку из золотой фольги. Эта мишень с отдачей была изготовлена с помощью гальванической техники, разработанной Альфредом Четам-Строде. Эта методика давала очень высокий выход, что было абсолютно необходимо при работе с таким редким и ценным продуктом, как эйнштейниевая мишень.[4] Мишень отдачи состояла из 109 атомы 253Es, которые были нанесены электролитическим способом на тонкую золотую фольгу. Его обстреляли 41МэВ альфа-частицы в Циклотрон Беркли с очень высокой плотностью пучка 6 × 1013 частиц в секунду на площади 0,05 см2. Мишень охлаждалась водой или жидкий гелий, и фольгу можно было заменить.[4][6]
Первоначальные эксперименты были проведены в сентябре 1954 г. Не наблюдалось альфа-распада атомов менделевия; таким образом, Гиорсо предположил, что менделевий полностью распался за счет захват электронов к фермий и что эксперимент следует повторить для поиска вместо спонтанное деление События.[5] Повторение эксперимента произошло в феврале 1955 года.[5]

В день открытия, 19 февраля, альфа-облучение эйнштейниевой мишени происходило за три трехчасовых сеанса. Циклотрон находился в Калифорнийский университет кампус, а на следующем холме располагалась радиационная лаборатория. Чтобы справиться с этой ситуацией, была использована сложная процедура: Гиорсо перенес ловящие фольги (было три мишени и три фольги) с циклотрона Харви, который использовал царская водка растворить его и пропустить через анион -обмен смола столбец, чтобы отделить трансурановые элементы из золота и других изделий.[5][7] Полученные капли попали в пробирка, которую Чоппин и Гиорсо взяли на машине, чтобы как можно скорее добраться до Радиационной лаборатории. Там Томпсон и Чоппин использовали катион -обменная колонка со смолой и α-гидроксиизомасляной кислотой. Капли раствора собирались на платина диски и сушат под нагревательными лампами. Ожидалось, что три диска будут содержать соответственно фермий без новых элементов и менделевий. Наконец, их поместили в свои собственные счетчики, которые были подключены к регистраторам, чтобы события спонтанного деления регистрировались как огромные отклонения на графике, показывающем количество и время распадов. Таким образом, не было прямого обнаружения, но наблюдалось спонтанное деление, возникающее из-за его дочернего захвата электронов. 256Fm. Первый был идентифицирован как «ура», затем последовали «двойное ура» и «тройное ура». Четвертый в конечном итоге официально подтвердил химическую идентификацию 101-го элемента - менделевия. Всего до 4 часов утра было сообщено о пяти распадах.Сиборгу сообщили, и команда ушла спать.[5] Дополнительный анализ и дальнейшие эксперименты показали, что произведенный изотоп менделевия имел массу 256 и распадался за счет захвата электронов до фермия-256 с периодом полураспада 1,5 часа.[3]
Мы подумали, что уместным является наличие элемента, названного в честь русского химика Дмитрия Менделеева, который разработал таблицу Менделеева. Почти во всех наших экспериментах по обнаружению трансурановых элементов мы полагались на его метод предсказания химических свойств на основе положения элемента в таблице. Но в разгар холодной войны наименование элемента для русского было довольно смелым жестом, который не нравился некоторым американским критикам.[8]
— Гленн Т. Сиборг
Являясь первым из второй сотни химических элементов, было решено, что элемент будет назван «менделевий» в честь русского химика. Дмитрий Менделеев, отец периодическая таблица. Поскольку это открытие произошло во время Холодная война, Сиборгу пришлось запросить разрешение у правительства Соединенные Штаты предложить назвать элемент в честь русского языка, но это было предоставлено.[5] Название «менделевий» было принято Международный союз теоретической и прикладной химии (ИЮПАК) в 1955 г. с условным обозначением «Mv»,[9] который был изменен на "Md" на следующей Генеральной ассамблее ИЮПАК (Париж, 1957 г.).[10]
Характеристики
Физический
в периодическая таблица, менделевий расположен справа от актинида фермий, слева от актинида нобелий, а ниже лантаноида тулий. Металлический менделевий еще не был получен в больших количествах, и в настоящее время его массовое получение невозможно.[12] Тем не менее, в отношении его свойств был сделан ряд предсказаний и некоторые предварительные экспериментальные результаты.[12]
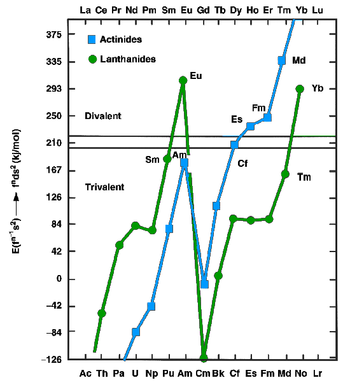
Лантаноиды и актиниды в металлическом состоянии могут существовать как двухвалентные (например, европий и иттербий ) или трехвалентных (большинство других лантаноидов) металлов. Первые имеют fпd1s2 конфигураций, тогда как последние имеют fп+1s2 конфигурации. В 1975 году Йоханссон и Розенгрен изучили измеренные и предсказанные значения для когезионные энергии (энтальпии кристаллизации) металлического лантаноиды и актиниды, как двухвалентные, так и трехвалентные металлы.[13][14] Был сделан вывод, что повышенная энергия связи [Rn] 5f126d17 с2 конфигурация по [Rn] 5f137 с2 конфигурации для менделевия было недостаточно, чтобы компенсировать энергию, необходимую для продвижения одного электрона 5f до 6d, как и для очень поздних актинидов: эйнштейний, фермий, менделевий и нобелий ожидалось, что это будут двухвалентные металлы.[13] Возрастающее преобладание двухвалентного состояния задолго до завершения ряда актинидов приписывается релятивистский стабилизация 5f-электронов, которая увеличивается с увеличением атомного номера.[15] Термохроматографический исследования следовых количеств менделевия, проведенные Зварой и Хюбенером с 1976 по 1982 год, подтвердили это предсказание.[12] В 1990 году Хайр и Гибсон оценили металлический менделевий как энтальпия сублимации от 134 до 142 кДж / моль.[12] Двухвалентный металл менделевий должен иметь металлический радиус около 194±10 вечера.[12] Как и другие двухвалентные поздние актиниды (кроме трехвалентного лоуренсий ) металлический менделевий должен принять гранецентрированная кубическая Кристальная структура.[1] Температура плавления менделевия оценивается в 827 ° C, то же самое значение, что и предсказанное для соседнего элемента нобелия.[16] Его плотность, по прогнозам, будет около 10.3±0,7 г / см3.[1]
Химическая
Химический состав менделевия в основном известен только в растворах, в которых он может принимать +3 или +2 состояния окисления. О состоянии +1 также сообщалось, но еще не подтверждено.[17]
До открытия менделевия, Сиборг и Кац предсказали, что он должен быть преимущественно трехвалентным в водном растворе и, следовательно, должен вести себя аналогично другим триположительным лантаноидам и актинидам. После синтеза менделевия в 1955 году эти предсказания подтвердились, во-первых, в наблюдении при его открытии, что он элюированный сразу после фермия в последовательности элюирования трехвалентного актинида из катионообменной колонки со смолой, а позднее наблюдение 1967 г., что менделевий может образовывать нерастворимые гидроксиды и фториды которые соосаждены с солями трехвалентного лантаноида.[17] Исследования катионообмена и экстракции растворителем привели к выводу, что менделевий является трехвалентным актинидом с ионным радиусом несколько меньшим, чем у предыдущего актинида, фермия.[17] Менделевий может образовывать координационные комплексы с 1,2-циклогександинитрилотетрауксусной кислотой (DCTA).[17]
В сокращение В условиях менделевия (III) можно легко восстановить до менделевия (II), который устойчив в водном растворе.[17] В стандартный восстановительный потенциал из E° (Md3+→ мкр.2+) пара по разным оценкам в 1967 году составляла -0,10 В или -0,20 В:[17] позже эксперименты 2013 г. установили значение как −0.16±0,05 В.[18] В сравнении, E° (Md3+→ мкр.0) должно быть около -1,74 В, а E° (Md2+→ мкр.0) должно быть около -2,5 В.[17] Элюирование Mendelevium (II) сравнивалось с таковым у стронций (II) и европий (II).[17]
В 1973 г. сообщалось, что менделевий (I) был получен российскими учеными, которые получили его путем восстановления более высоких степеней окисления менделевия с помощью самарий (II). Было обнаружено, что он стабилен в нейтральной воде -этиловый спирт решение и быть гомологичный к цезий (Я). Однако более поздние эксперименты не обнаружили доказательств наличия менделевия (I) и обнаружили, что менделевий при восстановлении ведет себя как двухвалентные элементы, а не как одновалентные. щелочных металлов.[17] Тем не менее, российская команда провела дальнейшие исследования термодинамика сокристаллизации менделевия с щелочным металлом хлориды, и пришел к выводу, что менделевий (I) образовался и мог образовывать смешанные кристаллы с двухвалентными элементами, таким образом сокристаллизуясь с ними. Статус окисления +1 все еще предварительный.[17]
Несмотря на то что E° (Md4+→ мкр.3+) было предсказано в 1975 г. на уровне +5,4 В, предполагая, что менделевий (III) может быть окислен до менделевия (IV), эксперименты 1967 г. с сильным окислителем висмутат натрия не смогли окислить менделевий (III) до менделевия (IV).[17]
Атомный
Атом менделевия имеет 101 электрон, из которых по крайней мере три (а возможно, четыре) могут действовать как валентные электроны. Предполагается, что они будут расположены в конфигурации [Rn] 5f137 с2 (основное состояние термин символ 2F7/2), хотя экспериментальная проверка этой электронной конфигурации еще не проводилась по состоянию на 2006 год.[19] При образовании соединений три валентных электрона могут быть потеряны, оставив после себя [Rn] 5f12 core: это соответствует тенденции, заданной другими актинидами с их [Rn] 5fп электронные конфигурации в триположительном состоянии. Первый потенциал ионизации менделевия не превышало (6,58 ± 0,07)эВ в 1974 г., исходя из предположения, что электроны 7s ионизируются раньше, чем электроны 5f;[20] это значение с тех пор еще не уточнялось из-за дефицита менделевия и высокой радиоактивности.[21] Ионный радиус шестнадцатеричный Мкр3+ по предварительной оценке в 1978 г. она составляла около 91,2 часа дня;[17] Расчеты 1988 г., основанные на логарифмическом тренде между коэффициенты распределения и ионный радиус дал значение 89,6 пм, а также энтальпия гидратации из −3654±12 кДж / моль.[17] Мкр2+ должен иметь ионный радиус 115 мкм и энтальпию гидратации -1413 кДж / моль; Мкр+ должен иметь ионный радиус 117 пм.[17]
Изотопы
Известно семнадцать изотопов менделевия с массовыми числами от 244 до 260; все радиоактивны.[22] Дополнительно пять ядерные изомеры известны: 245 кв.м.Мкр, 247 кв.м.Мкр, 249 кв.м.Мкр, 254 кв.м.Мкр, и 258 кв.м.Мкр.[3][23] Из них самым долгоживущим изотопом является 258Md с периодом полураспада 51,5 суток, а самый долгоживущий изомер 258 кв.м.Md с периодом полураспада 58,0 минут.[3][23] Тем не менее, более короткоживущие 256Md (период полураспада 1,17 часа) чаще используется в химических экспериментах, потому что его можно получить в больших количествах из альфа-частица облучение эйнштейном.[22] После 258Md, следующие наиболее стабильные изотопы менделевия - 260Md с периодом полураспада 31,8 суток, 257Md с периодом полураспада 5,52 часа, 259Md с периодом полураспада 1,60 часа, и 256Md с периодом полураспада 1,17 часа. У всех остальных изотопов менделевия период полураспада составляет менее часа, а у большинства из них период полураспада составляет менее 5 минут.[3][22][23]
Период полураспада изотопов менделевия в основном плавно увеличивается от 244Md и далее, достигая максимума при 258Мкр.[3][22][23] Эксперименты и прогнозы предполагают, что период полураспада затем уменьшится, за исключением 260Md с периодом полураспада 31,8 суток,[3][22][23] в качестве спонтанное деление становится доминирующей модой распада[3] из-за взаимного отталкивания протонов, что ограничивает остров относительной стабильности долгоживущих ядер в актинид серии.[24]
Менделевий-256, химически самый важный изотоп менделевия, распадается через захват электронов 90% времени и альфа-распад В 10% случаев.[22] Его легче всего обнаружить через спонтанное деление своей дочери электронного захвата фермий-256, но в присутствии других нуклидов, подвергающихся спонтанному делению, альфа-распад с характерными энергиями для менделевия-256 (7.205 и 7.139МэВ ) может обеспечить более полезную идентификацию.[25]
Производство и изоляция
Самые легкие изотопы менделевия (244Мкр до 247Md) в основном производятся путем бомбардировки висмут мишени с тяжелыми аргон ионы, а несколько более тяжелые (248Мкр до 253Md) производятся бомбардировкой плутоний и америций мишени с более легкими ионами углерод и азот. Наиболее важные и наиболее стабильные изотопы находятся в диапазоне от 254Мкр до 258Md и производятся путем бомбардировки эйнштейний можно использовать изотопы с альфа-частицами: эйнштейний-253, -254 и -255. 259Md выпускается как дочь из 259Нет, и 260Md может производиться в реакция передачи между эйнштейнием-254 и кислород-18.[22] Обычно наиболее часто используемый изотоп 256Md получают путем бомбардировки эйнштейния-253 или -254 альфа-частицами: эйнштейний-254 предпочтителен, когда он доступен, потому что он имеет более длительный период полураспада и, следовательно, может использоваться в качестве мишени дольше.[22] Используя доступные количества эйнштейния в микрограммах, фемтограмма количество менделевия-256 может быть произведено.[22]
Отдача импульс образовавшихся атомов менделевия-256 используется для их физического удаления от эйнштейниевой мишени, из которой они произведены, на тонкую металлическую фольгу (обычно бериллий, алюминий, платина, или же золото ) сразу за целью в вакууме.[25] Это устраняет необходимость в немедленном химическом разделении, которое является дорогостоящим и предотвращает повторное использование дорогой эйнштейниевой мишени.[25] Затем атомы менделевия задерживаются в газовой атмосфере (часто гелий ), а струя газа из небольшого отверстия в реакционной камере уносит менделевий.[25] Используя длинный капиллярная трубка, и в том числе хлорид калия аэрозолей в газообразном гелии атомы менделевия могут переноситься на десятки метры пройти химический анализ и определить их количество.[7][25] Затем менделевий можно отделить от фольги и других материалов. продукты деления нанеся кислоту на фольгу, а затем соосаждение менделевий с фторид лантана, затем с помощью катионообменный колонка со смолой с 10% этиловый спирт раствор, насыщенный соляная кислота, действуя как элюент. Однако, если фольга сделана из золота и достаточно тонкая, достаточно просто растворить золото в царская водка перед отделением трехвалентных актинидов от золота с помощью анионообменный хроматография, элюент - 6 М хлористоводородная кислота.[25]
Наконец, менделевий может быть отделен от других трехвалентных актинидов с помощью селективного элюирования из колонки с катионообменной смолой, элюент представляет собой аммиачный α-HIB.[25] Использование газоструйного метода часто делает ненужными первые два шага.[25] Вышеупомянутая процедура является наиболее часто используемой для разделения трансейнштейниевых элементов.[25]
Другой возможный способ разделения трехвалентных актиноидов - это хроматография с экстракцией растворителем с использованием бис- (2-этилгексил) фосфорной кислоты (сокращенно HDEHP) в качестве стационарной органической фазы и азотная кислота в качестве подвижной водной фазы. Последовательность элюирования актинидов обратная по сравнению с колонкой с катионообменной смолой, так что более тяжелые актиниды элюируются позже. Менделевий, отделенный этим методом, имеет то преимущество, что он не содержит органического комплексообразователя по сравнению с колонкой со смолой; недостатком является то, что менделевий затем элюируется очень поздно в последовательности элюирования, после фермия.[7][25]
Другой метод выделения менделевия основан на отличных элюирующих свойствах Md.2+ из тех из Es3+ и Fm3+. Начальные этапы такие же, как и выше, и для экстракционной хроматографии используется HDEHP, но менделевий соосажден с фторидом тербия вместо фторида лантана. Затем 50 мг хром добавляется к менделевию для восстановления его до состояния +2 в 0,1 М соляной кислоте с цинк или же Меркурий.[25] Затем продолжается экстракция растворителем, и в то время как трехвалентные и четырехвалентные лантаноиды и актиниды остаются на колонке, менделевий (II) не выделяется и остается в соляной кислоте. Затем он повторно окисляется до состояния +3, используя пероксид водорода и затем выделяют селективным элюированием 2 М соляной кислотой (для удаления примесей, включая хром) и, наконец, 6 М соляной кислотой (для удаления менделевия).[25] Также можно использовать колонку из катионита и амальгамы цинка, используя 1 М соляную кислоту в качестве элюента, восстанавливая Md (III) до Md (II), где он ведет себя как щелочноземельные металлы.[25] Термохроматографическая химическая изоляция может быть достигнута с использованием летучего менделевия. гексафторацетилацетонат: аналогичное соединение фермия также известно и также является летучим.[25]
Токсичность
Хотя мало кто контактирует с менделевием, Международная комиссия по радиологической защите установил годовые пределы воздействия для наиболее стабильного изотопа. Для менделевия-258 предел приема был установлен на уровне 9 × 10.5 беккерели (1 Бк эквивалентен одному распаду в секунду), а предел ингаляции составляет 6000 Бк.[26]
Рекомендации
- ^ а б c d Фурнье, Жан-Марк (1976). «Связь и электронная структура актинидов металлов». Журнал физики и химии твердого тела. 37 (2): 235–244. Bibcode:1976JPCS ... 37..235F. Дои:10.1016/0022-3697(76)90167-0.
- ^ https://pubs.acs.org/doi/10.1021/jacs.8b09068
- ^ а б c d е ж грамм час я Ауди, Жорж; Берсильон, Оливье; Blachot, Жан; Вапстра, Алдерт Хендрик (2003), "ТогдаUBASE оценка ядерных и распадных свойств », Ядерная физика A, 729: 3–128, Bibcode:2003НуФА.729 .... 3А, Дои:10.1016 / j.nuclphysa.2003.11.001
- ^ а б c d Ghiorso, A .; Харви, B .; Choppin, G .; Thompson, S .; Сиборг, Гленн Т. (1955). Новый элемент Менделевий, атомный номер 101. Физический обзор. 98. С. 1518–1519. Bibcode:1955ПхРв ... 98.1518Г. Дои:10.1103 / PhysRev.98.1518. ISBN 9789810214401.
- ^ а б c d е ж грамм час Чоппин, Грегори Р. (2003). «Менделевий». Новости химии и техники. 81 (36).
- ^ Хофманн, Сигурд (2002). За пределами урана: путешествие к концу таблицы Менделеева. CRC Press. С. 40–42. ISBN 978-0-415-28496-7.
- ^ а б c Холл, Нина (2000). Новая химия. Издательство Кембриджского университета. стр.9 –11. ISBN 978-0-521-45224-3.
- ^ 101. Менделевий - Элементимология и элементы Multidict.. Питер ван дер Крогт.
- ^ Химия, Международный союз теоретических и прикладных наук (1955). Comptes rendus de la confèrence IUPAC.
- ^ Химия, Международный союз теоретических и прикладных наук (1957). Comptes rendus de la confèrence IUPAC.
- ^ Haire, Ричард Г. (2006). «Эйнштейний». In Morss, Lester R .; Эдельштейн, Норман М .; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (PDF). 3 (3-е изд.). Дордрехт, Нидерланды: Springer. С. 1577–1620. Дои:10.1007/1-4020-3598-5_12. ISBN 978-1-4020-3555-5.
- ^ а б c d е Сильва, стр. 1634–5.
- ^ а б Сильва, стр. 1626–8.
- ^ Йоханссон, Бёрье; Розенгрен, Андерс (1975). «Обобщенная фазовая диаграмма для редкоземельных элементов: расчеты и соотношения объемных свойств». Физический обзор B. 11 (8): 2836–2857. Bibcode:1975PhRvB..11.2836J. Дои:10.1103 / PhysRevB.11.2836.
- ^ Хьюлет, Э. К. (1980). «Глава 12. Химия наиболее тяжелых актинидов: фермия, менделевия, нобелия и лоуренсия». В Эдельштейне, Норман М. (ред.). Химия и спектроскопия лантаноидов и актинидов. Серия симпозиумов ACS. 131. стр.239–263. Дои:10.1021 / bk-1980-0131.ch012. ISBN 9780841205680.
- ^ Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press. С. 4.121–4.123. ISBN 978-1439855119.
- ^ а б c d е ж грамм час я j k л м п Сильва, стр. 1635–166.
- ^ Тоошима, Ацуши; Ли, Цзыцзе; Асаи, Масато; Сато, Нозоми; Sato, Tetsuya K .; Кикучи, Такахиро; Канейя, Юске; Китацудзи, Ёсихиро; Цукада, Кадзуаки; Нагаме, Юичиро; Шедель, Маттиас; Ooe, Kazuhiro; Касамацу, Ёситака; Шинохара, Ацуши; Хаба, Хиромицу; Эвен, Юлия (11 октября 2013). «Измерение Md3+/ Мкр2+ Потенциал восстановления, изученный с помощью проточной электролитической хроматографии ». Неорганическая химия. 52 (21): 12311–3. Дои:10.1021 / ic401571h. PMID 24116851.
- ^ Сильва, стр. 1633–164.
- ^ Martin, W. C .; Хэган, Люси; Читатель, Джозеф; Суган, Джек (1974). «Уровни земли и потенциал ионизации для атомов и ионов лантанидов и актинидов» (PDF). J. Phys. Chem. Ref. Данные. 3 (3): 771–9. Bibcode:1974JPCRD ... 3..771M. Дои:10.1063/1.3253147. Архивировано из оригинал (PDF) на 2014-02-11. Получено 2013-10-19.
- ^ Дэвид Р. Лид (редактор), CRC Справочник по химии и физике, 84-е издание. CRC Press. Бока-Ратон, Флорида, 2003 год; Секция 10 «Атомная, молекулярная и оптическая физика»; Ионизационные потенциалы атомов и атомных ионов.
- ^ а б c d е ж грамм час я Сильва, стр. 1630–1.
- ^ а б c d е Nucleonica (2007–2014 гг.). «Универсальная карта нуклидов». Nucleonica. Получено 22 мая 2011.
- ^ Нурмия, Матти (2003). "Нобелий". Новости химии и техники. 81 (36): 178. Дои:10.1021 / cen-v081n036.p178.
- ^ а б c d е ж грамм час я j k л м п Сильва, стр. 1631–3.
- ^ Кох, Лотар (2000). «Трансурановые элементы». Трансурановые элементы в Энциклопедии промышленной химии Ульмана. Вайли. Дои:10.1002 / 14356007.a27_167. ISBN 978-3527306732.
Библиография
- Сильва, Роберт Дж. (2006). «Фермий, менделевий, нобелий и лоуренсий» (PDF). In Morss, Lester R .; Эдельштейн, Норман М .; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов. 3 (3-е изд.). Дордрехт: Спрингер. С. 1621–1651. Дои:10.1007/1-4020-3598-5_13. ISBN 978-1-4020-3555-5. Архивировано из оригинал (PDF) 17 июля 2010 г.
дальнейшее чтение
- Хоффман, Д. К., Гиорсо, А., Сиборг, Г. Т. Трансурановые люди: внутренняя история, (2000), 201–229.
- Морсс, Л. Р., Эдельштейн, Н. М., Фугер, Дж., Химия актинидов и трансактинидов, 3, (2006), 1630–1636.
- Путеводитель по элементам - переработанное издание, Альберт Ствертка, (Oxford University Press; 1998) ISBN 0-19-508083-1

