Платина - Platinum
 | |||||||||||||||||||||||||||||||||||||||||
| Платина | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | /ˈплæт(ɪ)пəм/ | ||||||||||||||||||||||||||||||||||||||||
| Внешность | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес Аr, std(Пт) | 195.084(9)[1] | ||||||||||||||||||||||||||||||||||||||||
| Платина в периодическая таблица | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 78 | ||||||||||||||||||||||||||||||||||||||||
| Группа | группа 10 | ||||||||||||||||||||||||||||||||||||||||
| Период | период 6 | ||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | ||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | ||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Xe ] 4f14 5d9 6 с1 | ||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 17, 1 | ||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||
| Фаза вSTP | твердый | ||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 2041.4 K (1768,3 ° С, 3214,9 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 4098 К (3825 ° С, 6917 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Плотность (возлеr.t.) | 21,45 г / см3 | ||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (приm.p.) | 19,77 г / см3 | ||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 22.17 кДж / моль | ||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 510 кДж / моль | ||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,86 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||
Давление газа
| |||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −3, −2, −1, 0, +1, +2, +3, +4, +5, +6 (мягко говоря базовый окись) | ||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,28 | ||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||||||||||||
| Радиус атома | эмпирические: 139вечера | ||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 136 ± 5 вечера | ||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 175 вечера | ||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||
| Естественное явление | изначальный | ||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | гранецентрированная кубическая (fcc) | ||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 2800 м / с (приr.t.) | ||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 8,8 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 71,6 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 105 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный | ||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | +201.9·10−6 см3/ моль (290 К)[2] | ||||||||||||||||||||||||||||||||||||||||
| Предел прочности | 125–240 МПа | ||||||||||||||||||||||||||||||||||||||||
| Модуль для младших | 168 ГПа | ||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 61 ГПа | ||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 230 ГПа | ||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.38 | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 3.5 | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 400–550 МПа | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 300–500 МПа | ||||||||||||||||||||||||||||||||||||||||
| Количество CAS | 7440-06-4 | ||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||
| Открытие | Антонио де Уллоа (1735) | ||||||||||||||||||||||||||||||||||||||||
| Главный изотопы платины | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Платина это химический элемент с символ Pt и атомный номер 78. Это плотный, податливый, пластичный, очень инертный, драгоценный, серебристо-белый переходный металл. Его название происходит от испанского термина платино, что означает «маленькое серебро».[3][4]
Platinum является членом платиновая группа элементов и группа 10 из периодическая таблица элементов. Имеет шесть встречающихся в природе изотопы. Это один из более редкие элементы в земной коре, при средней численности около 5мкг /кг. Это происходит в некоторых никель и медь руды вместе с некоторыми родные депозиты, в основном в Южная Африка, на долю которого приходится 80% мирового производства. Из-за его редкости в земной коре лишь несколько сотен тонны производятся ежегодно, и, учитывая его важное использование, он очень ценен и является основным товар из драгоценных металлов.[5]
Платина - одна из наименее химически активные металлы. Обладает замечательной устойчивостью к коррозия, даже при высоких температурах, и поэтому считается благородный металл. Следовательно, платина часто бывает химически несвязанной как самородная платина. Поскольку это происходит естественным образом в аллювиальные пески различных рек, он был впервые использован доколумбовый Южноамериканские аборигены производят артефакты. На него ссылались европейские писатели еще в 16 веке, но только после этого Антонио де Уллоа опубликовал отчет о новом металле Колумбийский происхождение в 1748 году, что его начали исследовать ученые.
Платина используется в каталитические преобразователи, Лабораторное оборудование, электрические контакты и электроды, платиновые термометры сопротивления, стоматология оборудование и украшения. Быть тяжелый металл, это приводит к проблемам со здоровьем при воздействии его соли; но из-за своей коррозионной стойкости металлическая платина не оказывает вредного воздействия на здоровье.[6] Соединения, содержащие платину, такие как цисплатин, оксалиплатин и карбоплатин, применяются в химиотерапия против некоторых видов рака.[7]
По состоянию на 2020 год цена платины составляет около 32 долларов за грамм (1000 долларов за грамм). тройская унция ).[8]
Характеристики
Физический
Чистая платина - блестящая, пластичный, и податливый, серебристо-белый металл.[9] Платина более пластична, чем золото, серебро или же медь, поэтому он является наиболее пластичным из чистых металлов, но менее пластичным, чем золото.[10][11] Металл обладает отличной устойчивостью к коррозия, стабилен при высоких температурах и имеет стабильные электрические свойства. Платина окисляется, образуя PtO2, при 500 ° С; этот оксид легко удаляется термически.[12] Он активно реагирует с фтором при 500 ° C (932 ° F) с образованием тетрафторид платины.[13] На него также нападают хлор, бром, йод, и сера. Платина не растворяется в соляной и азотная кислота, но растворяется в горячем царская водка (Смесь азотной и соляной кислот) с образованием платинохлористоводородная кислота, H2PtCl6.[14]
Его физические характеристики и химическая стабильность делают его полезным для промышленного применения.[15] Его устойчивость к износу и потускнению хорошо подходит для использования в мелкой украшения.
Химическая

Самый распространенный состояния окисления платины +2 и +4. Степени окисления +1 и +3 встречаются реже и часто стабилизируются металлическими связями в биметаллических (или полиметаллических) частицах. Как и ожидалось, тетракоординированные соединения платины (II) имеют тенденцию принимать 16-электронные квадратный плоский геометрии. Хотя элементарная платина обычно не реагирует, она растворяется в горячем состоянии. царская водка дать водный платинохлористоводородная кислота (ЧАС2PtCl6):[16]
- Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 НЕТ2 + 4 часа2О
Как мягкая кислота, платина имеет большое сродство к сере, например, на диметилсульфоксид (ДМСО); Сообщалось о множестве комплексов ДМСО, и следует соблюдать осторожность при выборе реакционного растворителя.[17]
В 2007, Герхард Эртль выиграл Нобелевская премия по химии для определения детальных молекулярных механизмов каталитического окисления монооксид углерода над платиной (каталитический нейтрализатор ).[18]
Изотопы
Платина имеет шесть природных изотопы: 190Пт, 192Пт, 194Пт, 195Пт, 196Pt и 198Pt. Большинство обильный из них 195Pt, составляющая 33,83% от всей платины. Это единственный стабильный изотоп с ненулевым спином; с вращением 1/2, 195Сателлитные пики Pt часто наблюдаются в 1Рука 31P-ЯМР-спектроскопия (т.е. Pt-фосфиновые и Pt-алкильные комплексы). 190Pt наименее распространен - всего 0,01%. Из встречающихся в природе изотопов только 190Pt нестабилен, хотя распадается с периодом полураспада 6.5.×1011 лет, вызывая активность 15 Бк / кг природной платины. 198Pt может пройти альфа-распад, но его распад никогда не наблюдался ( период полураспада известно, что длиннее 3,2×1014 годы); поэтому считается стабильным. Платина также содержит 34 синтетических изотопа с атомной массой от 165 до 204, что составляет 40 известных изотопов. Наименее стабильными из них являются 165Pt и 166Pt с периодом полураспада 260 мкс, тогда как наиболее стабильным является 193Pt с периодом полураспада 50 лет. Большинство изотопов платины распадаются под действием некоторой комбинации бета-распад и альфа-распад. 188Пт, 191Pt и 193Pt распадается преимущественно за счет захват электронов. 190Pt и 198По прогнозам, у Pt будет энергетически выгодная двойной бета-распад пути.[19]
Вхождение



Платина - крайне редкий металл,[20] происходит при концентрации всего 0,005 промилле в земной коры.[21][22] Иногда его принимают за серебро. Платина часто бывает химически несвязанной как самородная платина и как сплав с другими металлами платиновой группы и утюг по большей части. Чаще всего самородная платина находится во вторичных месторождениях в г. аллювиальный депозиты. Аллювиальные отложения, используемые доколумбовый люди в Департамент Чоко, Колумбия по-прежнему являются источником металлов платиновой группы. Еще одно крупное аллювиальное месторождение находится в Уральские горы, Россия и до сих пор добывается.[14]
В никель и медь месторождения, металлы платиновой группы встречаются как сульфиды (например, (Pt, Pd) S), теллуриды (например, PtBiTe), антимониды (PdSb) и арсениды (например, PtAs2), так и концевых сплавов с никелем или медью. Арсенид платины, сперрилит (PtAs2), является основным источником платины, связанной с никелевыми рудами в Бассейн Садбери депозит в Онтарио, Канада. В Платина, Аляска, около 17 000 кг (550 000 унций) было добыто с 1927 по 1975 год. Рудник прекратил работу в 1990 году.[23] Редкий сульфидный минерал куперит, (Pt, Pd, Ni) S, наряду с палладий и никель. Куперит встречается в Меренский риф в пределах Бушвельд комплекс, Гаутенг, Южная Африка.[24]
В 1865 г. хромиты были обнаружены в районе Бушвельда в Южной Африке, после чего в 1906 году была обнаружена платина.[25] В 1924 году геолог Ганс Меренский обнаружил большой запас платины в Бушвельдский магматический комплекс в Южной Африке. Определенный слой, который он нашел, назвал Меренский риф, содержит около 75% известной в мире платины.[26][27] Крупные медно-никелевые месторождения вблизи г. Норильск в Россия, а Бассейн Садбери, Канада, являются двумя другими крупными месторождениями. В бассейне Садбери огромное количество переработанной никелевой руды компенсирует тот факт, что платина присутствует только в 0,5 раза. промилле в руде. Меньшие запасы можно найти в США,[27] например в Хребет Абсарока в Монтана.[28] В 2010 году ЮАР была крупнейшим производителем платины с долей почти 77%, за ней следовала Россия с 13%; мировое производство в 2010 году составило 192 000 кг (423 000 фунтов).[29]
Крупные месторождения платины находятся в состоянии Тамил Наду, Индия.[30]
Платина в больших количествах существует на Луна и в метеоритах. Соответственно, платина в несколько большем количестве встречается на участках болид воздействия на Землю, которые связаны с последующим вулканизмом после удара и могут быть добыты экономически; то Бассейн Садбери один из таких примеров.[31]
Соединения
Галогениды
Упомянутая выше гексахлорплатиновая кислота, вероятно, является наиболее важным соединением платины, поскольку она служит предшественником многих других соединений платины. Сам по себе он имеет различные применения в фотографии, гравировке цинка, несмываемые чернила, гальваника, зеркала, окраска фарфора, а также в качестве катализатора.[32]
Обработка платинохлористоводородной кислоты солью аммония, такой как хлорид аммония, дает гексахлороплатинат аммония,[16] который относительно нерастворим в растворах аммония. Нагревание этой соли аммония в присутствии водорода восстанавливает ее до элементарной платины. Гексахлороплатинат калия также нерастворим, и платинохлористоводородная кислота использовалась для определения ионов калия с помощью гравиметрия.[33]
Когда гексахлорплатиновая кислота нагревается, она разлагается через хлорид платины (IV) и хлорид платины (II) до элементарной платины, хотя реакции не идут ступенчато:[34]
- (ЧАС3O)2PtCl6·пЧАС2O ⇌ PtCl4 + 2 HCl + (п + 2) H2О
- PtCl4 ⇌ PtCl2 + Cl2
- PtCl2 ⇌ Pt + Cl2
Все три реакции обратимы. Платина (II) и бромиды платины (IV) также известны. Гексафторид платины сильный окислитель, способный окисляющий кислород.
Оксиды
Оксид платины (IV), PtO2, также известный как 'Катализатор Адамса ', представляет собой черный порошок, растворимый в гидроксид калия (КОН) растворы и концентрированные кислоты.[35] PtO2 и менее распространенный PtO разлагается при нагревании.[9] Оксид платины (II, IV), Pt3О4, образуется в следующей реакции:
- 2 балла2+ + Pt4+ + 4 O2− → Pt3О4
Другие соединения
В отличие от ацетат палладия, платина (II) ацетат не имеется в продаже. Если требуется основание, галогениды использовались в сочетании с ацетат натрия.[17] Сообщалось также об использовании ацетилацетоната платины (II).[36]
Было синтезировано несколько платинидов бария, в которых платина проявляет отрицательные степени окисления в диапазоне от -1 до -2. К ним относятся BaPt, Ба
3Pt
2, и Ба
2Pt.[37] Платинид цезия, CS
2Pt, темно-красное прозрачное кристаллическое соединение[38] было показано, что он содержит Pt2−
анионы.[39] Платина также демонстрирует отрицательную степень окисления на электрохимически восстановленных поверхностях.[40] Отрицательные степени окисления платины необычны для металлических элементов, и их связывают с релятивистской стабилизацией 6s-орбиталей.[39]
Соль Цейзе, содержащий этилен лиганд, был одним из первых металлоорганические соединения обнаруженный. Дихлор (циклоокта-1,5-диен) платина (II) коммерчески доступный олефин комплекс, содержащий легко заменяемые лиганды трески («треска» - это сокращение от 1,5-циклооктадиена). Комплекс трески и галогениды - удобные отправные точки для химии платины.[17]
Цисплатин, или же СНГ-диамминдихлорплатина (II) является первым из серии химиотерапевтических препаратов, содержащих платину (II) с квадратной плоскостью.[41] Другие включают карбоплатин и оксалиплатин. Эти соединения способны сшивание ДНК, и убивают клетки способами, аналогичными алкилированию химиотерапевтические агенты.[42] (Побочные эффекты цисплатина включают тошноту и рвоту, выпадение волос, шум в ушах, потерю слуха и нефротоксичность.)[43][44]

Ион гексахлороплатината

Анион соли Цейзе

Дихлор (циклоокта-1,5-диен) платина (II)

Цисплатин
История
Раннее использование
Археологи обнаружили следы платины в золоте, используемом в древнеегипетских захоронениях еще в 1200 году до нашей эры. Например, ящик из захоронения Шепенупет II было обнаружено, что он был украшен иероглифами из платины и золота.[45] Однако степень знания этого металла древними египтянами неясна. Вполне возможно, что они не узнали, что в их золоте есть платина.[46][47]
Металл использовался доколумбовый Американцы рядом с современностью Эсмеральдас, Эквадор для изготовления изделий из сплава белого золота с платиной. Археологи обычно связывают традицию обработки платины в Южной Америке с Культура Ла Толита (около 600 г. до н.э. - 200 г. н.э.), но точные даты и местоположение затруднены, так как большинство платиновых артефактов из этого района были куплены из вторых рук через торговля древностями а не полученные путем прямых археологических раскопок.[48] Чтобы обработать металл, они соединяли золотой и платиновый порошки. спекание. Полученный золотоплатиновый сплав будет достаточно мягким, чтобы его можно было придать инструментам.[49][50] Платина, используемая в таких объектах, была не чистым элементом, а скорее встречающейся в природе смесью платиновая группа металлы с небольшими количествами палладия, родия и иридия.[51]
Европейское открытие
Первое упоминание платины в Европе появляется в 1557 г. в трудах Итальянский гуманист Юлий Цезарь Скалигер как описание неизвестного благородного металла, найденного между Дарьен и Мексика, «которую ни огонь, ни никакие испанские уловки еще не смогли превратить в жидкость».[52] С самого первого знакомства с платиной испанцы обычно рассматривали металл как своего рода примесь в золоте и относились к нему как к таковой. Его часто просто выбрасывали, и был официальный указ, запрещающий фальсификация золота с примесями платины.[51]

В 1735 г. Антонио де Уллоа и Хорхе Хуан-и-Сантацилия видел, как коренные американцы добывают платину, в то время как испанцы восемь лет путешествовали по Колумбии и Перу. Уллоа и Хуан нашли мины с самородками беловатого металла и увезли их домой в Испанию. Антонио де Уллоа вернулся в Испанию и основал первую минералогическую лабораторию в Испании и был первым, кто систематически изучал платину, что было в 1748 году. Его исторический отчет об экспедиции включал описание платины как неразделимой и неразделимой. кальцинируемый. Уллоа также ожидал открытия платиновых рудников. После публикации отчета в 1748 году Уллоа не стал продолжать исследования нового металла. В 1758 году его отправили руководить добычей ртути в Huancavelica.[52]
В 1741 году Чарльз Вуд,[53] британский металлург, нашел различные образцы колумбийской платины на Ямайке, которые он отправил в Уильям Браунригг для дальнейшего расследования.
В 1750 году, изучив платину, присланную ему Вудом, Браунригг представил подробный отчет о металле. Королевское общество, заявив, что он не видел упоминания об этом ни в каких предыдущих отчетах об известных минералах.[54] Браунригг также отметил чрезвычайно высокую температуру плавления платины и ее тугоплавкость по отношению к бура.[требуется разъяснение ] Другие химики по всей Европе вскоре начали изучать платину, в том числе Андреас Сигизмунд Маргграф,[55] Торберн Бергман, Йенс Якоб Берцелиус, Уильям Льюис, и Пьер Макер. В 1752 г. Хенрик Шеффер опубликовал подробное научное описание металла, которое он назвал «белым золотом», включая отчет о том, как ему удалось сплавить платиновую руду с помощью мышьяк. Шеффер описал платину как менее пластичную, чем золото, но с аналогичной устойчивостью к коррозии.[52]
Средства пластичности
Карл фон Зикинген широко исследовал платину в 1772 году. Ему удалось создать податливый платина легирование его с золотом, растворяя сплав в горячем царская водка, осаждая платину с хлорид аммония, воспламеняя хлороплатинат аммония и ударяя молотком по полученной мелкодисперсной платине, чтобы заставить ее сцепиться. Франц Карл Ахард сделал первый платиновый тигель в 1784 году. Он работал с платиной, сплавлив ее с мышьяком, а позже испаряющийся мышьяк.[52]
Поскольку другие члены семейства платины еще не были обнаружены (платина была первой в списке), Шеффер и Зикинген сделали ложное предположение, что из-за ее твердости, которая немного больше, чем у чистого утюг - платина была бы относительно негибким материалом, временами даже хрупким, хотя на самом деле ее пластичность и ковкость близки к пластичности золота. Их предположений нельзя было избежать, потому что платина, с которой они экспериментировали, была сильно загрязнена небольшими количествами элементов семейства платины, таких как осмий и иридий, среди прочего, охрупчивало платиновый сплав. Легирование этого нечистого платинового остатка, называемого «плиоксеном», с золотом было единственным решением в то время для получения пластичного соединения, но в настоящее время доступна очень чистая платина, и из чистой платины очень легко можно вытянуть очень длинные проволоки из-за ее кристаллической структуры. структура, аналогичная структуре многих мягких металлов.[56]
В 1786 г. Карл III Испании предоставил библиотеку и лабораторию для Пьер-Франсуа Шабано чтобы помочь в его исследовании платины. Шабано удалось удалить из руды различные примеси, включая золото, ртуть, свинец, медь и железо. Это заставило его поверить, что он работал с одним металлом, но на самом деле руда все еще содержала еще не обнаруженные металлы платиновой группы. Это привело к противоречивым результатам в его экспериментах. Порой платина казалась ковкой, но когда ее легировали иридием, она становилась гораздо более ковкой. хрупкий. Иногда металл был полностью негорючим, но при сплаве с осмием он улетучивался. Через несколько месяцев Chabaneau удалось произвести 23 килограмма чистой ковкой платины путем ковки и сжатия губчатой формы в горячем состоянии. Шабено понял, что неплавкость платины повысит ценность изделий из нее, и поэтому вместе с Хоакином Кабесасом начал бизнес по производству платиновых слитков и посуды. Так началось то, что в Испании известно как «платиновый век».[52]
Производство


Платина вместе с остальными металлы платиновой группы, коммерчески получается как побочный продукт из никель и медь добыча и переработка. В течение электрорафинирование меди, благородные металлы, такие как серебро, золото и металлы платиновой группы, а также селен и теллур оседают на дно электролизера в виде «анодного шлама», который образует отправную точку для извлечения металлов платиновой группы.[58]
Если чистая платина обнаружена в россыпные месторождения или других руд, он выделяется из них различными методами вычитания примесей. Поскольку платина значительно плотнее, чем многие из ее примесей, более легкие примеси можно удалить, просто погрузив их в жидкость. Платина - это парамагнитный, тогда как никель и железо оба ферромагнитный. Таким образом, эти две примеси удаляются путем воздействия на смесь электромагнита. Поскольку платина имеет более высокую температуру плавления, чем большинство других веществ, многие примеси можно сжечь или расплавить без плавления платины. Наконец, платина устойчива к соляной и серной кислотам, тогда как другие вещества легко подвергаются их воздействию. Примеси металлов можно удалить, перемешивая смесь в любой из двух кислот и извлекая оставшуюся платину.[59]
Один из подходящих методов очистки сырой платины, содержащей платину, золото и другие металлы платиновой группы, заключается в ее обработке царская водка, в котором растворены палладий, золото и платина, а осмий, иридий, рутений и родий не вступают в реакцию. Золото осаждается добавлением хлорид железа (II) а после отфильтровывания золота платина осаждается в виде хлороплатинат аммония путем добавления хлорид аммония. Хлороплатинат аммония можно превратить в платину при нагревании.[60] Неосаждаемый гексахлороплатинат (IV) можно восстановить элементарной цинк, и аналогичный метод подходит для мелкомасштабного извлечения платины из лабораторных остатков.[61] Добыча и переработка платины наносят ущерб окружающей среде.[62]
Приложения

Из 218 тонн платины, проданной в 2014 году, 98 тонн были использованы для контроль выбросов транспортных средств устройства (45%), 74,7 тонны для ювелирных изделий (34%), 20,0 тонны для химического производства и нефтепереработки (9,2%) и 5,85 тонны для электрических устройств, таких как жесткие диски (2,7%). Остальные 28,9 тонны пошли на различные другие второстепенные применения, такие как медицина и биомедицина, оборудование для производства стекла, паковочные материалы, электроды, противоопухолевые препараты, кислородные датчики, Свечи зажигания и газотурбинные двигатели.[63]
Катализатор
Чаще всего платину используют в качестве катализатор в химических реакциях, часто как платиновый черный. Он использовался в качестве катализатора с начала 19 века, когда порошок платины использовался для катализа воспламенения водорода. Его наиболее важное применение в автомобилях в качестве каталитический нейтрализатор, что позволяет полностью сгорать несгоревшие углеводороды с низкой концентрацией из выхлопных газов в диоксид углерода и водяной пар. Платина также используется в нефтяной промышленности в качестве катализатора в ряде отдельных процессов, но особенно в каталитический риформинг прямогонного нафта в бензин с более высоким октановым числом, который обогащается ароматическими соединениями. PtO2, также известный как Катализатор Адамса, используется в качестве катализатора гидрирования, особенно для растительные масла.[32] Платина также сильно катализирует разложение пероксид водорода в воды и кислород[64] и он используется в топливные элементы[65] в качестве катализатора снижения кислород.[66]
Стандарт

С 1889 по 1960 год метр определялась как длина стержня из платино-иридиевого сплава (90:10), известная как международный прототип счетчика. Предыдущий слиток был сделан из платины в 1799 году. До мая 2019 года килограмм определялась как масса международный прототип килограмма, цилиндр из того же платино-иридиевого сплава, изготовленный в 1879 году.[67]
Стандартная платина Термометр сопротивления (SPRT) - один из четырех типов термометров, используемых для определения Международная температурная шкала 1990 г. (ITS-90), международный стандарт калибровки для измерения температуры. Проволока сопротивления в термометре изготовлена из чистой платины (например, NIST изготовил провода из платинового стержня с химической чистотой 99,999% по весу).[68][69] Помимо лабораторных применений, термометрия сопротивления платины (PRT) также имеет множество промышленных применений, промышленные стандарты включают ASTM E1137 и IEC 60751.
В стандартный водородный электрод также использует платинированный платиновый электрод из-за его коррозионной стойкости и других свойств.[70]
Как вложение
Платина - это драгоценный металл товар; это слиток имеет Код валюты ISO XPT. Монеты, слитки и слитки продаются или собираются. Платина находит применение в ювелирных изделиях, обычно в виде сплава на 90–95% из-за ее инертности. Он используется для этой цели из-за его престижа и неотъемлемой ценности слитков. Издания по торговле ювелирными изделиями советуют ювелирам представлять мельчайшие царапины на поверхности (которые они называют патина ) как желательную особенность в попытке повысить ценность платиновых продуктов.[71][72]
В часовое дело, Vacheron Constantin, Patek Philippe, Rolex, Breitling, и другие компании используют платину для производства своих ограниченных серий часов. Часовщики ценят уникальные свойства платины, поскольку она не тускнеет и не изнашивается (последнее качество по сравнению с золотом).[73]
В периоды устойчивой экономической стабильности и роста цена на платину, как правило, вдвое превышает цену золота, тогда как в периоды экономической неопределенности[74] Цена на платину имеет тенденцию к снижению из-за сокращения промышленного спроса, опускающегося ниже цены золота. Цены на золото более стабильны в период экономического спада, поскольку золото считается безопасной гаванью. Хотя золото также используется в промышленности, особенно в электронике из-за его использования в качестве проводника, спрос на него не так сильно зависит от промышленного использования. В 18 веке редкость платины сделала Короля Людовик XV Франции объявить, что это единственный металл, пригодный для короля.[75]

1000 кубических сантиметров платины с чистотой 99,9%, стоимостью около 696 000 долларов США по ценам 29 июня 2016 г.[76]
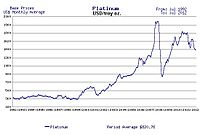
Средняя цена платины с 1992 по 2012 год в долларах США за тройская унция[77]
Другое использование
В лаборатории для электродов используется платиновая проволока; платиновые поддоны и подставки используются в термогравиметрический анализ из-за жестких требований химической инертности при нагревании до высоких температур (~ 1000 ° C). Платина используется в качестве легирующего агента для различных металлических изделий, включая тонкую проволоку, нержавеющие лабораторные контейнеры, медицинские инструменты, зубные протезы, электрические контакты и термопары. Платина-кобальт, сплав примерно трех частей платины и одной части кобальта, используется для создания относительно прочных постоянных магниты.[32] Аноды на основе платины используются на судах, трубопроводах и стальных опорах.[14] Платиновые препараты используются для лечения самых разных видов рака, включая карциномы яичек и яичников, меланому, мелкоклеточный и немелкоклеточный рак легкого, миеломы и лимфомы.[78]
Символ престижа в маркетинге
Редкость платины как металла заставляет рекламодателей ассоциировать ее с исключительностью и богатством. «Платина» дебетовые и кредитные карты иметь больше привилегий, чем "золото " открытки.[79] "Платиновые награды "являются вторыми по величине возможными, занимая выше" золото ","серебро " и "бронза ", но ниже алмаз. Например, в Соединенных Штатах музыкальный альбом, проданный тиражом более 1 миллиона копий, будет считаться «платиновым», тогда как альбом, проданный тиражом более 10 миллионов копий, будет сертифицирован как «алмазный».[80] Некоторые продукты, такие как блендеры и автомобили, серебристо-белого цвета идентифицируются как «платиновые». Платина считается драгоценным металлом, хотя ее использование не так распространено, как золото или серебро. Кадр из Корона королевы Елизаветы Королева-мать, изготовленный для ее коронации как супруга Король Георг VI, изготовлен из платины. Это была первая британская корона, сделанная из этого металла.[81]
Проблемы со здоровьем
Согласно Центры по контролю и профилактике заболеваний Кратковременное воздействие солей платины может вызвать раздражение глаз, носа и горла, а длительное воздействие может вызвать как респираторную, так и кожную аллергию. Электрический ток OSHA стандарт - 2 микрограмма на кубический метр воздуха в среднем за 8-часовую рабочую смену.[82] В Национальный институт охраны труда и здоровья установил рекомендуемый предел воздействия (REL) для платины как 1 мг / м3 за 8-часовой рабочий день.[83]
Платина - это катализатор в изготовлении резинка и гелевые компоненты нескольких видов медицинские имплантаты (грудные имплантаты, протезирование суставов, искусственные поясничные диски, порты доступа к сосудам и т. д.) возможность того, что платина может попасть в организм и вызвать побочные эффекты, заслуживает изучения. В Управление по контролю за продуктами и лекарствами и другие учреждения рассмотрели этот вопрос и не обнаружили никаких доказательств токсичности in vivo.[84][85] Платина была определена FDA как «поддельное лекарство от рака».[86]
Смотрите также
Рекомендации
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ Weast, Роберт (1984). CRC, Справочник по химии и физике. Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
- ^ «платина (Pt)». В архиве 5 апреля 2012 г. Wayback Machine Энциклопедия Britannica Online. Энциклопедия Britannica Inc., 2012. Интернет. 24 апреля 2012 г.
- ^ Харпер, Дуглас. "платина". Интернет-словарь этимологии.
- ^ Хобсон, Питер. «Валютные потрясения сбивают платину до 10-летних минимумов». Рейтер. Получено 20 августа 2018.
- ^ «Глава 6.11 Платина» (PDF), Рекомендации по качеству воздуха (Второе изд.), Европейское региональное бюро ВОЗ, Копенгаген, Дания, 2000 г., в архиве (PDF) из оригинала 18 октября 2012 г.
- ^ Wheate, N.J .; Уокер, S .; Craig, G.E .; Оун, Р. (2010). «Состояние противоопухолевых препаратов платины в клинике и клинических исследованиях» (PDF). Dalton Transactions. 39 (35): 8113–27. Дои:10.1039 / C0DT00292E. HDL:2123/14271. PMID 20593091.
- ^ «Живые графики цен на платину в долларах США и исторические данные». APMEX.
- ^ а б Лаговски, Дж. Дж., Изд. (2004). Основы и приложения химии. 3. Томсон Гейл. стр.267–268. ISBN 978-0-02-865724-0.
- ^ CRC press энциклопедия материалов и отделки, 2-е издание, Мел Шварц, 2002 г.
- ^ Справочник по материалам, пятнадцатое издание, McGraw-Hill, John Vaccari, 2002
- ^ "Дж. К. Чэстон, Platinum Metals Rev. 8, 50 (1964)" (PDF).
- ^ Сэр Норман Локьер (1891). Природа. Macmillan Journals Limited. стр. 625–. В архиве из оригинала от 24 марта 2017 г.
- ^ а б c Участники CRC (2007–2008 гг.). «Платина». В Лиде, Дэвид Р. (ред.). CRC Справочник по химии и физике. 4. Нью-Йорк: CRC Press. п. 26. ISBN 978-0-8493-0488-0.
- ^ Крейг, Брюс Д; Андерсон, Дэвид С; International, A.S.M. (Январь 1995 г.). «Платина». Справочник данных по коррозии. С. 8–9. ISBN 978-0-87170-518-1. В архиве из оригинала от 24 марта 2017 г.
- ^ а б Кауфман, Джордж Б.; Тернер, Джозеф Дж .; Затко, Давид А. (1967). Гексахлороплатинат аммония (IV). Неорганические синтезы. 9. С. 182–185. Дои:10.1002 / 9780470132401.ch51. ISBN 978-0-470-13240-1.
- ^ а б c Han, Y .; Huynh, H. V .; Тан, Г. К. (2007). «Моно- и бис (карбен) комплексы: подробное исследование платины (II) -бензимидазолин-2-илидены». Металлоорганические соединения. 26 (18): 4612–4617. Дои:10.1021 / om700543p.
- ^ Эртль, Герхард (2008). «Реакции на поверхности: от атомов к сложности (Нобелевская лекция)». Angewandte Chemie International Edition. 47 (19): 385–407. Дои:10.1002 / anie.200800480. PMID 18357601.
- ^ Ауди, Жорж; Берсильон, Оливье; Blachot, Жан; Вапстра, Алдерт Хендрик (2003), "ТогдаUBASE оценка ядерных и распадных свойств », Ядерная физика A, 729: 3–128, Bibcode:2003НуФА.729 .... 3А, Дои:10.1016 / j.nuclphysa.2003.11.001
- ^ Природные богатства Земли: аудит В архиве 7 ноября 2014 г. Wayback Machine. Новый ученый. 23 мая 2007 г.
- ^ Стеллман, Жанна Магер (1998). Энциклопедия по охране труда: химия, промышленность и профессии. Международная организация труда. п. 141. ISBN 978-92-2-109816-4. В архиве из оригинала от 24 марта 2017 г.
- ^ Мурата, К. Дж. (1958). в симпозиуме по спектрохимическому анализу микроэлементов. ASTM International. п. 71. В архиве из оригинала от 24 марта 2017 г.
- ^ «История платины». База данных сообщества Аляски в Интернете. ExploreNorth. В архиве из оригинала 22 декабря 2010 г.. Получено 12 апреля 2011.
Platinum расположен на берегу Берингова моря, у подножия Красной горы на южной косе залива Гудньюс.
- ^ Xiao, Z .; Лапланте, А. Р. (2004). «Характеристика и извлечение минералов платиновой группы - обзор». Минерал Инжиниринг. 17 (9–10): 961–979. Дои:10.1016 / j.mineng.2004.04.001.
- ^ Дэн Оанча Платина в Южной Африке В архиве 13 августа 2011 г. Wayback Machine. MINING.com. Сентябрь 2008 г.
- ^ Р. Грант Коуторн (1999). «Семьдесят пятая годовщина открытия платиноносного рифа Меренского». Обзор платиновых металлов. Получено 24 декабря 2017.
- ^ а б Сеймур, Р. Дж .; О'Фаррелли, Дж. И. (2001). «Металлы платиновой группы». Энциклопедия химической технологии Кирка Отмера. Вайли. Дои:10.1002 / 0471238961.1612012019052513.a01.pub2. ISBN 978-0471238966.
- ^ «Добыча платины в Монтане». Нью-Йорк Таймс. 13 августа 1998 г. В архиве из оригинала 3 февраля 2008 г.. Получено 9 сентября 2008.
- ^ Лоферски, П. Дж. (Июль 2012 г.). «Металлы платиновой группы» (PDF). Программа минеральных ресурсов USGS. В архиве (PDF) из оригинала 7 июля 2012 г.. Получено 17 июля 2012.
- ^ «Доказательства огромных залежей платины в государстве». Индуистский. Ченнаи, Индия. 2 июля 2010 г. В архиве из оригинала от 6 декабря 2011 г.
- ^ Кёберл, Кристиан (1998). «Выявление метеоритных компонентов в имактитах». Метеориты: поток во времени и эффекты удара. С. 133–155. ISBN 978-1-86239-017-1. В архиве из оригинала от 24 марта 2017 г.
- ^ а б c Кребс, Роберт Э. (1998). «Платина». История и использование химических элементов нашей Земли. Гринвуд Пресс. стр.124–127. ISBN 978-0-313-30123-0.
- ^ Smith, G.F .; Гринг, Дж. Л. (1933). «Разделение и определение щелочных металлов с использованием хлорной кислоты. V. Хлорная кислота и хлороплатиновая кислота в определении малых количеств калия в присутствии больших количеств натрия». Журнал Американского химического общества. 55 (10): 3957–3961. Дои:10.1021 / ja01337a007.
- ^ Schweizer, A.E .; Керр, Г. Т. (1978). «Термическое разложение платинохлористоводородной кислоты». Неорганическая химия. 17 (8): 2326–2327. Дои:10.1021 / ic50186a067.
- ^ Перри, Д. Л. (1995). Справочник неорганических соединений. Природа. 177. С. 296–298. Bibcode:1956Натура.177..639.. Дои:10.1038 / 177639a0. ISBN 978-0-8493-8671-8. S2CID 4184615.
- ^ Аренс, Себастьян; Страсснер, Томас (2006). «Беспроблемный синтез комплексов платина-бис-NHC хлорид, их структура и каталитическая активность при активации метана с помощью CH». Неорганика Chimica Acta. 359 (15): 4789–4796. Дои:10.1016 / j.ica.2006.05.042.
- ^ Карпов, Андрей; Конума, Мицухару; Янсен, Мартин (2006). «Экспериментальное доказательство отрицательных степеней окисления платины: ESCA-измерения на платинидах бария». Химические коммуникации. 44 (8): 838–840. Дои:10.1039 / b514631c. PMID 16479284.
- ^ Карпов, Андрей; Нусс, Юрген; Ведиг, Ульрих; Янсен, Мартин (2003). «Cs2Pt: платинид (-II), демонстрирующий полное разделение заряда». Angewandte Chemie International Edition. 42 (39): 4818–4821. Дои:10.1002 / anie.200352314. PMID 14562358.
- ^ а б Янсен, Мартин (2005). «Влияние релятивистского движения электронов на химию золота и платины». Науки о твердом теле. 7 (12): 1464–1474. Bibcode:2005SSSci ... 7.1464J. Дои:10.1016 / j.solidstatesciences.2005.06.015.
- ^ Ghilane, J .; Lagrost, C .; Guilloux-Viry, M .; Simonet, J .; и другие. (2007). "Спектроскопические доказательства отрицательного окислительного состояния платины на электрохимически восстановленных поверхностях". Журнал физической химии C. 111 (15): 5701–5707. Дои:10.1021 / jp068879d.
- ^ Ридделл, Имоджен А .; Липпард, Стивен Дж. (2018). «Цисплатин и оксалиплатин: наше текущее понимание их действий». В Сигеле, Астрид; Сигель, Гельмут; Фрайзингер, Ева; Сигель, Роланд К. О. (ред.). Металло-препараты: разработка и действие противоопухолевых средств. Ионы металлов в науках о жизни. 18. С. 1–42. Дои:10.1515/9783110470734-007. ISBN 978-3-11-046984-4. PMID 29394020.
- ^ Richards, A.D .; Роджер, А. (2007). «Синтетические металломолекулы как средства контроля структуры ДНК» (PDF). Обзоры химического общества. 36 (3): 471–483. Дои:10.1039 / b609495c. PMID 17325786.
- ^ Кариндер, Джеймс А .; Моррисон, Пилар М .; Моррисон, Дэвид Дж .; Джек Э. Сокс III (7 июля 2014 г.). Практические протоколы онкологии. Милл Сити Пресс, Инкорпорейтед. п. 22. ISBN 978-1-62652-816-1. В архиве из оригинала 9 ноября 2017 г.. Получено 11 июн 2016.
- ^ Тагучи, Такаши; Назнин, Арифа; Абид, М. Рухул; Раззак, Мохаммед С. (2005). Нефротоксичность и патологические явления, связанные с цисплатином. Вклад в нефрологию. 148. С. 107–121. Дои:10.1159/000086055. ISBN 978-3-8055-7858-5. PMID 15912030. S2CID 24509477.
- ^ Бертело, М. (1901). "Sur les métaux égyptiens: Présence du platine parmi les caractères d'inscriptions hiéroglyphiques, confié à mon excn" [О египетских металлах: наличие платины среди знаков иероглифических надписей, порученных мне исследовать]. Comptes rendus de l'Académie des Sciences (На французском). 132: 729.
- ^ Райнер В. Гессе (2007). История ювелирного дела: энциклопедия. Издательская группа "Гринвуд". С. 155–156. ISBN 978-0-313-33507-5.
- ^ Огден, Джек М. (1976). «Так называемые« платиновые »включения в египетских золотых изделиях». Журнал египетской археологии. Публикации SAGE. 62 (1): 138–144. Дои:10.1177/030751337606200116. ISSN 0307-5133. S2CID 192364303.
- ^ Дэвид А. Скотт и Уорвик Брей (1980). «Древняя платиновая технология в Южной Америке: ее использование индейцами в доиспанские времена». Обзор платиновых металлов. Получено 5 ноября 2018.
- ^ Бергсе, Пол (1936). «Металлургия золота и платины у индейцев доколумбовой эпохи». Природа. ООО "Спрингер Сайенс энд Бизнес Медиа". 137 (3453): 29. Дои:10.1038 / 137029a0. ISSN 0028-0836. S2CID 4100269.
- ^ Meeks, N .; La Niece, S .; Эстевес, П. (2002). «Технология раннего покрытия платиной: золотая маска культуры Ла-Толита, Эквадор». Археометрия. Вайли. 44 (2): 273–284. Дои:10.1111 / 1475-4754.t01-1-00059. ISSN 0003-813X.
- ^ а б Дональд Макдональд, Лесли Б. Хант (1982). История платины и родственных ей металлов. Johnson Matthey Plc. С. 7–8. ISBN 978-0-905118-83-3.
- ^ а б c d е Уикс, М. Э. (1968). Открытие элементов (7-е изд.). Журнал химического образования. стр.385 –407. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Диксон, Джошуа; Браунригг, Уильям (1801). Литературная жизнь Уильяма Браунригга. К этому добавлен отчет об угольных шахтах около Уайтхейвена: и наблюдения о средствах предотвращения эпидемических лихорадок.. п. 52. В архиве из оригинала от 24 марта 2017 г.
- ^ Watson, Wm; Браунригг, Уильям (1749). "Несколько статей о новом полуметалле, названном Platina; переданы Королевскому обществу г-ном Уильямом Уотсоном Ф. Р. С." (PDF). Философские труды. 46 (491–496): 584–596. Bibcode:1749РСПТ ... 46..584Вт. Дои:10.1098 / rstl.1749.0110. S2CID 186213277. Архивировано из оригинал (PDF) 21 октября 2013 г.
- ^ Маргграф, Андреас Сигизмунд (1760). Versuche mit dem neuen Mineralischen Körper Platina del pinto genannt. В архиве из оригинала от 24 марта 2017 г.
- ^ Платина В архиве 22 декабря 2011 г. Wayback Machine. mysite.du.edu
- ^ Келли, Томас Д. и Матос, Греция Р. (2013)Историческая статистика минералов и сырьевых товаров в США В архиве 4 июня 2013 г. Wayback Machine, Геологическая служба США
- ^ Лоферски, П. Дж. (Октябрь 2011 г.). «Ежегодник полезных ископаемых 2010; металлы платиновой группы» (PDF). Программа минеральных ресурсов USGS. В архиве (PDF) из оригинала 8 июля 2012 г.. Получено 17 июля 2012.
- ^ Хейзерман, Дэвид Л. (1992). Изучение химических элементов и их соединений. TAB Книги. стр.272–274. ISBN 978-0-8306-3018-9.
- ^ Хант, Л. Б .; Рычаг, Ф. М. (1969). «Платиновые металлы: обзор производственных ресурсов для промышленного использования» (PDF). Обзор платиновых металлов. 13 (4): 126–138. В архиве (PDF) из оригинала от 29 октября 2008 г.
- ^ Кауфман, Джордж Б .; Тетер, Ларри А. и Рода, Ричард Н. (1963). Извлечение платины из лабораторных остатков. Неорг. Синтезатор. Неорганические синтезы. 7. С. 232–236. Дои:10.1002 / 9780470132388.ch61. ISBN 978-0-470-13238-8.
- ^ «Архивная копия» (PDF). В архиве (PDF) из оригинала 5 октября 2016 г.. Получено 4 октября 2016.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Лоферски, П. Дж. (Июль 2016 г.). «Ежегодник полезных ископаемых 2014; металлы платиновой группы» (PDF). Программа минеральных ресурсов USGS. В архиве (PDF) с оригинала 18 августа 2016 г.. Получено 11 июля 2016.
- ^ Петруччи, Ральф Х. (2007). Общая химия: принципы и современные приложения (9-е изд.). Прентис Холл. п. 606. ISBN 978-0-13-149330-8.
- ^ Ларами, Джеймс; Дикс, Эндрю (2003). Объяснение системы топливных элементов. John Wiley & Sons Ltd. ISBN 978-0-470-84857-9.
- ^ Wang, C .; Daimon, H .; Онодера, Т .; Koda, T .; Солнце, С. (2008). «Общий подход к контролю размера и формы наночастиц платины и их каталитическому восстановлению кислорода». Angewandte Chemie International Edition. 47 (19): 3588–3591. Дои:10.1002 / anie.200800073. PMID 18399516.
- ^ Гупта, С. В. (2010). «Глава 4. Соглашение о счетчиках и эволюция базовых единиц». Серия Springer по материаловедению, том 122. Серия Спрингера по материаловедению. 122. п. 47. Дои:10.1007/978-3-642-00738-5_4. ISBN 978-3-642-00777-4.
- ^ «Руководство по реализации ITS-90 - Платиновая термометрия сопротивления» (PDF). Международный комитет мер и весов.
- ^ «Стандартный эталонный материал 1750: стандартные платиновые термометры сопротивления, от 13,8033 К до 429,7485 К» (PDF). NIST.
- ^ Feltham, A.M .; Спиро, Майкл (1971). «Платинированные платиновые электроды». Химические обзоры. 71 (2): 177–193. Дои:10.1021 / cr60270a002.
- ^ "Архив журнала профессиональных ювелиров, август 2004 г.". В архиве из оригинала 28 сентября 2011 г.. Получено 19 июн 2011.
- ^ «Платиновый праймер». Diamond Cutters International. 12 декабря 2008 г. В архиве из оригинала 27 сентября 2011 г.. Получено 18 июн 2011.
- ^ «Неизвестные факты о платине». watch.infoniac.com. Архивировано из оригинал 21 сентября 2008 г.. Получено 9 сентября 2008.
- ^ «Платина против золота». Спекулятивный инвертор. 14 апреля 2002 г. Архивировано с оригинал 26 октября 2008 г.
- ^ «Платина». Зона минералов. Архивировано из оригинал 12 октября 2008 г.. Получено 9 сентября 2008.
- ^ «21.09 кг Pt». Вольфрам Альфа. В архиве из оригинала 23 августа 2014 г.. Получено 14 июля 2012.
- ^ «Исправление статистики». Лондонский рынок платины и палладия. Архивировано из оригинал 25 января 2010 г.. Получено 13 июн 2010.
- ^ Приложения, Майкл Джи; Чой, Юджин Х.И.; Уит, Ниал Дж (август 2015 г.). «Текущее состояние и будущее платиновых препаратов». Эндокринный рак. Общество эндокринологов. 22 (4): R219 – R233. Дои:10.1530 / ERC-15-0237. PMID 26113607.
- ^ Гвин, Джон (1986). «Ценообразование на продукты финансовых институтов». Журнал маркетинга профессиональных услуг. 1 (3): 91–99. Дои:10.1300 / J090v01n03_07.
- ^ Крауз, Ричард (1 мая 2000 г.). Big Bang Baby: Рок-викторина. п. 126. ISBN 978-0-88882-219-2. В архиве из оригинала от 24 марта 2017 г.
- ^ Гаудинг, Мадонна (6 октября 2009 г.). Библия знаков и символов: полное руководство по загадочным отметкам. ISBN 978-1-4027-7004-3. В архиве из оригинала от 24 марта 2017 г.
- ^ «Руководство по гигиене труда для растворимых солей платины (как платина)» (PDF). Центры по контролю и профилактике заболеваний. В архиве (PDF) из оригинала 11 марта 2010 г.. Получено 9 сентября 2008.
- ^ "CDC - Карманный справочник NIOSH по химическим опасностям - платина". www.cdc.gov. В архиве из оригинала 21 ноября 2015 г.. Получено 21 ноября 2015.
- ^ «Справочная информация FDA о платине в силиконовых грудных имплантатах». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Архивировано из оригинал 24 июля 2008 г.. Получено 9 сентября 2008.
- ^ Брук, Майкл (2006). «Платина в силиконовых грудных имплантатах». Биоматериалы. 27 (17): 3274–3286. Дои:10.1016 / j.biomaterials.2006.01.027. PMID 16483647.
- ^ «Потребители должны избегать 187 поддельных лекарств от рака». НАС. Управление по контролю за продуктами и лекарствами. Архивировано из оригинал 2 мая 2017 г.. Получено 20 мая 2020.
дальнейшее чтение
- Янг, Гордон (ноябрь 1983 г.). «Чудо-металл - платина». Национальная география. Vol. 164 нет. 5. С. 686–706. ISSN 0027-9358. OCLC 643483454.
внешняя ссылка
- Платина (химический элемент) на Британская энциклопедия
- Платина в Периодическая таблица видео (Ноттингемский университет)
- Нуклиды и изотопы Четырнадцатое издание: карта нуклидов, General Electric Company, 1989.
- Карманный справочник NIOSH по химической опасности - платина Центры по контролю и профилактике заболеваний
- "База данных PGM".
- «Сбалансированный исторический отчет о последовательности открытий платины; иллюстрированный».
- «Johnson Matthey Technology Review: бесплатный ежеквартальный журнал исследований науки и технологий в промышленных приложениях (ранее издавался как Platinum Metals Review)».
- «Статистика и информация о металлах платиновой группы». Геологическая служба США.
- «Международная ассоциация металлов платиновой группы».







