Сульфид цезия - Википедия - Caesium sulfide
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфид цезия | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| CS2S | |
| Молярная масса | 297.876 |
| Внешность | белый кристалл |
| Плотность | 4,19 г · см−3[1] |
| Температура плавления | 480 ° С[2] |
| гидролизуется с образованием бисульфид цезия[3] | |
| Растворимость в этиловый спирт и глицерин | растворимый |
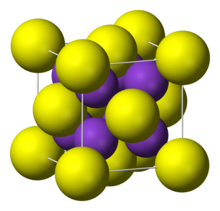
| Структура | |
| кубический, анти-флюорит | |
| Опасности | |
| Главный опасности | токсичный |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H314, H400 | |
| P260, P264, P273, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P391, P405, P501 | |
| Родственные соединения | |
Другой анионы | оксид цезия селенид цезия теллурид цезия полонид цезия |
Другой катионы | сульфид калия, сульфид лития, сульфид рубидия, сульфид натрия, сульфид франция |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Сульфид цезия является неорганический соль с химической формулой Cs2S. Это сильная щелочь в водном растворе. В воздухе сульфид цезия выделяет запах тухлых яиц. сероводород.
Производство
Похожий на сульфид натрия, безводный сульфид цезия может быть получен путем реакции цезий и сера в THF. Это нужно аммиак или же нафталин реагировать.[4]
- 2Cs + S → Cs2S
Путем растворения сероводород в гидроксид цезия решение, это произведет бисульфид цезия, то он также будет производить сульфид цезия.[5][6]。
- CsOH + H2S → CsHS + H2О
- CsHS + CsOH → Cs2S + H2О
Рекомендации
- ^ Соммер, Гельмут; Хоппе, Рудольф. Кристаллическая структура сульфида цезия и примечание о селениде цезия, теллуриде цезия, селениде рубидия и теллуриде рубидия (на немецком). Zeitschrift fuer Anorganische und Allgemeine Chemie, 1977. 429: 118-30. ISSN: 0044-2313
- ^ Дейл Л. Перри, Сидни Л. Филлипс: Справочник неорганических соединений. CRC Press, 1995, ISBN 978-0-8493-8671-8, С. 336 ([1], п. 336, в Google Книги ).
- ^ Жан Д'Анс, Эллен Лакс: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997 г., ISBN 978-3-5406-0035-0, С. 692 ([2], п. 692, в Google Книги ).
- ^ Ж.-Х. Так и П. Буджук (1992). Н. Г. Рассел (ред.). «Гексаметилдисилатиан». Неорганические синтезы. Дои:10.1002 / 9780470132609.ch11.
- ^ Вильгельм Блиц, Эрнст Вильке-Дёрфурт: «Убер-сульфид рубидиев и цезий» в Zeitschr. f. анорг. Chem. 1906. 48, С. 297–317. Volltext
- ^ Р. Абегг, Ф. Ауэрбах: «Handbuch der anorganischen Chemie». Verlag S. Hirzel, Bd. 2, 1908. С. 430.Volltext
