Ацетил-КоА - Acetyl-CoA
эта статья имеет нечеткий стиль цитирования. (Август 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
 | |
 | |
| Имена | |
|---|---|
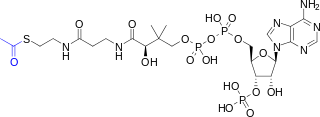
| Название ИЮПАК S-[2-[3-[[(2р)-4-[[[(2р,3S,4р,5р) -5- (6-аминопурин-9-ил) -4-гидрокси-3-фосфонооксиоксолан-2-ил] метоксигидроксифосфорил] оксигидроксифосфорил] окси-2-гидрокси-3,3-диметилбутаноил] амино] пропаноиламино] этил] этантиоат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.000.719 |
| КЕГГ | |
| MeSH | Ацетил + Коэнзим + А |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C23ЧАС38N7О17п3S | |
| Молярная масса | 809.57 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ацетил-КоА (ацетилкофермент А) представляет собой молекулу, которая участвует во многих биохимические реакции в белке, углеводах и липидах метаболизм.[1] Его основная функция - доставить ацетил группа в цикл лимонной кислоты (Цикл Кребса) быть окисленный для производства энергии. Коэнзим А (CoASH или CoA) состоит из β-меркаптоэтиламиновая группа связано с витамином пантотеновая кислота (B5) через амидная связь [2] и 3'-фосфорилированный АДФ. Ацетильная группа (обозначенная синим цветом на структурной диаграмме справа) ацетил-КоА связана с сульфгидрил заместитель β-меркаптоэтиламиновой группы. Этот тиоэфир связь представляет собой «высокоэнергетическую» связь, которая особенно реактивна. Гидролиз тиоэфирной связи экзергонический (-31,5 кДж / моль).
КоА ацетилируется до ацетил-КоА за счет разложения углеводы через гликолиз и разбивкой жирные кислоты через β-окисление. Затем ацетил-КоА входит в цикл лимонной кислоты, где ацетильная группа окисляется до диоксида углерода и воды, а выделяемая энергия улавливается в форме 11 АТФ и один GTP на ацетильную группу.
Конрад Блох и Федор Линен были награждены 1964 г. Нобелевская премия по физиологии и медицине за их открытия, связывающие метаболизм ацетил-КоА и жирных кислот. Фриц Липманн получил Нобелевскую премию в 1953 году за открытие кофактора кофермент А.
Прямой синтез
Ацетилирование КоА определяется источниками углерода.[3][4]
Внемитохондриальный
- На высоком глюкоза уровни гликолиз происходит быстро, что увеличивает количество цитрат производится из цикла трикарбоновых кислот. Этот цитрат затем экспортируется в другие органеллы вне митохондрий, чтобы расщепиться на ацетил-КоА и оксалоацетат посредством фермент Цитрат лиаза АТФ (ACL). Эта основная реакция сопровождается гидролизом АТФ.[5][6]
- При низком уровне глюкозы:
- КоА ацетилируется с использованием ацетат к ацетил-КоА синтетаза (ACS), также в сочетании с АТФ гидролиз.[7]
- Этиловый спирт также служит источником углерода для ацетилирования КоА с использованием фермента алкогольдегидрогеназа.[8]
- Деградация разветвленной цепи кетогенный аминокислоты такие как валин, лейцин, и изолейцин происходит. Эти аминокислоты превращаются в α-кетокислоты путем трансаминирование и, в конечном итоге, в изовалерил-КоА посредством окислительного декарбоксилирования комплексом α-кетокислоты дегидрогеназы. Изовалерил-КоА подвергается дегидрирование, карбоксилирование и гидратация с образованием другого промежуточного соединения - производного КоА перед его расщеплением на ацетил-КоА и ацетоацетат.[9][страница нужна ]
Внутримитохондриальный

- При высоком уровне глюкозы ацетил-КоА производится через гликолиз.[10] Пируват подвергается окислительному декарбоксилированию, при котором теряет свое карбоксил группа (как углекислый газ ) с образованием ацетил-КоА с выделением энергии 33,5 кДж / моль. Окислительное превращение пирувата в ацетил-КоА обозначается как пируватдегидрогеназная реакция. Катализируется пируватдегидрогеназный комплекс. Возможны другие превращения пирувата в ацетил-КоА. Например, пируват формиатлиаза диспропорционирует пируват в ацетил-КоА и Муравьиная кислота.
- При низком уровне глюкозы производство ацетил-КоА связано с β-окисление из жирные кислоты. Жирные кислоты сначала превращаются в ацил-КоА. Затем ацил-КоА разлагается в четырехступенчатом цикле окисления, гидратации, окисления и тиолиз катализируется четырьмя соответствующими ферментами, а именно ацил-КоА дегидрогеназа, еноил-КоА гидратаза, 3-гидроксиацил-КоА дегидрогеназа, и тиолаза. Цикл производит новую цепь жирных кислот с двумя атомами углерода меньше, и ацетил-КоА в качестве побочного продукта.[11]
Функции
Промежуточные звенья в различных путях
- В клеточном дыхании
- Цикл лимонной кислоты:
- В результате ряда химических реакций накопленная энергия высвобождается в результате окисления ацетил-КоА, полученного из углеводов, жиров и белков, в аденозинтрифосфат (АТФ) и углекислый газ.
- Метаболизм жирных кислот
- Ацетил-КоА образуется при распаде обоих углеводы (к гликолиз ) и липиды (к β-окисление ). Затем он входит в цикл лимонной кислоты в митохондрии, соединяясь с оксалоацетат формировать цитрат.[12][13]
- Две молекулы ацетил-КоА конденсируются с образованием ацетоацетил-КоА, что приводит к образованию ацетоацетат и β-гидроксибутират.[12] Ацетоацетат, β-гидроксибутират и продукты их самопроизвольного распада ацетон[14] часто, но сбивает с толку, известны как кетоновые тела (поскольку это вовсе не «тела», а водорастворимые химические вещества). Кетоновые тела высвобождаются печень в кровь. Все клетки с митохондриями могут забирать кетоновые тела из крови и преобразовывать их в ацетил-КоА, который затем можно использовать в качестве топлива в их циклах лимонной кислоты, поскольку никакая другая ткань не может отводить оксалоацетат в кровь. глюконеогенный путь так, как это делает печень. В отличие от свободных жирных кислот кетоновые тела могут пересекать гематоэнцефалический барьер и поэтому доступны в качестве топлива для ячеек Центральная нервная система, действуя как заменитель глюкозы, на которой эти клетки обычно выживают.[12] Возникновение высокого уровня кетоновых тел в крови во время голодание, а низкоуглеводная диета, длительные тяжелые упражнения и неконтролируемые сахарный диабет 1 типа известен как кетоз, и в его крайней форме при неконтролируемом сахарном диабете 1 типа, как кетоацидоз.
- С другой стороны, когда инсулин концентрация в крови высокая, а глюкагон При низком уровне (т.е. после еды) ацетил-КоА, образующийся в результате гликолиза, конденсируется как обычно с оксалоацетатом с образованием цитрата в митохондрии. Однако вместо продолжения цикла лимонной кислоты для превращения в диоксид углерода и воду цитрат удаляется из митохондрии в цитоплазма.[12] Там он расщеплен Цитрат лиаза АТФ на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малата (а затем превращается обратно в оксалоацетат для переноса большего количества ацетил-КоА из митохондрии).[15] Этот цитозольный ацетил-КоА затем можно использовать для синтеза жирных кислот посредством карбоксилирования путем ацетил-КоА карбоксилаза в малонил-КоА, первый совершенный шаг в синтезе жирных кислот.[15][16] Это преобразование происходит в первую очередь в печени, жировая ткань и кормящим молочные железы, где жирные кислоты сочетаются с глицерин формировать триглицериды, основной резервуар топлива для большинства животных. Жирные кислоты также входят в состав фосфолипиды которые составляют основную часть липидные бислои из всех клеточные мембраны.[12]
- У растений de novo синтез жирных кислот происходит в пластиды. Много семена накапливать большие резервуары масел семян для поддержки прорастание и ранний рост саженца, прежде чем он станет сеткой фотосинтетический организм.
- В цитозольный ацетил-КоА также может конденсироваться с ацетоацетил-КоА с образованием 3-гидрокси-3-метилглутарил-КоА (HMG-CoA ), который является этапом ограничения скорости, контролирующим синтез холестерина.[12] Холестерин может использоваться как структурный компонент клеточных мембран или может использоваться для синтеза стероидные гормоны, желчные соли, и Витамин Д.[12][16]
- Ацетил-КоА может быть карбоксилированный в цитозоле ацетил-КоА карбоксилаза, порождая малонил-КоА, субстрат, необходимый для синтеза флавоноиды и связанные поликетиды, для удлинения жирных кислот с образованием воск, кутикула, и растительные масла в членах Brassica семья, и для малоновость белков и других фитохимических веществ.[17] У растений к ним относятся сесквитерпены, брассиностероиды (гормоны) и мембрана стеролы.
- Синтез стероидов:
- Ацетил-КоА участвует в мевалонатный путь участвуя в синтезе гидроксиметилглутарил-КоА.
- Ацетилхолин синтез:
- Ацетил-КоА также является важным компонентом биогенного синтеза нейротрансмиттер ацетилхолин. Холин в сочетании с ацетил-КоА катализируется ферментом холина ацетилтрансфераза производить ацетилхолин и кофермент А как побочный продукт.
- Мелатонин синтез
- Ацетилирование
- Ацетил-КоА также является источником ацетильной группы, включенной в некоторые лизин остатки гистон и негистоновые белки в посттрансляционная модификация ацетилирование. Это ацетилирование катализируется ацетилтрансферазы. Это ацетилирование влияет на рост клеток, митоз, и апоптоз.[18]
- Аллостерический регулятор
- Ацетил-КоА служит аллостерический регулятор из киназа пируватдегидрогеназы (ПДК). Он регулируется через соотношение ацетил-КоА по сравнению с КоА. Повышенная концентрация ацетил-КоА активирует PDK.[19]
- Ацетил-КоА также является аллостерическим активатором пируваткарбоксилаза.[20]
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы посетить Джин Вики страниц и связанных статей Википедии. Путь можно скачать и отредактировать на WikiPathways.
Цикл TCA редактировать | Путь статинов редактировать |
Смотрите также
Рекомендации
- ^ «Ацетил-КоА Перекресток». chemistry.elmhurst.edu. Получено 2016-11-08.
- ^ «Жирные кислоты - структура ацетил-КоА». library.med.utah.edu. Получено 2017-06-02.
- ^ Хайнс, Майкл Дж .; Мюррей, Сандра Л. (01.07.2010). «АТФ-цитрат лиаза необходима для производства цитозольного ацетилкофермента А и развития в Aspergillus nidulans». Эукариотическая клетка. 9 (7): 1039–1048. Дои:10.1128 / EC.00080-10. ISSN 1535-9778. ЧВК 2901662. PMID 20495057.
- ^ Веллен, Кэтрин Э .; Томпсон, Крейг Б. (01.04.2012). «Улица с двусторонним движением: взаимное регулирование метаболизма и передачи сигналов». Обзоры природы Молекулярная клеточная биология. 13 (4): 270–276. Дои:10.1038 / nrm3305. ISSN 1471-0072. PMID 22395772. S2CID 244613.
- ^ Стори, Кеннет Б. (25 февраля 2005 г.). Функциональный метаболизм: регуляция и адаптация. Джон Вили и сыновья. ISBN 9780471675570.
- ^ «Цитратлиаза ACLY АТФ [Homo sapiens (человек)] - Ген - NCBI». www.ncbi.nlm.nih.gov. Получено 2016-11-06.
- ^ Рэгсдейл, С. В. (2004). «Жизнь с угарным газом». Критические обзоры CRC в биохимии и молекулярной биологии. 39 (3): 165–195. Дои:10.1080/10409230490496577. PMID 15596550. S2CID 16194968.
- ^ Чаттерджа (1 января 2004 г.). Учебник биохимии для студентов стоматологов / медсестер / фармацевтов. Издательство Jaypee Brothers. ISBN 9788180612046.
- ^ Берг, Джереми М .; Тимочко, Джон Л .; Страйер, Люберт (2002). Биохимия (5-е изд.). В. Х. Фриман. ISBN 978-0716730514.
- ^ Блэксток, Джеймс К. (28 июня 2014 г.). Руководство по биохимии. Баттерворт-Хайнеманн. ISBN 9781483183671.
- ^ Хаутен, Сандер Мишель; Вандерс, Рональд Дж. А. (02.03.2010). «Общее введение в биохимию β-окисления митохондриальных жирных кислот». Журнал наследственных метаболических заболеваний. 33 (5): 469–477. Дои:10.1007 / s10545-010-9061-2. ISSN 0141-8955. ЧВК 2950079. PMID 20195903.
- ^ а б c d е ж грамм Страйер, Люберт (1995). Биохимия (Четвертое изд.). Нью-Йорк: W.H. Фримен и компания. С. 510–515, 559–565, 581–613, 614–623, 775–778. ISBN 978-0-7167-2009-6.
- ^ «Окисление жирных кислот». 2013-10-11.
- ^ «Кетоновый метаболизм в организме». Университет Ватерлоо.
- ^ а б Ferre, P .; Ф. Фуфель (2007). «Фактор транскрипции SREBP-1c и липидный гомеостаз: клиническая перспектива». Гормональные исследования. 68 (2): 72–82. Дои:10.1159/000100426. PMID 17344645.
этот процесс показан графически на странице 73
- ^ а б Воет, Дональд; Джудит Г. Воет; Шарлотта В. Пратт (2006). Основы биохимии, 2-е издание. John Wiley and Sons, Inc., стр.547, 556. ISBN 978-0-471-21495-3.
- ^ Фатланд, Б. Л. (2005). «Обратная генетическая характеристика образования цитозольного ацетил-КоА с помощью АТФ-цитрат-лиазы у Arabidopsis». Растительная клетка онлайн. 17 (1): 182–203. Дои:10.1105 / tpc.104.026211. ЧВК 544498. PMID 15608338.
- ^ Yi, C.H .; Vakifahmetoglu-Norberg, H .; Юань, Дж. (01.01.2011). «Интеграция апоптоза и метаболизма». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 76: 375–387. Дои:10.1101 / sqb.2011.76.010777. ISSN 0091-7451. PMID 22089928.
- ^ Pettit, Flora H .; Пелли, Джон В .; Рид, Лестер Дж. (1975-07-22). «Регулирование пируватдегидрогеназы киназы и фосфатазы с помощью соотношений ацетил-КоА / КоА и НАДН / НАД». Сообщения о биохимических и биофизических исследованиях. 65 (2): 575–582. Дои:10.1016 / S0006-291X (75) 80185-9. PMID 167775.
- ^ Джитрапакди, Саравут; Морис, Мартин-стрит; Реймент, Иван; Cleland, W. Wallace; Уоллес, Джон С .; Аттвуд, Пол В. (2008-08-01). «Структура, механизм и регуляция пируваткарбоксилазы». Биохимический журнал. 413 (3): 369–387. Дои:10.1042 / BJ20080709. ISSN 0264-6021. ЧВК 2859305. PMID 18613815.
внешняя ссылка
- Ацетил + Коэнзим + А в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
АТФ ADP АТФ ADP + + 2 ×  2 ×  2 × 3-фосфоглицерат 2 ×  2 × 2-фосфоглицерат 2 ×  2 × Фосфоенолпируват 2 ×  ADP АТФ 2 × Пируват 2 × |
| + ЧАС 2О | НАДН + Н+ НАД+ ЧАС2О FADH2 FAD КоА + АТФ (ГТФ) пя + ADP (ВВП) | ||
| НАДН + Н+ + CO 2 | |||
| CoA | НАД+ | ||


















