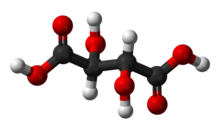
Винная кислота - Tartaric acid
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2,3-дигидроксибутандиовая кислота | |
| Другие имена Винная кислота 2,3-дигидроксисукциновая кислота Треариновая кислота Рацемическая кислота Увиновая кислота Паравинная кислота Винный камень | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.121.903 |
| КЕГГ | |
| MeSH | винная кислота + кислота |
PubChem CID | |
| |
| |
| Свойства | |
| C4ЧАС6О6 (Основная формула) HO2ССН (ОН) СН (ОН) СО2ЧАС (Структурная формула) | |
| Молярная масса | 150.087 г / моль |
| Внешность | белый порошок |
| Плотность | 1.79 г / мл (H2O) |
| Температура плавления | От 171 до 174 ° C (от 340 до 345 ° F; от 444 до 447 K) (L или Dвиннокаменный; чистый) 206 ° C (DL, рацемический) 165–166 ° C (мезо-безводный) 146–148 ° C (мезо-водный)[3] |
| |
| Кислотность (пKа) | L (+) 25 ° C: pKа1= 2,89, пКа2= 4.40 мезо 25 ° C: pKа1= 3,22, рКа2= 4.85 |
| Основание конъюгата | Битартрат |
| −67.5·10−6 см3/ моль | |
| Опасности | |
Классификация ЕС (DSD) (устарело) | Раздражающий (Си) |
| R-фразы (устарело) | R36 |
| Родственные соединения | |
Другой катионы | Тартрат натрия Тартрат динатрия Тартрат монокалия Тартрат дикалия |
Связанный карбоновые кислоты | Масляная кислота Янтарная кислота Димеркаптоянтарная кислота Яблочная кислота Малеиновая кислота Фумаровая кислота |
Родственные соединения | 2,3-бутандиол Цикориевая кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Винная кислота белый, кристаллический органическая кислота что естественным образом встречается во многих фруктах, особенно в виноград, но и в бананы, тамаринды, и цитрусовые.[4] это поваренная соль, битартрат калия, широко известный как соус тартар, естественно развивается в процессе ферментация. Обычно его смешивают с бикарбонат натрия и продается как порошок для выпечки используется как разрыхлитель в приготовлении пищи. Сама кислота добавляется в пищу в качестве антиоксидант E334 и придать ему характерный кисловатый вкус.
Винная кислота - это альфа-гидрокси-карбоновая кислота, является дипротический и алдарический по кислотным характеристикам и является дигидроксильным производным Янтарная кислота.
История
Известно, что винная кислота виноделы на века. Составлен письменный отчет о его извлечении из остатков виноделия. около 800 г. н.э., алхимик Джабир ибн Хайян.[5] Химический процесс экстракции был разработан в 1769 г. Шведский химик Карл Вильгельм Шееле.[6]
Винная кислота сыграла важную роль в открытии химическая хиральность. Это свойство винной кислоты было впервые обнаружено в 1832 г. Жан Батист Биот, который наблюдал за его способностью вращаться поляризованный свет.[7][8] Луи Пастер продолжил это исследование в 1847 году, исследуя формы кристаллов тартрата натрия-аммония, которые он обнаружил хиральными. Сортировав вручную кристаллы разной формы, Пастер первым произвел чистый образец левотаровой кислоты.[9][10][11][12][13]
Стереохимия

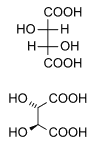
Встречающиеся в природе винная кислота хиральный, и является полезным сырьем в органический химический синтез. Встречающаяся в природе форма кислоты декстротаровая кислота или L- (+) - винная кислота (устаревшее название d -Винная кислота). Поскольку он доступен естественно, он немного дешевле, чем его энантиомер и мезо-изомер. В правый и лево префиксы - это архаичные термины.[14] В современных учебниках естественная форма именуется (2р,3р)-Винная кислота (L- (+) - винная кислота), а его энантиомер как (2S,3S)-Винная кислота (D-(-)-Винная кислота). В мезо диастереомер (2р,3S) винная кислота (идентичная «(2S,3р)-Винная кислота').
В то время как два хиральных стереоизомеры вращают плоско-поляризованный свет в противоположных направлениях, растворы мезо-винной кислоты не вращают плоско-поляризованный свет. Отсутствие оптической активности связано с зеркальной плоскостью в молекуле [сегментированная линия на рисунке ниже].[15][16]
Винная кислота в Решение Фелинга связывается с ионами меди (II), предотвращая образование нерастворимых гидроксидных солей.
| DL-Винная кислота (рацемическая кислота ) (при соотношении 1: 1) | мезотарная кислота | |
|---|---|---|
| декстротаровая кислота (L- (+) - винная кислота) | левотарная кислота (D- (-) - винная кислота) | |
 |  |  |
| Распространенное имя | Винная кислота | Левотарная кислота | Декстротарная кислота | Мезотарная кислота | Рацемическая кислота |
|---|---|---|---|---|---|
| Синонимы | (2S,3S)-Винная кислота (S,S)-Винная кислота (-) - винная кислота л-Винная кислота (устарело) левотарная кислота D-Винная кислота D-треариновая кислота ('неестественный изомер')[17] | (2р,3р)-Винная кислота (р,р)-Винная кислота (+) - винная кислота d-Винная кислота (устарело) L-Винная кислота L-треариновая кислота («Природный изомер»)[18] | (2р,3S)-Винная кислота мезо-Винная кислота эритрариновая кислота | гонка-(2р,3S)-Винная кислота (2RS,3SR)-Винная кислота (±) -винная кислота DL-Винная кислота дл-Винная кислота (устарело) паравинная кислота УФ-кислота | |
| PubChem | CID 875 от PubChem | CID 439655 от PubChem | CID 444305 от PubChem | CID 78956 от PubChem | CID 5851 от PubChem |
| Номер EINECS | |||||
| Количество CAS | 526-83-0 | 147-71-7 | 87-69-4 | 147-73-9 | 133-37-9 |
Производство
L- (+) - Винная кислота
В L- (+) - Изомер винной кислоты винной кислоты промышленно производится в наибольших количествах. Получается из осадок, твердый побочный продукт брожения. Первые побочные продукты в основном состоят из битартрата калия (KHC4ЧАС4О6). Эта калиевая соль превращается в тартрат кальция (CaC4ЧАС4О6) после обработки известковым молоком (Ca (OH)2):[19]
- KO2ССН (ОН) СН (ОН) СО2Н + Са (ОН)2 → Ca (O2ССН (ОН) СН (ОН) СО2) + КОН + Н2О
На практике более высокие выходы тартрата кальция достигаются при добавлении хлорид кальция. Затем тартрат кальция превращается в винную кислоту путем обработки соли водной серной кислотой:
- Ca (O2ССН (ОН) СН (ОН) СО2) + H2ТАК4 → HO2ССН (ОН) СН (ОН) СО2H + CaSO4
Рацемическая винная кислота
Рацемическая винная кислота (т.е..: смесь 50:50 D- (-) - винная кислота и L- (+) - молекулы винной кислоты, рацемическая кислота ) могут быть получены в результате многоступенчатой реакции из малеиновая кислота. На первом этапе малеиновая кислота эпоксидированный от пероксид водорода с помощью вольфрамат калия как катализатор.[19]
- HO2CC2ЧАС2CO2H + H2О2 → OC2ЧАС2(CO2ЧАС) 2
На следующем этапе эпоксид гидролизуют.
- OC2ЧАС2(CO2ЧАС)2 + H2O → (HOCH)2(CO2ЧАС)2
мезо-Винная кислота
мезо-Винная кислота образуется через термическая изомеризация. правый-Винную кислоту нагревают в воде до 165 ° C около 2 дней. мезо-Винную кислоту также можно получить из дибромянтарной кислоты с использованием гидроксида серебра:[20]
- HO2CCHBrCHBrCO2H + 2 AgOH → HO2ССН (ОН) СН (ОН) СО2H + 2 AgBr
мезо-Винная кислота может быть отделена от остаточной рацемической кислоты путем кристаллизации, причем рацемат менее растворим.
Реактивность
L - (+) - винная кислота, может участвовать в нескольких реакциях. Как показано на схеме реакции ниже, дигидроксималеиновая кислота образуется при обработке L - (+) - винной кислоты пероксидом водорода в присутствии соли двухвалентного железа.
- HO2ССН (ОН) СН (ОН) СО2H + H2О2 → HO2СС (ОН) С (ОН) СО2H + 2 H2О
Затем дигидроксималеиновая кислота может быть окислена до тартроновая кислота с азотной кислотой.[21]
Производные


Важные производные винной кислоты включают ее соли, зубной камень (битартрат калия ), Рошель соль (тартрат калия-натрия, мягкий слабительное ), и рвотный камень (сурьма тартрат калия).[22][23][24] Диизопропиловый тартрат используется как сокатализатор в асимметричном синтезе.
Винная кислота - это мышца токсин, который работает, подавляя производство яблочная кислота, а в больших дозах вызывает паралич и смерть.[25] В средняя смертельная доза (LD50) составляет около 7,5 г / кг для человека, 5,3 г / кг для кроликов и 4,4 г / кг для мышей.[26] Учитывая эту цифру, потребуется более 500 г (18 унций), чтобы убить человека весом 70 кг (150 фунтов), поэтому его можно безопасно включать во многие продукты, особенно кислые на вкус. сладости. Как пищевая добавка, винная кислота используется как антиоксидант с участием Номер E E334; тартраты другие добавки, служащие антиоксидантами или эмульгаторы.
При добавлении зубного камня в воду образуется суспензия, которая служит для очистки меди. монеты очень хорошо, так как раствор винной кислоты может растворить слой оксида меди (II), присутствующий на поверхности монеты. Образовавшийся комплекс тартрата меди (II) легко растворяется в воде.
Винная кислота в вине

Винная кислота может быть легко узнаваема любителями вина как источник «винных алмазов», малых битартрат калия кристаллы, которые иногда спонтанно образуются на пробка или дно бутылки. Эти «тартраты» безвредны, несмотря на то, что их иногда принимают за битое стекло, и во многих винах их предотвращают через холодная стабилизация (что не всегда является предпочтительным, поскольку оно может изменить профиль вина). Тартраты, оставшиеся внутри бочки для выдержки одно время были основным промышленным источником битартрата калия.
Винная кислота играет важную химическую роль, понижая pH ферментирующего «сусла» до уровня, при котором многие нежелательные бактерии порчи не могут жить, и действуя как консервант после ферментация. Винная кислота во рту придает вину некоторую терпкость, хотя лимонный и яблочная кислота тоже играют роль.
Винная кислота в цитрусовых
Результаты исследования показали, что в цитрусовых, фрукты, выращенные в органическом сельском хозяйстве, содержат более высокий уровень винной кислоты, чем фрукты, выращенные в традиционном сельском хозяйстве.[27]
В сверхпроводниках
Винная кислота, по-видимому, повышает критическую температуру в определенных сверхпроводники, предположительно повышая степень окисления, хотя механизм этого явления до сих пор точно не известен.[28]
Приложения
Винная кислота и ее производные находят множество применений в области фармацевтики. Например, его использовали в производстве шипучих солей в сочетании с лимонной кислотой для улучшения вкуса пероральных препаратов.[21] Антимонильное производное калия кислоты, известной как рвотный камень, входит в небольших дозах в сироп от кашля как отхаркивающее средство.
Винная кислота также имеет несколько применений в промышленности. Было замечено, что кислота хелат ионы металлов, такие как кальций и магний. Таким образом, кислота использовалась в сельском хозяйстве и металлургической промышленности в качестве хелатирующего агента для образования комплекса микроэлементов в почве. удобрение и для очистки металлических поверхностей, состоящих из алюминия, меди, железа и сплавов этих металлов соответственно.[19]
использованная литература
- ^ Винная кислота - Резюме соединений, PubChem.
- ^ Доусон, R.M.C. и другие., Данные для биохимических исследований, Oxford, Clarendon Press, 1959.
- ^ Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ^ Duarte, A.M .; Caixeirinho, D .; Miguel, M.G .; Sustelo, V .; Nunes, C .; Fernandes, M.M .; Маррейрос, А. (2012). «Концентрация органических кислот в соке цитрусовых при традиционном и органическом земледелии». Acta Horticulturae (933): 601–606. Дои:10.17660 / actahortic.2012.933.78. ISSN 0567-7572.
- ^ Лиза Сольери, Паоло Джудичи (2009). Уксусы мира. Springer. п. 29. ISBN 978-88-470-0865-6.
- ^ Ретциус, Андерс Джахан (1770) "Försök med vinsten och dess syra" (Эксперименты с винным камнем и его кислотой), Kungliga Vetenskapsakademiens Handlingar (Труды Королевской академии наук), 31 : 207–213. С п. 209: "§. 6. Dessa försök omtalte jag for Hr. Carl Wilhelm Scheele (en snabb och lårgirug Pharmaciæ Studiosus)…" (§ 6. Я упоминаю эти эксперименты от имени г-на Карла Вильгельма Шееле (быстрый и прилежный студент фармакологии)…)
- ^ Биот (1835) "Память о циркулирующей поляризации и о приложениях à la chimie organique" (Воспоминания о круговой поляризации и ее приложениях в органической химии), Mémoires de l'Académie des Sciences de l'Institut, 2-я серия, 13 : 39–175. Эта винная кислота (acide tartarique cristallisé) вращает плоско-поляризованный свет показано на Таблица G после стр. 168. (Примечание: эта статья была зачитана Французской Королевской академии наук 5 ноября 1832 г.)
- ^ Биот (1838) "Налейте отличительные меланжи и химические комбинации, определяющие или не определяющие, qui agissent sur la lumière polarisée; suivies d'applications aux combinaisons de l'acide tartarique avec l'eau, l'alcool et l'esprit de bois" (Для того, чтобы различать смеси и химические комбинации, определенные или неопределенные, которые действуют на поляризованный свет; с последующим применением к комбинациям винной кислоты с водой, спиртом [например, этанолом] и древесным спиртом [например, метанолом]), Mémoires de l'Académie des Sciences de l'Institut, 2-я серия, 15 : 93–279.
- ^ Л. Пастер (1848) «Воспоминание о связи, которая существует между кристаллической формой и химическим составом, и о причинах вращения поляризации» (Воспоминания о взаимосвязи, которая может существовать между кристаллической формой и химическим составом, а также о причина вращающейся поляризации), " Comptes rendus de l'Académie des Sciences (Париж), 26 : 535–538.
- ^ Л. Пастер (1848) "Sur les Relations qui peuvent exister entre la forme cristalline, la композиция chimique et le sens de la polarization rotatoire" (О связях, которые могут существовать между кристаллической формой и химическим составом, а также чувством вращательной поляризации), Annales de Chimie et de Physique, 3-я серия, 24 : 442–459.
- ^ Пастер, Луи (1850) "Recherches sur les propriétés spécifiques des deux acides qui composent l'acide racémique" (Исследования специфических свойств двух кислот, составляющих рацемическую кислоту), Annales de Chimie et de Physique, 3-я серия, 28 (3): 56–99. Смотрите также Пластина II. (См. Также отчет комиссии, назначенной для проверки выводов Пастера, стр. 99–117.) [На французском языке]
- ^ Джордж Б. Кауфман и Робин Д. Майерс (1998). «Пастеровское решение рацемической кислоты: полутолетняя ретроспектива и новый перевод» (PDF). Химический педагог. 3 (6): 1–4. Дои:10.1007 / s00897980257a. S2CID 95862598. Архивировано из оригинал (PDF) 17 января 2006 г.
- ^ Х. Д. Флэк (2009). «Открытие Луи Пастером молекулярной хиральности и спонтанного разрешения в 1848 году вместе с полным обзором его кристаллографических и химических работ» (PDF). Acta Crystallographica A. 65 (5): 371–389. Дои:10.1107 / S0108767309024088. PMID 19687573. Архивировано из оригинал (PDF) на 2012-09-06.
- ^ Лекция Дж. М. Макбрайда в Йеле по истории стереохимии винной кислоты, систем D / L и R / S
- ^ различные (2007-07-23). Органическая химия. Глобальные СМИ. п. 65. ISBN 978-81-89940-76-8. Получено 2010-06-05.
- ^ "(WO / 2008/022994) Использование производных азабициклогексана".
- ^ «Винная кислота_1».
- ^ «Винная кислота_2».
- ^ а б c Ж.-М. Кассаян «Винная кислота» в Энциклопедии промышленной химии Ульмана; VCH: Weinheim, Germany, 2002, 35, 671-678. Дои:10.1002 / 14356007.a26_163
- ^ Август Прайс Вест. Экспериментальная органическая химия. Всемирная книжная компания: Нью-Йорк, 1920, 232-237.
- ^ а б Blair, G.T .; ДеФратес, Дж. Дж. (2000). «Гидроксидикарбоновые кислоты». Энциклопедия химической технологии Кирка Отмера. С. 1–19. Дои:10.1002 / 0471238961.0825041802120109.a01. ISBN 0471238961.
- ^ Залкин, Аллан; Темплтон, Дэвид Х .; Уэки, Тацуо (1973). «Кристаллическая структура октагидрата l-трис (1,10-фенатролин) железа (II) бис (d-тартрат сурьмы (III))». Неорганическая химия. 12 (7): 1641–1646. Дои:10.1021 / ic50125a033.
- ^ Хак, я; Хан, С (1982). «Опасности традиционной косметики для глаз - СУРМА». JPMA. Журнал Пакистанской медицинской ассоциации. 32 (1): 7–8. PMID 6804665.
- ^ МакКаллум, Р.И. (1977). «Послание президента. Замечания по сурьме». Труды Королевского медицинского общества. 70 (11): 756–63. Дои:10.1177/003591577707001103. ЧВК 1543508. PMID 341167.
- ^ Альфред Суэйн Тейлор, Эдвард Хартшорн (1861). Медицинская юриспруденция. Бланшар и Ли. п.61.
- ^ Джозеф А. Мага, Энтони Т. Ту (1995). Токсикология пищевых добавок. CRC Press. С. 137–138. ISBN 0-8247-9245-9.
- ^ Duarte, A.M .; Caixeirinho, D .; Miguel, M.G .; Sustelo, V .; Nunes, C .; Fernandes, M.M .; Маррейрос, А. (2012). «Концентрация органических кислот в соке цитрусовых при традиционном и органическом земледелии». Acta Horticulturae (933): 601–606. Дои:10.17660 / actahortic.2012.933.78. ISSN 0567-7572.
- ^ arXiv, Новые технологии из. «Красное вино, винная кислота и секрет сверхпроводимости». Обзор технологий MIT. Получено 2020-01-09.
