Молибдат натрия - Википедия - Sodium molybdate
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Молибдат натрия | |
| Другие имена Динатрий молибдат | |
| Идентификаторы | |
| |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.028.683 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII |
|
| |
| |
| Характеристики | |
| Na2МоО4 | |
| Молярная масса | 205,92 г / моль (безводный) 241,95 г / моль (дигидрат) |
| Внешность | белый порошок |
| Плотность | 3,78 г / см3, твердый |
| Температура плавления | 687 ° С (1269 ° F, 960 К) |
| 84 г / 100 мл (100 ° C) | |
| 1.714 | |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 4000 мг / кг (крыса, перорально)[1] |
LC50 (средняя концентрация ) | > 2080 мг / м3 (крыса, 4 часа)[1] |
| Родственные соединения | |
Другой анионы | Хромат натрия Вольфрамат натрия |
Другой катионы | Молибдат аммония |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
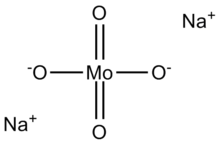
Молибдат натрия, Na2МоО4, полезен как источник молибден.[2] Часто встречается в виде дигидрата Na2МоО4· 2H2О.
Анион молибдата (VI) тетраэдрический. Два катиона натрия координируются с каждым анионом.[3]
История
Молибдат натрия впервые был синтезирован методом гидратации.[4] Более удобный синтез осуществляется путем растворения МоО3 в едкий натр при 50–70 ° C и кристаллизации отфильтрованного продукта.[3] Безводную соль получают нагреванием до 100 ° C.
- МоО3 + 2NaOH + H2O → Na2МоО4· 2H2О
Использует
В сельском хозяйстве используется 1 миллион фунтов стерлингов в год в качестве удобрений. В частности, его использование было предложено для лечения хлыст в брокколи и цветная капуста в почвах с дефицитом молибдена.[5][6] Однако следует проявлять осторожность, поскольку при уровне 0,3 промилле молибдата натрия может возникнуть дефицит меди у животных, особенно крупного рогатого скота.[3]
Он используется в промышленности для ингибирования коррозии, поскольку является неокисляющим анодным ингибитором.[3] Добавление молибдата натрия значительно снижает потребность в нитритах в жидкостях, ингибированных нитритамином, и улучшает защиту от коррозии жидкостей на основе карбоксилатных солей.[7]
В промышленных системах очистки воды, где возможна гальваническая коррозия из-за биметаллической конструкции, применение молибдата натрия предпочтительнее, чем нитрита натрия. Молибдат натрия имеет преимущество в том, что дозирование более низких частей на миллион молибдата позволяет снизить проводимость циркулирующей воды. Молибдат натрия на уровне 50-100 частей на миллион обеспечивает такие же уровни ингибирования коррозии, что и нитрит натрия при уровнях 800+ частей на миллион. За счет использования более низких концентраций молибдата натрия проводимость сохраняется на минимальном уровне и, таким образом, снижаются потенциалы гальванической коррозии.[8]
Реакции
Когда реагировал с борогидрид натрия, молибден восстанавливается до более низкой валентности оксид молибдена (IV):[9]
- Na2МоО4 + NaBH4 + 2H2O → NaBO2 + MoO2 + 2NaOH + 3H2
Молибдат натрия реагирует с кислотами дитиофосфатов:[3]
- Na2МоО4 + → [MoO2(S2P (ИЛИ)2)2]
который в дальнейшем реагирует с образованием [MoO3(S2P (ИЛИ)2)4].
Безопасность
Молибдат натрия несовместим с щелочными металлами, наиболее распространенными металлами и окислителями. Он взорвется при контакте с расплавленным магнием. Он будет бурно реагировать с интергалогены (например., пентафторид брома; трифторид хлора ). Его реакция с горячим натрием, калием или литием раскалена.[10]
Рекомендации
- ^ а б «Молибден (растворимые соединения, как Мо)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press. ISBN 978-0-08-022057-4.
- ^ а б c d е Braithwaite, E.R .; Габер, Дж. Молибден: очерк его химии и использования. 1994. Elsevier Science B.V. Амстердам, Нидерланды.
- ^ Спицын, Викт. Я.; Кулешов, И.М. Журнал Общей химии 1951. 21. 1701-15.
- ^ Плант, W. (1950). «Использование извести и молибдата натрия для борьбы с« хлыстохвостом »в брокколи». Природа. 165 (4196): 533. Bibcode:1950Натура.165..533P. Дои:10.1038 / 165533b0.
- ^ Дэвис, Э. Б. (1945). «Случай дефицита молибдена в Новой Зеландии». Природа. 156 (3961): 392. Bibcode:1945Натура.156..392D. Дои:10.1038 / 156392b0.
- ^ Вукасович, Марк С. Смазочная инженерия 1980. 36(12). 708-12.
- ^ М. Хаузер, Corrosion Control Services, Inc., Вводное руководство
- ^ Цанг, Чи Фо; Мантирам, Арумугам (1997). «Синтез низковалентных оксидов молибдена в водных растворах восстановлением Na2МоО4 с NaBH4". Журнал химии материалов. 7 (6): 1003–1006. Дои:10.1039 / A606389F. ISSN 1364-5501.
- ^ http://www.mallbaker.com/americas/msds/english/s4394_msds_us_default.pdf[постоянная мертвая ссылка ]

