Метаборат натрия - Sodium metaborate
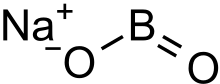 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ECHA InfoCard | 100.028.992 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| |
| |
| Характеристики | |
| NaBO2 | |
| Молярная масса | 65,80 г / моль |
| Внешность | бесцветные кристаллы |
| Запах | без запаха |
| Плотность | 2,464 г / мл (безводный)[1] |
| Температура плавления | 966 ° С (1771 ° F, 1239 К) |
| Точка кипения | 1,434[2] ° С (2613 ° F, 1707 К) |
| 16,4 г / 100 мл (0 ° С) 28,2 г / 100 мл (25 ° С) 125,2 г / 100 мл (100 ° С) | |
| Растворимость | не растворим в эфир, этиловый спирт |
| Структура | |
| тригональный | |
| Термохимия | |
Теплоемкость (C) | 65,94 Дж / моль К |
Стандартный моляр энтропия (S | 73,39 Дж / моль К |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1059 кДж / моль |
| Опасности | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 2330 мг / кг (крыса, перорально) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Метаборат натрия бесцветное твердое вещество химическое соединение из натрий, бор, и кислород с участием формула NaBO
2.[3] Формулу можно также записать как Na
2О·B
2О
3 выделить отношение к главному оксиды натрия и бора.[2]
Структура
Твердый безводный метаборат натрия кристаллизуется в гексагональной форме. космическая группа. На самом деле он содержит тримерный анион. [B
3О
6]3−
.[1] Шесть кислород атомы равномерно разделены на две отдельные структурные позиции с разными B – O длина облигаций (около 128 и 143 вечера, соответственно).[4]
Гидраты и растворимость
Следующее гидраты кристаллизуются из растворов подходящего состава в различных диапазонах температур:[5]
- тетрагидрат NaBO
2·4ЧАС
2О от −6 до 53,6 ° С - дигидрат NaBO
2·2ЧАС
2О от 53,6 ° C до 105 ° C - полугидрат NaBO
2·0.5ЧАС
2О от 105 ° С до точки кипения.
Ранние сообщения о моногидрате NaBO
2·ЧАС
2О не подтверждены.[5]
Безводную соль можно получить из тетрабората путем нагревания до 270 ° C в вакууме.[6]
Подготовка
Метаборат натрия получают путем плавления карбонат натрия и оксид бора B
2О
3[1] или бура Na
2B
4О
7. Другой способ создать соединение - это слияние бура с участием едкий натр при 700 ° C:
- B
2О
3 + 2 NaOH → 2 NaBO
2 + 2 ЧАС
2О
Температура кипения метабората натрия (1434 ° C) ниже, чем у оксида бора (1860 ° C) и буры (1575 ° C). Фактически, в то время как метаборат кипит без изменения состава, бура выделяет пары метабората натрия. с небольшим избытком оксида натрия Na
2О.[2]
Реакции
Электрохимическое преобразование в буру
Электролиз концентрированного раствора 20% NaBO
2·4ЧАС
2О с анионообменная мембрана и инертный анод (например, золото, палладий, или алмаз, легированный бором ) превращает метаборатный анион в тетраборат B
4О2−
7, а натриевая соль более позднего (бура ) выпадает в виде белого порошка.[7]
- BO2−
2 + 2HO−
→ B
4О2−
7 + ЧАС
2О + 4 е−
Восстановление до боргидрида натрия
Метаборат натрия также является побочным продуктом гидролиза борогидрид натрия NaBH
4, предлагаемый водород материал для хранения автомобили на водородном топливе это более безопасно (стабильно в сухом воздухе) и более эффективно по весу, чем большинство других альтернатив.[7][8] Реакция
- NaBH
4 + 2 ЧАС
2О → NaBO
2 + 4 ЧАС
2
и требует катализатор.
Чтобы быть экономичным, этот подход потребует дешевого и эффективного способа рециркуляции метабората в боргидрид. Было изучено несколько методов, например, реакция с различными сокращение агенты при высоких температурах и давлении,[7] или с гидрид магния MgH
2 от шаровая мельница при комнатной температуре с последующей экстракцией NaBH
4 с участием изопропиламин.[8][6]
- NaBO
2 + 2 MgH
2 → NaBH
4 + 2 MgO
Другой альтернативой, которая была рассмотрена, является электролитическое восстановление концентрированного раствора метабората натрия,[6] а именно
- BO2−
2 + 6 ЧАС
2О + 8 e− → BH−
4 + 8 HO−
Однако этот метод неэффективен, поскольку он конкурирует с уменьшением гидроксид, 4 HO−
→ 2 ЧАС
2О + О
2 + 4 е−
Превращение в алкоксиды натрия
Безводный метаборат натрия рефлюкс с участием метанол дает соответствующий натрий метоксиборат:[9]
- Na+
[BO
2]−
+ 4 CH
3ОЙ → Na+
[B (OCH
3)
4]−
+ 2 ЧАС
2О
Аналогичная реакция с этиловый спирт дает этоксиборат.[9]
Использует
Метаборат натрия используется в производстве боросиликатные стекла. Это также компонент гербициды и антифриз товары.
Смотрите также
использованная литература
- ^ а б c Ssu-Mien Fang (1938): "Кристаллическая структура метабората натрия. Na
3(B
3О
6)". Zeitschrift für Kristallographie - Кристаллические материалы, том 99, выпуск 1-6, страницы 1–8, Дои:10.1524 / zkri.1938.99.1.1 - ^ а б c Сэндфорд С. Коул и Нельсон В. Тейлор, "Система Na
2О-B
2О
3, IV: Давление паров оксида бора, метабората натрия и дибората натрия между 1150 ° C и 1400 ° C ». Журнал Американского керамического общества, том 18, выпуск 1-12, страницы 82-85 Дои:10.1111 / j.1151-2916.1935.tb19358.x - ^ Метаборат натрия в Chemister
- ^ М. Марезио, Х. А. Плеттингер и В. Х. Захариасен (1963): «Длины связей в структуре метабората натрия», Acta Crystallographica, том 16, страницы 594-595. Дои:10.1107 / S0365110X63001596
- ^ а б Нельсон П. Найс и Ричард В. Халберт (1967): «Изотермы растворимости в системе оксид натрия-оксид бора-вода. Пересмотренные кривые растворимости-температуры борной кислоты, буры, пентабората натрия и метабората натрия». Журнал химических и технических данных, том 12, выпуск 3, страницы 303-313. Дои:10.1021 / je60034a005
- ^ а б c Линьян Конг, Синью Цуй, Хуази Цзинь, Цзе Ву, Хао Ду и Тяньин Сюн (2009): «Механохимический синтез боргидрида натрия путем рециркуляции метабората натрия». Энергетическое топливо, том 23, выпуск 10, страницы 5049-5054. Дои:10.1021 / ef900619y
- ^ а б c Ын Хи Пак, Сон Ук Чжон, Ун Хо Чжон, Сон Хён Ким, Джеён Ли, Сок У Нам, Тэ Хун Лим, Пак Ён Джун, Ён Хо Юк (2007): «Переработка метабората натрия до буры». Международный журнал водородной энергетики, том 32, выпуск 14, страницы 2982-2987. Дои:10.1016 / j.ijhydene.2007.03.029
- ^ а б З. П. Ли, Б. Х. Лю. К. Араи, Н. Моригазаки, С. Суда (2003): "Протидные соединения в системах хранения водорода". Журнал сплавов и соединений, тома 356–357, страницы 469–474. Дои:10.1016 / S0925-8388 (02) 01241-0
- ^ а б Т. Кеммит и Г. Дж. Гейнсфорд (2009): «Регенерация боргидрида натрия из метабората натрия и выделение промежуточных соединений» Международный журнал водородной энергетики, том 34, выпуск 14, страницы 5726-5731. Дои:10.1016 / j.ijhydene.2009.05.108
| Эта неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |

