Пентафторид брома - Bromine pentafluoride
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Пентафторид брома | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.234 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1745 | ||
| |||
| |||
| Свойства | |||
| BrF5 | |||
| Молярная масса | 174,894 г / моль−1 | ||
| Внешность | Бледно-желтая жидкость | ||
| Плотность | 2,466 г / см3 | ||
| Температура плавления | -61,30 ° С (-78,34 ° F, 211,85 К) | ||
| Точка кипения | 40,25 ° С (104,45 ° F, 313,40 К) | ||
| Реагирует с водой | |||
| Структура | |||
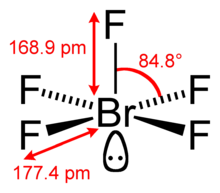
| Квадрат пирамидальный | |||
| Опасности | |||
| Основной опасности | Реагирует бурно с водой, мощный окислитель[1] | ||
| Паспорт безопасности | Увидеть: страница данных Внешний паспорт безопасности материалов | ||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H271, H305, H314, H318, H330, H370, H371, H373 | |||
| P210, P220, P221, P260, P264, P270, P271, P280, P283, P284, P301 + 310, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P306 + 360, P307 + 311, P309 + 311, P310, P314, P320, P321, P331, P363, P370 + 378 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Не воспламеняется | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | никто[1] | ||
REL (Рекомендуемые) | TWA 0,1 частей на миллион (0,7 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | N.D.[1] | ||
| Родственные соединения | |||
Другой анионы | Монохлорид брома | ||
Другой катионы | Пентафторид хлора Пентафторид йода | ||
Связанный соединения | Монофторид брома Трифторид брома | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Пентафторид брома, BrF5, является межгалогенное соединение и фторид из бром. Это сильный фторирование реагент.
BrF5 находит применение в кислород изотопный анализ. Лазерная абляция твердых силикаты при наличии выбросов пентафторида брома О2 для последующего анализа.[2] Он также был протестирован как окислитель в жидкости ракетное топливо и используется как фторирующий агент в обработке уран.
Подготовка
Пентафторид брома был впервые получен в 1931 году путем прямой реакции брома с фтором.[3] Эта реакция подходит для приготовления больших количеств и проводится при температуре выше 150 ° C (302 ° F) с избытком фтора:
- Br2 + 5 Ж2 → 2 руб.5
Для приготовления меньшего количества, бромид калия используется:[3]
- KBr + 3 F2 → КФ + БрФ5
Этот путь дает пентафторид брома почти полностью свободный от трифторидов и других примесей.[3]
Реакции
Пентафторид брома бурно реагирует с водой, но с образованием бромная кислота и плавиковая кислота (особенно при умеренном разбавлении ацетонитрил ), простые продукты гидролиза:[4]
- BrF5 + 3 часа2O → HBrO3 + 5 ВЧ
Это чрезвычайно эффективный фторирующий агент, способный превращать большинство соединений урана в гексафторид урана при комнатной температуре.
Опасности
Пентафторид брома оказывает сильное разъедающее действие на кожу, а его пары раздражают глаза, кожу и слизистые оболочки. Во влажном воздухе он действительно выделяет «дым», содержащий плавиковая кислота пары, образующиеся в результате реакции с водой в воздухе. Кроме того, воздействие 100 ppm или более в течение более одной минуты смертельно для большинства экспериментальных животных. Хроническое воздействие может вызвать повреждение почек и печеночная недостаточность.[5]
Он может самопроизвольно воспламениться или взорваться при контакте с органическими материалами или металлической пылью.[5]
использованная литература
- ^ а б c d Карманный справочник NIOSH по химической опасности. "#0065". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Clayton, R .; Майеда, Т. К. (1963). «Использование пентафторида брома при извлечении кислорода из оксидов и силикатов для изотопного анализа». Geochimica et Cosmochimica Acta. 27 (1): 43–48. Bibcode:1963GeCoA..27 ... 43C. Дои:10.1016/0016-7037(63)90071-1.
- ^ а б c Hyde, G.A .; Будакян, М. М. (1968). «Пути синтеза пентафторидов хлора и брома». Неорганическая химия. 7 (12): 2648–2649. Дои:10.1021 / ic50070a039.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 834. ISBN 978-0-08-037941-8.
- ^ а б Патнаик, Прадёт (2007). Подробное руководство по опасным свойствам химических веществ (3-е изд.). Wiley-Interscience. п. 480. ISBN 0-471-71458-5.
внешние ссылки
- Веб-страница для BrF5
- Международная карта химической безопасности 0974
- Карманный справочник NIOSH по химической опасности. "#0065". Национальный институт охраны труда и здоровья (NIOSH).
- Национальный реестр загрязнителей - информационный бюллетень по фторидам и соединениям