Фторуглерод - Википедия - Fluorocarbon

Фторуглероды, иногда называемый перфторуглероды или же ПФУ, находятся фторорганический соединения с формулой CИксFу, т.е. они содержат только углерод и фтор.[1] Терминология не соблюдается строго, и многие фторсодержащие органические соединения называются фторуглеродами.[2]Соединения с префиксом перфтор- представляют собой углеводороды, в том числе с гетероатомами, в которых все связи C-H заменены связями C-F.[3]Фторуглероды включают перфторалканы, фторалкены, фторалкины и перфторароматические соединения. Фторуглероды и их производные (перфторированные соединения ) используются как фторполимеры, хладагенты, растворители, и анестетики.
Перфторалканы
Химические свойства
Перфторалканы очень стабильны из-за силы связь углерод-фтор, один из сильнейших в органической химии.[4]Его сила является результатом электроотрицательности фтора, придающей частичный ионный характер через частичные сборы на атомах углерода и фтора, которые укорачивают и укрепляют связь за счет благоприятных ковалентный взаимодействия. Кроме того, множественные связи углерод-фтор увеличивают прочность и стабильность других близлежащих связей углерод-фтор на том же участке. близнец углерод, так как углерод имеет более высокий положительный частичный заряд.[2] Более того, множественные связи углерод-фтор также укрепляют «скелетные» связи углерод-углерод из индуктивный эффект.[2] Следовательно, насыщенный фторуглероды более химически и термически стабильны, чем их соответствующие углеводородные аналоги, да и любое другое органическое соединение. Они подвержены воздействию очень сильных восстановителей, например Сокращение березы и очень специализированные металлоорганические комплексы.[5]
Фторуглероды бесцветны и имеют высокую плотность, вдвое превышающую плотность воды. Они не смешиваются с большинством органических растворителей (например, этанолом, ацетоном, этилацетатом и хлороформом), но могут смешиваться с некоторыми углеводородами (например, в некоторых случаях с гексаном). Они имеют очень низкую растворимость в воде, и вода имеет очень низкую растворимость в них (порядка 10 ppm). У них низкий показатели преломления.
Как высокий электроотрицательность фтора снижает поляризуемость атома,[2] фторуглероды лишь слабо восприимчивы к мимолетным диполям, которые составляют основу Лондонская дисперсионная сила. В результате фторуглероды имеют низкие силы межмолекулярного притяжения и липофобный в дополнение к тому, чтобы быть гидрофобный и неполярный. Отражая слабых межмолекулярные силы эти соединения показывают низкие вязкости по сравнению с жидкостями аналогичного точки кипения, низкий поверхностное натяжение и низкий теплота испарения. Низкий силы притяжения во фторуглеродных жидкостях делают их сжимаемый (низкий объемный модуль ) и относительно хорошо растворяет газ. Фторуглероды меньшего размера чрезвычайно летучий.[2] Есть пять газов перфторалкана: тетрафторметан (т.кип. −128 ° C), гексафторэтан (т.кип. -78,2 ° C), октафторпропан (т.кип. -36,5 ° C), перфтор-н-бутан (точка кипения -2,2 ° C) и перфторизобутан (точка кипения -1 ° C). Почти все другие фторалканы - жидкости; наиболее заметным исключением является перфторциклогексан, который возвышенный при 51 ° С.[6] Фторуглероды также имеют низкую поверхностные энергии и высокий диэлектрик сильные стороны.[2]
- Перфторалканы
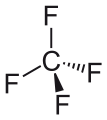
Тетрафторид углерода, простейший перфторалкан

Перфтороктан, линейный перфторалкан
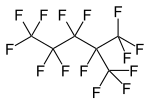
Перфтор-2-метилпентан, разветвленный перфторалкан
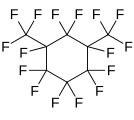
Перфтор-1,3-диметилциклогексан, циклический перфторалкан
Перфтордекалин, полициклический перфторалкан
Воспламеняемость
В 1960-е годы фторуглероды как анестетики вызывали большой интерес. Исследование не дало никаких анестетиков, но исследование включало тесты на воспламеняемость и показало, что протестированные фторуглероды не горючи в воздухе ни в какой пропорции, хотя большинство тестов проводились в чистом виде. кислород или чистый оксид азота (газы, важные в анестезиологии).[7][8]
| Сложный | Условия испытаний | Результат |
|---|---|---|
| Гексафторэтан | Нижний предел воспламеняемости в кислороде | Никто |
| Перфторпентан | точка возгорания в воздухе | Никто |
| Температура вспышки в кислороде | −6 ° С | |
| Температура вспышки закиси азота | −32 ° С | |
| Перфторметилциклогексан | Нижний предел воспламеняемости в воздухе | Никто |
| Нижний предел воспламеняемости в кислороде | 8.3% | |
| Нижний предел воспламеняемости в кислороде (50 ° C) | 7.4% | |
| Нижний предел воспламеняемости закиси азота | 7.7% | |
| Перфтор-1,3-диметилциклогексан | Нижний предел воспламеняемости в кислороде (50 ° C) | 5.2% |
| Перфторметилдекалин | Тест самовозгорания в кислороде при 127 бар | Нет воспламенения при 500 ° C |
| Самовозгорание при адиабатическом ударе волна в кислороде от 0,98 до 186 бар | Нет зажигания | |
| Самовозгорание при адиабатическом ударе волна в кислороде от 0,98 до 196 бар | Зажигание |
В 1993 году 3М рассматривала фторуглероды в качестве огнетушащих средств, заменяющих ХФУ.[9] Этот эффект тушения объясняется их высоким теплоемкость, отводящий тепло от огня. Было высказано предположение, что атмосфера, содержащая значительный процент перфторуглеродов на космической станции или подобном, может полностью предотвратить пожары.[10][11]Когда происходит возгорание, образуются токсичные пары, в том числе карбонилфторид, монооксид углерода, и фтороводород.
Свойства растворения газов
Перфторуглероды растворяют относительно большие объемы газов. Высокая растворимость газов объясняется слабыми межмолекулярными взаимодействиями в этих фторуглеродных жидкостях.[12]
В таблице приведены значения мольной доли x1растворенного азота, рассчитанного из Коэффициент распределения кровь – газ, при 298,15 К (25 ° C), 0,101325 МПа.[13]
| Жидкость | 104 Икс1 | Концентрация, мМ |
|---|---|---|
| Вода | 0.118 | 0.65 |
| Этиловый спирт | 3.57 | 6.12 |
| Ацетон | 5.42 | 7.32 |
| Тетрагидрофуран | 5.21 | 6.42 |
| Циклогексан | 7.73 | 7.16 |
| Перфторметилциклогексан | 33.1 | 16.9 |
| Перфтор-1,3-диметилциклогексан | 31.9 | 14.6 |
Производство
Развитие фторуглеродной промышленности совпало с Вторая Мировая Война.[14] До этого фторуглероды получали реакцией фтора с углеводородом, т.е. прямым фторированием. Поскольку связи C-C легко расщепляются фтором, прямое фторирование в основном дает более мелкие перфторуглероды, такие как тетрафторметан, гексафторэтан и октафторпропан.[15]
Процесс Фаулера
Важным прорывом, позволившим крупномасштабное производство фторуглеродов, стало Процесс Фаулера. В этом процессе трифторид кобальта используется как источник фтора. Показательным является синтез перфторгексан:
- C6ЧАС14 + 28 CoF3 → С6F14 + 14 ВЧ + 28 CoF2
Полученный дифторид кобальта затем регенерируют, иногда в отдельном реакторе:
- 2 CoF2 + F2 → 2 CoF3
В промышленном отношении обе стадии объединяются, например, при производстве фторуглеродов Flutec компанией F2 Chemical Ltd с использованием реактора с вертикальным перемешиваемым слоем, углеводород вводится снизу, а фтор вводится на полпути вверх по реактору. Пары фторуглерода собираются сверху.
Электрохимическое фторирование
Электрохимическое фторирование (ECF) (также известный как процесс Саймонса) включает электролиз субстрата, растворенного в фтороводород. Поскольку фтор сам производится электролизом фтористого водорода, ECF представляет собой более прямой путь к фторуглеродам. Процесс происходит при низком напряжении (5-6 В), поэтому свободный фтор не выделяется. Выбор субстрата ограничен, поскольку в идеале он должен быть растворим во фтористом водороде. Обычно используются простые эфиры и третичные амины. Для получения перфторгексана используют тригексиламин, например:
- N (C6ЧАС13)3 + 45 ВЧ → 3 С6F14 + NF3 + 42 часов2
Перфторированный амин также будет производиться:
- N (C6ЧАС13)3 + 39 HF → N (С6F13)3 + 39H2
Проблемы окружающей среды и здоровья
Фторалканы обычно инертны и нетоксичны.[16][17][18]
Фторалканы не являются разрушение озона, так как они не содержат атомов хлора или брома и иногда используются в качестве замены химикатов, разрушающих озоновый слой.[19]Термин «фторуглерод» используется довольно свободно для включения любого химического вещества, содержащего фтор и углерод, включая хлорфторуглероды, которые разрушают озоновый слой. Фторалканы иногда путают с фторсодержащие ПАВ, которые значительно биоаккумулируются.[нужна цитата ]
Перфторалканы не биоаккумулируются;[нужна цитата ] те, которые используются в медицинских процедурах, быстро выводятся из организма, в первую очередь через выдох, причем скорость выведения зависит от давления пара; период полураспада для октафторпропан менее 2 минут,[20] по сравнению с примерно неделей для перфтордекалина.[21]

Низкокипящие перфторалканы обладают сильным действием парниковые газы, отчасти из-за их очень длительного срока службы в атмосфере, и их использование покрывается Киотский протокол.[нужна цитата ][22] В потенциал глобального потепления (по сравнению с двуокисью углерода) многих газов можно найти в 5-м оценочном отчете МГЭИК,[23] с экстрактом ниже для нескольких перфторалканов.
| Имя | Химическая формула | Срок службы (г) | GWP (100 лет) |
|---|---|---|---|
| ПФУ-14 | CF4 | 50000 | 6630 |
| PFC-116 | C2F6 | 10000 | 11100 |
| PFC-c216 | c-C3F6 | 3000 | 9200 |
| PFC-218 | C3F6 | 2600 | 8900 |
| PFC-318 | c-C4F8 | 3200 | 9540 |
Алюминиевая промышленность является основным источником атмосферных перфторуглеродов (тетрафторметан и гексафторэтан особенно), полученный как побочный продукт процесса электролиза.[24] Однако в последние годы промышленность активно участвовала в сокращении выбросов.[25]
Приложения
Поскольку они инертны, перфторалканы практически не имеют химического применения, но их физические свойства привели к их использованию во многих разнообразных областях. К ним относятся:
- Перфторуглеродный индикатор
- Жидкий диэлектрик
- Химическое осаждение из паровой фазы
- Органический цикл Ренкина
- Фтористый двухфазный катализ [26]
- Косметика
А также несколько медицинских применений:
- Жидкое дыхание
- Заменитель крови
- Ультразвук с контрастным усилением
- Глазная хирургия [27]
- Удаление татуировок [28]
Фторалкены и фторалкины
Ненасыщенный фторуглероды гораздо более активны, чем фторалканы. Несмотря на то что дифторацетилен нестабилен (что типично для родственных алкинов, см. дихлорацетилен ),[2] гексафтор-2-бутин и родственные фторированные алкины хорошо известны.
- Ненасыщенные фторуглероды

Перфторизобутен, химически активный и высокотоксичный фторалкеновый газ
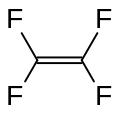
Тетрафторэтилен, важный перфторированный мономер.
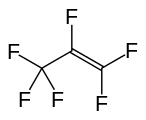
Гексафторпропилен, еще один важный перфторалкен.

Гексафтор-2-бутин, перфторалкин.
Полимеризация
Фторалкены полимеризуются более экзотермически, чем нормальные алкены.[2] Ненасыщенные фторуглероды имеют движущую силу к sp.3 гибридизация из-за того, что электроотрицательные атомы фтора ищут большую долю связывающих электронов с пониженным s-характером на орбиталях.[2] Самый известный представитель этого класса - тетрафторэтилен, который используется для изготовления политетрафторэтилен (PTFE), более известный под торговым наименованием Тефлон.
Проблемы окружающей среды и здоровья
Фторалкены и фторированные алкины реакционноспособны, и многие из них, например, токсичны. перфторизобутен.[нужна цитата ] Фторалкены не являются разрушение озона, так как они не содержат атомов хлора или брома. Они слишком реактивны, чтобы быть парниковыми газами.[нужна цитата ]Производить политетрафторэтилен разные фторированные поверхностно-активные вещества используются в процессе, известном как Эмульсионная полимеризация, и поверхностно-активное вещество, включенное в полимер, может биоаккумулироваться.
Перфторароматические соединения
Перфторароматические соединения, как и другие фторуглероды, содержат только углерод и фтор, но также содержат ароматическое кольцо. Три наиболее важных примера: гексафторбензол, октафтортолуол и октафторнафталин.
- Перфторароматические соединения
Перфторароматические соединения могут быть получены с помощью процесса Фаулера, как и фторалканы, но условия должны быть скорректированы, чтобы предотвратить полное фторирование. Их также можно получить путем нагревания соответствующего перхлороароматического соединения с фторидом калия при высокой температуре (обычно 500 ° C), во время которой атомы хлора заменяются атомами фтора. Третий путь - дефторирование фторалкана; например, октафтортолуол можно получить из перфторметилциклогексан нагреванием до 500 ° C с никелевым или железным катализатором.[29]
Перфторароматические соединения относительно летучие по своей молекулярной массе, с температурами плавления и кипения, аналогичными соответствующим ароматическим соединениям, как показано в таблице ниже. Они имеют высокую плотность и негорючие. По большей части это прозрачные бесцветные жидкости (исключение составляет октафторнафталин, твердое вещество желтого цвета). В отличие от перфторалканов они, как правило, смешивающийся с обычными растворителями.[нужна цитата ]
| Сложный | Точка плавления (° C) | Точка кипения (° C) |
|---|---|---|
| Гексафторбензол | 5.3 | 80.5 |
| Бензол | 5.5 | 80.1 |
| Октафтортолуол | <−70 | 102–103 |
| Толуол | −95 | 110.6 |
| Перфтор (этилбензол) | 114–115 | |
| Этилбензол | −93.9 | 136.2 |
| Октафторнафталин | 86–87 | 209[30] |
| Нафталин | 80.2 | 217.9 |
Смотрите также
- Категория: Фторуглероды
- Фторохимическая промышленность
- Фторографен
- Перфторциклоалкен (PFCA)
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "фторуглероды ". Дои:10.1351 / goldbook.F02459
- ^ а б c d е ж грамм час я Lemal DM (январь 2004 г.). «Перспективы химии фторуглеродов». J. Org. Chem. 69 (1): 1–11. Дои:10.1021 / jo0302556. PMID 14703372.
- ^ Мерфи WJ (март 1947 г.). «Номенклатура фтора ... Заявление редакции». Ind. Eng. Chem. 39 (3): 241–242. Дои:10.1021 / ie50447a004.
- ^ О'Хаган Д. (февраль 2008 г.). «Понимание фторорганической химии. Введение в связь C – F». Chem. Soc. Rev. 37 (2): 308–19. Дои:10.1039 / b711844a. PMID 18197347.
- ^ Киплингер Дж. Л., Ричмонд Т. Г., Остерберг CE (1994). «Активация углеродно-фторных связей металлическими комплексами». Chem. Rev. 94 (2): 373–431. Дои:10.1021 / cr00026a005.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2008-12-05. Получено 2008-11-29.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Ларсен Э. Р. (1969). «Соединения фтора в анестезиологии: В.И. Горючесть». Fluorine Chem. Rev. 3: 22–27.
- ^ Flutec (Технический отчет). ISC Chemicals Limited. 1982 г.
- ^ Джон А. Пиньято младший; Пол Э. Риверс; Майрон Т. Пайк. «Разработка перфторуглеродов в качестве чистых средств пожаротушения» (PDF). Национальный институт стандартов и технологий. Архивировано из оригинал (PDF) на 2014-05-21. Получено 2019-01-03.
- ^ Макхейл ET (1974). «Жизнеобеспечение без опасности возгорания». Пожарная техника. 10 (1): 15–24. Дои:10.1007 / bf02590509.
- ^ Хаггетт C (1973). «Жилая атмосфера, не поддерживающая горение». Горение и пламя. 20: 140–142. Дои:10.1016 / с0010-2180 (73) 81268-4.
- ^ «Растворение газов в жидкостях FLUTEC ™» (PDF). F2 Chemicals Ltd. 10 мая 2005 г.
- ^ Баттино Р., Реттич Т.Р., Томинага Т. (1984). «Растворимость азота и воздуха в жидкостях». J. Phys. Chem. Ref. Данные. 13 (2): 308–19.
- ^ Макби ET (март 1947 г.). «Химия фтора». Ind. Eng. Chem. 39 (3): 236–237. Дои:10.1021 / ie50447a002.
- ^ Зигемунд Г., Швертфегер В., Фейринг А., Смарт Б., Бер Ф., Фогель Н., МакКусик Б. «Соединения фтора, органические» в «Энциклопедии промышленной химии Ульмана» 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a11_349
- ^ «Архивная копия». Архивировано из оригинал на 2015-09-24. Получено 2014-05-19.CS1 maint: заархивированная копия как заголовок (связь)
- ^ «Обобщение и план тестирования HPV» (PDF). Интернет-архив. Архивировано из оригинал (PDF) на 2012-12-02. Получено 2019-01-03.
- ^ Яманучи К.; Ёкояма К. (1975). «Труды X Международного конгресса по питанию: симпозиум по перфторхимической искусственной крови, Киото»: 91. Цитировать журнал требует
| журнал =(помощь) - ^ «Архивная копия». Архивировано из оригинал в 2014-05-19. Получено 2014-05-19.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Platts DG; Фрейзер Дж. Ф. (2011). «Реанимация и реанимация». 13 (1): 44–55. Цитировать журнал требует
| журнал =(помощь) - ^ Гейер Р.П. (1975). "Proc. Xth Intern. Congress for Nutr .: Symp on Perfluorochemical Artif. Blood, Kyoto": 3–19. Цитировать журнал требует
| журнал =(помощь) - ^ Изменение, Рамочная конвенция ООН по климату. "Киотский протокол". Unfccc.int. Получено 2017-09-27.
- ^ Myhre, G., D. Shindell, F.-M. Bréon, W. Collins, J. Fuglestvedt, J. Huang, D. Koch, J.-F. Ламарк, Д. Ли, Б. Мендоза, Т. Накадзима, А. Робок, Г. Стивенс, Т. Такемура и Х. Чжан (2013) «Антропогенное и естественное радиационное воздействие» (см. Таблицу 8.A.1). В: Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад Межправительственной группы экспертов по изменению климата. Стокер, Т.Ф., Д. Цинь, Г.-К. Платтнер, М. Тиньор, С.К. Аллен, Дж. Бошунг, А. Науэльс, Ю. Ся, В. Бекс и П.М. Мидгли (ред.). Издательство Кембриджского университета, Кембридж, Великобритания и Нью-Йорк, штат Нью-Йорк, США.
- ^ «Анодный эффект». aluminium-production.com.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2013-02-16. Получено 2014-05-20.CS1 maint: заархивированная копия как заголовок (связь) climvision.gov
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2014-02-07. Получено 2014-05-19.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Имамура Y; Minami M; Ueki M; Сато Б; Икеда Т (2003). «Использование перфторуглеродной жидкости во время витрэктомии при тяжелой пролиферативной диабетической ретинопатии». Br J Ophthalmol. 87 (5): 563–566. Дои:10.1136 / bjo.87.5.563. ЧВК 1771679. PMID 12714393.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) в 2014-05-19. Получено 2014-05-19.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Банки, RE (1970). Фторуглероды и их производные, второе издание. Лондон: MacDonald & Co. (Publishers) Ltd., стр. 203–207. ISBN 978-0-356-02798-2.
- ^ «Октафторнафталин». ChemSpider.
внешняя ссылка
- Фторуглероды и гексафторид серы, предложенные Европейским техническим комитетом по фторуглеродам
- ХФУ и разрушение озона Freeview видео предоставлено Vega Science Trust.
- Введение во фторполимеры
- Фторорганическая химия Грэма Сэндфорда[постоянная мертвая ссылка ]











