Бромид золота (III) - Gold(III) bromide
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Бромид золота (III) | |
| Другие имена Бромид ауриновой кислоты Бромид золота Бромид золота (III) Трибромид золота Дигольд гексабромид | |
| Идентификаторы | |
3D модель (JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.030.582 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| AuBr3 | |
| Молярная масса | 436,69 г / моль |
| Внешность | от темно-красного до черного кристаллический |
| Температура плавления | 97,5 ° С (207,5 ° F, 370,6 К) |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бромид золота (III) представляет собой твердое кристаллическое вещество от темно-красного до черного цвета.[1][2][3] Он имеет эмпирическая формула AuBr3, но существует в основном как димер с молекулярная формула Au2Br6 в котором два атома золота мостовой двумя атомами брома.[2][3][4] Его обычно называют бромидом золота (III), трибромидом золота и редко, но традиционно, аурическим бромидом, а иногда и гексабромидом диголда. Как и другие галогениды золота, это соединение уникально тем, что является координационным комплексом группа 11 переходный металл, устойчивый в степень окисления трех, тогда как комплексы меди или серебра сохраняются в степенях окисления один или два.[5]
История
Первое упоминание о каких-либо исследованиях или изучении галогенидов золота относится к началу-середине 19 века, и есть три основных исследователя, связанных с обширным исследованием этой конкретной области химии: Томсен, Шоттлендер и Крюсс.[6][7][8][9]
Структура
Димер, диголд гексабромид, имеет структурные свойства, аналогичные свойствам других димерных соединений тригалогенида золота, таких как хлорид золота (III). Золотые центры выставляют квадратный плоский согласование с валентными углами примерно 90 градусов.[3][4]
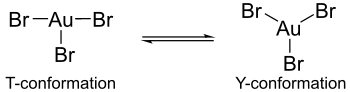
Расчеты показывают, что в гипотетических мономерных формах тригалогенидов золота Эффект Яна-Теллера вызывает различия в структурах галогенидных комплексов золота. Например, бромид золота (III) содержит одну длинную и две короткие связи золото-бром, тогда как хлорид золота (III) и фторид золота (III) состоят из двух длинных и одной короткой связи золото-галоген.[4] Более того, трибромид золота не проявляет такой же координации вокруг центрального атома золота, как трихлорид золота или трифторид золота. В последних комплексах координация проявляет Т-конформацию, но в трибромиде золота координация существует как более динамический баланс между Y-конформацией и Т-конформацией. Эту разницу в координации можно отнести к Эффект Яна-Теллера но в большей степени это связано с уменьшением π-обратной связи атомов золота с бромными лигандами по сравнению с обратной π-связью, обнаруженной с лигандами фтора и хлора. Это также уменьшение π-обратной связи, которое объясняет, почему трибромид золота менее стабилен, чем его трифторидные и трихлоридные аналоги.[4]
Подготовка
Наиболее распространенный метод синтеза бромида золота (III) - нагревание золота и избытка жидкости. бром при 140 ° C:[1]
- 2 Au + 3 Br2 → Au2Br6
В качестве альтернативы реакция галогенидного обмена хлорид золота (III) с бромистоводородная кислота также оказался успешным в синтезе бромида золота (III):
- Au2Cl6 + 6 HBr → 6 HCl + Au2Br6
Эта реакция вызвана образованием относительно более стабильных соляная кислота по сравнению с бромистоводородная кислота.[10]
Химические свойства
Нейтральный мономер AuBr3, а также другие нейтральные разновидности тригалогенида золота не были выделены в газовой фазе, что указывает на координационный номер три не одобряются.[5][11] Преимущественно золото (III) демонстрирует плоско-квадратную координацию, соответствующую предпочтительному координационному числу четыре.[3]
В частности, в растворах тригалогениды золота (III) имеют тенденцию добавлять четвертый лиганд с образованием более предпочтительного четырехкоординированного комплекса.[5][11] Что касается трибромида золота, обычно покупают гидрат бромида золота (III), AuBr.3⋅H2O, где центральный атом золота имеет координационное число четыре, а не безводный форма соединения, которая имеет координационное число три.
Альтернативно, если четвертый лиганд не добавлен, трибромид золота будет олигомеризоваться с образованием димерного комплекса с галогеновой мостиковой связью, упомянутого ранее.[5]
- 2 AuBr3 → Au2Br6
Кроме того, как и хлорид золота (III), трибромид золота является кислотой Льюиса и может образовывать несколько комплексов.[11] Например, при наличии бромистоводородная кислота, димер растворяется и образуется бромоазуровая кислота.[3]
- HBr (водн.) + AuBr3 (водный) → H+AuBr4− (водн.)
Димер также подвергается гидролиз быстро во влажном воздухе.[1][3]
Использует
Каталитическая химия
Бромид золота (III) используется в качестве катализатора в различных реакциях, но одно из наиболее интересных его применений находится в Реакция Дильса-Альдера. В частности, соединение катализирует реакцию между единичным элементом и карбонил соединения с образованием шестичленного циклического соединения.[12]
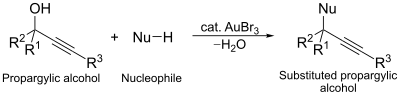
Еще одно каталитическое применение трибромида золота - нуклеофильное замещение реакция пропаргиловых спиртов. В этой реакции комплекс золота действует как спирт-активирующий агент, облегчая замещение.[13]
Обнаружение кетамина
Бромид золота (III) можно использовать в качестве реагента для тестирования на наличие кетамин.[14]
0,25% AuBr3 Готовят 0,1 М NaOH, получая коричневато-желтый раствор. Две капли этого раствора добавляются в пластину для пятен и добавляется небольшое количество кетамина. Смесь дает темно-фиолетовый цвет в течение приблизительно одной минуты, который превращается в темный, черно-фиолетовый цвет в течение приблизительно двух минут.
Ацетаминофен, аскорбиновая кислота, героин, лактоза, маннитол, морфий, и сахароза все они вызывают мгновенное изменение цвета на пурпурный, как и другие соединения с фенольными и гидроксильными группами.
Ничто из того, что обычно встречается в сочетании с кетамином, не дает такого же изменения цвета за одно и то же время.
"Первоначальный пурпурный цвет может быть результатом образования комплекса между золотом и кетамином. Причина изменения цвета с пурпурного на темно-черно-пурпурный неизвестна; однако это может быть связано с окислительно-восстановительной реакцией, которая приводит к небольшое количество коллоидного золота ».[14]
Рекомендации
- ^ а б c Макинтайр, Дж. Э. (ред.) Словарь неорганических соединений; Чепмен и Холл: Лондон, 1992; т. 1. С. 121.
- ^ а б Greenwood, N.N .; Эрншоу, А. Химия элементов; Баттерворт-Хейнеман: Оксфорд, 1997; стр. 1183-1185
- ^ а б c d е ж Cotton, F.A .; Wilkinson, G .; Мурильо, Калифорния; Бохманн, М. Продвинутая неорганическая химия; Джон Уайли и сыновья: Нью-Йорк, 1999; стр. 1101-1102
- ^ а б c d Schulz, A .; Харгиттай, М. Chem. Евро. Дж. 2001, т. 7. С. 3657-3670.
- ^ а б c d Швердтфегер, П. Варенье. Chem. Soc. 1989, т. 111, стр. 7261-7262.
- ^ Ленгефилд, Ф. Варенье. Chem. Soc. 1901, т. 26, с. 324
- ^ Томсен, Дж. J. prakt. Chem. 1876, т. 13. С. 337.
- ^ Шоттлендер, Justus Liebigs Ann. Chem., т. 217, стр. 312
- ^ Крюсс, Г. Бер. Dtsch. Chem. Ges. 1887, т. 20. С. 2634.
- ^ Dell'Amico, D.B .; Calderazzo, F .; Morvillo, A .; Пелицци, G; Робино, П. J. Chem. Soc., Dalton Trans. 1991, стр. 3009-3016
- ^ а б c Schwerdtfeger, P .; Boyd, P.D.W .; Brienne, S .; Баррелл, К. Неорг. Chem. 1992, т. 31, стр. 3411-3422.
- ^ Asao, N .; Aikawa, H .; Ямамото, Ю. Варенье. Chem. Soc. 2004, т. 126, стр. 7458-7459.
- ^ Георгий, М .; Boucard, V .; Кампань, Дж. Варенье. Chem. Soc. 2005, т. 127, с. 14180-14181.
- ^ а б Сарвар, Мохаммад. «Новый специфический цветовой тест на кетамин». Микрограмма. Отдел по борьбе с наркотиками. Архивировано из оригинал на 2010-10-17. Получено 2012-01-26.