Бромид железа (II) - Iron(II) bromide
 | |
| Имена | |
|---|---|
| Название ИЮПАК Бромид железа (II) | |
| Другие имена Бромид железа | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.244 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| FeBr2 | |
| Молярная масса | 215,65 г моль−1 |
| Внешность | желто-коричневое твердое вещество |
| Плотность | 4,63 г см−3, твердый |
| Температура плавления | 684 ° С (1263 ° F, 957 К) (безводный) 27 ° C (гексагидрат) |
| Точка кипения | 934 ° С (1713 ° F, 1207 К) |
| 117 г / 100 мл | |
| Растворимость в других растворителях | THF, метанол, этиловый спирт |
| +13,600·10−6 см3/ моль | |
| Структура | |
| Ромбоэдрический, hP3, SpaceGroup = P-3m1, No. 164 | |
| восьмигранный | |
| Опасности | |
| Главный опасности | никто |
| R-фразы (устарело) | R20 R36 / 37/38 |
| S-фразы (устарело) | S26 S36 |
| Родственные соединения | |
Другой анионы | Хлорид железа (II) |
Другой катионы | бромид железа (III) |
Родственные соединения | VBr2 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бромид железа (II) является неорганическое соединение с химической формулой FeBr2. Безводное соединение представляет собой парамагнитное твердое вещество желтого или коричневатого цвета. Несколько гидраты FeBr2 также известны, все они представляют собой твердые тела бледного цвета. Это обычный предшественник других соединений железа в исследовательских лабораториях, но для этого соединения не существует приложений.
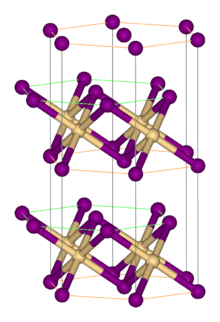
Структура
Как и большинство галогенидов металлов, FeBr2 имеет полимерную структуру, состоящую из изолированных металлических центров, сшитых галогенидами. Он кристаллизуется с CdI2 структура, состоящая из плотноупакованных слоев бромид-ионов, между которыми расположены ионы Fe (II) в октаэдрических дырках.[1] Упаковка галогенидов немного отличается от упаковки FeCl.2, который принимает CdCl2 мотив.
Синтез и реакции
FeBr2 синтезируется с использованием метанол раствор концентрированного бромистоводородная кислота и железный порошок. Он добавляет сольват метанола [Fe (MeOH)6] Br2 вместе с водородом. Нагревание комплекса метанола в вакууме дает чистый FeBr2.[2]
FeBr2 реагирует с двумя эквивалентами бромид тетраэтиламмония дать [(C2ЧАС5)4N]2FeBr4.[3] FeBr2 реагирует с бромидом и бромом с образованием сильно окрашенных частиц смешанной валентности [FeBr3Br9]−.[4]
Магнетизм
FeBr2 обладает сильным метамагнетизм при 4,2K и долгое время изучался как прототип метамагнитного соединения.[5][6]
Рекомендации
- ^ Haberecht, J .; Borrmann, Η .; Книп, Р. (2001). «Уточнение кристаллической структуры дибромида железа FeBr2». Zeitschrift für Kristallographie - Новые кристаллические структуры. 216 (1–4). Дои:10.1524 / ncrs.2001.216.14.544.
- ^ Уинтер, Г. (1973). «Галогениды железа (II)». Неорганические синтезы. Неорганические синтезы. 14. С. 99–104. Дои:10.1002 / 9780470132456.ch20. ISBN 9780470132456.
- ^ Гилл Н. С. Неорганические синтезы Ф .. Б. Тейлора 1967, том 9, стр. 136-142. Дои: 10.1002 / 9780470132401.ch37
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5
- ^ Уилкинсон, М. К .; Cable, J. W .; Wollan, E. O .; Келер, В. К. (15 января 1959 г.). «Нейтронографические исследования магнитного упорядочения в FeBr.2, CoBr2, FeCl2, и CoCl2". Физический обзор. 113 (2): 497–507. Bibcode:1959PhRv..113..497W. Дои:10.1103 / PhysRev.113.497.
- ^ Jacobs, I. S .; Лоуренс П. Э. (10 декабря 1967 г.). «Метамагнитные фазовые переходы и гистерезис в FeCl.2". Физический обзор. 164 (2): 866–878. Bibcode:1967PhRv..164..866J. Дои:10.1103 / PhysRev.164.866.
