Тетракарбонилгидрид железа - Википедия - Iron tetracarbonyl hydride
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Тетракарбонилдигидридоирон (II)[нужна цитата ] | |
| Другие имена Тетракарбонил дигидрид железа, тетракарбонилдигидро-железо | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| FeC 4ЧАС 2О 4 | |
| Молярная масса | 169,901 г моль−1 |
| Внешность | Жидкость (при -20 ° C) |
| Температура плавления | -70 ° С (-94 ° F, 203 К) |
| Точка кипения | -20 ° С (-4 ° F, 253 К) (разлагается) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
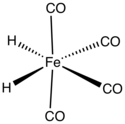
Тетракарбонил гидрид железа это металлоорганическое соединение с формулой H2Fe (CO)4. Это соединение было первым гидрид переходного металла обнаруженный. Комплекс устойчив при низких температурах, но быстро разлагается при температуре выше –20 ° C.[1]
Подготовка
Тетракарбонилгидрид железа был впервые произведен Hieber и Leutert из пентакарбонил железа, который сначала преобразуется в HFe (CO)−
4:[2][3]
- Fe (CO)5 + 2 ОН− → HFe (CO)−
4 + HCO−
3 - HFe (CO)−
4 + H+ → H2Fe (CO)4
Поскольку это соединение термостойкое и чувствительное к свету, идеальные условия в Мюнхене 1930-х годов требовали зимних ночей. Ранний метод получил название «синтез полярной ночи».
Согласно рекомендациям Хибера и Лейтерта, соединение может быть очищено перегонкой из ловушки в ловушку.[1][4]
Структура и свойства
В тетракарбонилгидриде железа Fe (CO)4 группа имеет C2v молекулярная симметрия с геометрией промежуточной между восьмигранный и четырехгранный. Рассматриваемые как октаэдрический комплекс, гидридные лиганды СНГ. Рассматривается как тетраэдрический Fe (CO)4 комплекса гидриды занимают смежные грани тетраэдра.[5] Хотя структура тетракарбонила железа с атомами водорода, связанными как один H2 лиганд был предложен в качестве промежуточного продукта в некоторых реакциях перегруппировки,[6] в стабильном состоянии соединения два атома являются независимыми лигандами.[7]
Реакции
ЧАС2Fe (CO)4 подвергается быстрой замене лиганда фосфорными лигандами:
- ЧАС2Fe (CO)4 + PPh3 → H2Fe (CO)3PPh3
Предложен механизм замещения, предусматривающий нестационарное образование 16e− формил промежуточный.[8]
ЧАС2Fe (CO)4 имеет pK1 из 6,8 и пK2 из 15.[9] Моноанион [HFe (CO)4]− имеет более обширную химическую реакцию, потому что он более стабилен, чем дигидрид.[10][11] Моноанион является промежуточным звеном в гомогенной смеси, катализируемой карбонилом железа. реакция конверсии водяного газа (РГСР). Медленным шагом в WGSR является перенос протона от воды к аниону гидрида железа.[12]
- HFe (CO)−
4 + H2O → H2Fe (CO)4 + ОН−
дальнейшее чтение
- Tsai, J.-C .; Khan, M.A .; Николай, К. (1991). «Восстановление согласованного диоксида углерода гидридами переходных металлов». Металлоорганические соединения. 10: 29–30. Дои:10.1021 / om00047a016.
- Farmery, K .; Килнер, М. (1970). «Реакции замещения дигидридотетракарбонилированного железа». Журнал химического общества A: 634. Дои:10.1039 / J19700000634.
Рекомендации
- ^ а б Blanchard, Arthur A .; Коулман, Джордж У. (1946). «Дигидрид тетракарбонила железа». Неорганические синтезы. 2: 243–244. Дои:10.1002 / 9780470132333.ch77. ISBN 9780470132333.
- ^ Hieber, W .; Leutert, F. (1931). "Zur Kenntnis des koordinative gebundene Kohlenoxyds: Bildung von Eisencarbonylwasserstoff". Naturwissenschaften. 19 (17): 360. Bibcode:1931NW ..... 19..360H. Дои:10.1007 / BF01522286. S2CID 791569.
- ^ Rittmeyer, P .; Вительманн, У. (2006). «Гидриды». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a13_199.
- ^ Vancea, L .; Грэм, W.A.G. (1977). «Стереохимически нежесткие шестикоординатные карбонильные комплексы металлов». J. Organomet. Chem. 134 (2): 219. Дои:10.1016 / S0022-328X (00) 81421-7.
- ^ McNeill, E. A .; Шолер, Ф. Р. (1977). «Молекулярная структура газообразных карбонилгидридов металлов марганца, железа и кобальта». Варенье. Chem. Soc. 99 (19): 6243. Дои:10.1021 / ja00461a011.
- ^ Soubra, C .; Oishi, Y .; Олбрайт, Т. А .; Фудзимото, Х. (2001). «Внутримолекулярные перегруппировки в шестикоординатных дигидридах рутения и железа». Неорг. Chem. 40 (4): 620–627. Дои:10.1021 / ic0006089. PMID 11225102.
- ^ Drouin, B.J .; Куколич, С. Г. (1998). "Молекулярная структура тетракарбонилдиводорода: микроволновые измерения и расчеты функциональной теории плотности". Варенье. Chem. Soc. 120 (27): 6774–6780. Дои:10.1021 / ja9741584.
- ^ Pearson, R.G .; Уокер, H.W .; Mauermann, H .; Ford, P.C. (1981). «Механизм миграции водорода для реакций замещения лигандов в карбонилгидридах металлов». Неорг. Chem. 20 (8): 2741. Дои:10.1021 / ic50222a078.
- ^ Уокер, H.W .; Kresge, C.T .; Ford, P.C .; Пирсон, Р. Г. (1979). «Скорость депротонирования и pKа Значения карбонилгидридов переходных металлов ». Варенье. Chem. Soc. 101 (24): 7428. Дои:10.1021 / ja00518a061.
- ^ Brunet, J.-J .; Chauvin, R .; Diallo, O .; Kindela, F .; Leglaye, P .; Neibecker, D., "Координационная химия одноядерных карбонильных комплексов железа", Coordination Chemistry Reviews 1998, 178-180, 331-352. Дои:10.1016 / S0010-8545 (98) 00075-7
- ^ Брюне, Дж. Дж. (1990). «Тетракарбонилгидридоферраты, MHFe (CO)4: Универсальные инструменты в области органического синтеза и катализа ». Chem. Ред. 90 (6): 1041–1059. Дои:10.1021 / cr00104a006.
- ^ Крэбтри, Р. Mingos D.M.P. 2007. Комплексная металлоорганическая химия III от основ до приложений. Elsevier Ltd.
