Феррат калия - Википедия - Potassium ferrate
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Феррат калия (VI) | |
| Другие имена Феррат калия Феррат дикалия | |
| Идентификаторы | |
| Характеристики | |
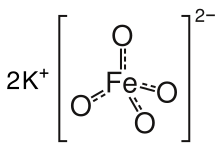
| K2FeO4 | |
| Молярная масса | 198,0392 г / моль |
| Внешность | Темно-фиолетовое твердое вещество |
| Плотность | 2,829 г / см3, твердый |
| Температура плавления | > 198 ° C (температура разложения) |
| растворим в 1М КОН | |
| Растворимость в других растворителях | реагирует с большинством растворителей |
| Структура | |
| K2ТАК4 мотив | |
| Тетраэдр | |
| 0 D | |
| Опасности | |
| Главный опасности | Окислитель |
| Паспорт безопасности | Внешний SDS |
| Пиктограммы GHS |  [1] [1] |
| Сигнальное слово GHS | Опасность[1] |
| H272[1] | |
| P210, P220, P221, P280, P370 + 378, P501[1] | |
| точка возгорания | негорючий |
| Родственные соединения | |
Другой анионы | K2MnO4 K2CrO4 K2RuO4 |
Другой катионы | BaFeO4 Na2FeO4 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Феррат калия это химическое соединение с формула K2FeO4. Этот фиолетовый соль является парамагнитный, и является редким примером утюг (VI) соединение. В большинстве своих соединений железо имеет степень окисления +2 или +3 (Fe2+ или Fe3+). Отражая его высокую степень окисления, FeO42− это мощный окислитель.
Синтез и структура

Георг Эрнст Шталь (1660-1734) впервые обнаружил, что остаток образовался при воспламенении смеси азотнокислый калий (селитра) и утюг порошок растворяют в воде с образованием пурпурного раствора. Эдмон Фреми (1814 - 1894) позже обнаружил, что слияние гидроксид калия и оксид железа (III) в воздухе дает соединение, растворимое в воде:
- 4KOH + Fe2О3 + 3O → 2K2FeO4 + 2H2О
Композиция соответствовала композиции манганат калия. В лаборатории K2FeO4 готовится окислением щелочной раствор соли железа (III) с концентрированным хлорный отбеливатель.[2]:
- 3ClO- + 3Fe (ОН)3(ЧАС2O)3 + 4K+ + 4OH- → 3Cl- + 2К2FeO4 + 11H2О
Соль изоструктурна K2MnO4, K2ТАК4, и K2CrO4. Тело состоит из K+ и тетраэдрический FeO42− анион, с расстояниями Fe-O 1,66 Å.[3] Трудно растворимая соль бария, BaFeO4, также известно.
Свойства и приложения
Основная трудность с использованием K2FeO4 в том, что он часто слишком реакционноспособен, о чем свидетельствует тот факт, что он разлагается при контакте с водой, особенно в кислой воде:[4]
- 4 К2FeO4 + 4 часа2O → 3 O2 + 2 Fe2О3 + 8 КОН
На высоком pH, водные растворы стабильны. Глубокие фиолетовые решения внешне похожи на перманганат калия (KMnO
4). Это более сильный окислитель, чем последний. В виде сухого твердого вещества K2FeO4 стабильно.
Поскольку побочными продуктами окислительно-восстановительных реакций являются оксиды железа, подобные ржавчине, K2FeO4 был описан как "зеленый окислитель. "Он был использован в очистки сточных вод как окислитель органических загрязнителей и как биоцид. Удобно, чтобы продукт реакции представлял собой оксигидроксид железа (III), превосходный флокулянт. В органический синтез, К2FeO4 окисляет начальный спирты.[5] Напротив, родственные окислители, такие как хромат считаются экологически опасными
K2FeO4 также привлек внимание как потенциальный катод материал в "супер железная батарея."
Стабилизированные формы феррата калия были предложены для удаления трансурановых частиц, как растворенных, так и суспендированных, из водных растворов. Было предложено количество тоннажа, чтобы помочь устранить последствия чернобыльской катастрофы в Беларуси. Этот новый метод был успешно применен для удаления широкого спектра тяжелых металлов.[нужна цитата ]
Работа по использованию осаждения трансурановых соединений и тяжелых металлов ферратом калия проводилась в лабораториях IC Technologies Inc. в партнерстве с ADC Laboratories с 1987 по 1992 год. Удаление трансурановых частиц проводилось на образцах из различных отделов. энергетических ядерных площадок США.[нужна цитата ]
Он был предложен в качестве остановки кровотечения для свежих ран.[6][7]
Рекомендации
- ^ а б c d «Феррат калия». Американские элементы. Получено 13 июня, 2019.
- ^ Schreyer, J.M .; Томпсон, Г. У .; Окерман, Л. Т. «Феррат калия (VI)», неорганический синтез, 1953, том IV, страницы 164–168.
- ^ Hoppe, M. L .; Schlemper, E.O .; Мурманн, Р. К. "Структура двухкалийного феррата (VI)" Acta Crystallographica 1982, том B38, стр. 2237-2239. Дои:10.1107 / S0567740882008395.
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.
- ^ Грин, Дж. Р. Энциклопедия реагентов для органического синтеза «Феррат калия» 2001, Джон Вили. Дои:10.1002 / 047084289X.rp212.
- ^ «Как работает WoundSeal». WoundSeal. 2016 г.
- ^ Заявка WO 2014153566, Джон Хен; Талмадж Келли Кин и Марк Трави, «Кровоостанавливающее устройство и метод», опубликовано 25 сентября 2014 г.
