Фторид хрома (II) - Chromium(II) fluoride
 | |
| Имена | |
|---|---|
| Другие имена дифторид хрома, фторид хрома, фторид хрома | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.030.140 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| CrF2 | |
| Молярная масса | 89.9929 г · моль−1 |
| Внешность | сине-зеленые переливающиеся кристаллы[1] гигроскопичный, превращается в Cr2О3 при нагревании на воздухе[1] |
| Плотность | 3,79 г / см3[1] |
| Температура плавления | 894 ° С (1641 ° F, 1167 К)[1] |
| Точка кипения | > 1300 ° С (2370 ° F, 1570 К)[1] |
| 76,7 г / 100 мл | |
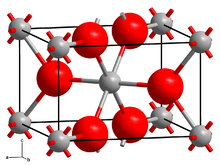
| Структура | |
| моноклинический[1] | |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -8,645 кДж / г (твердое вещество) |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H314, H318 | |
| P260, P264, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P405, P501 | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фторид хрома (II) является неорганическое соединение с формулой CrF2. Он существует как сине-зеленое переливающееся твердое тело. Фторид хрома (II) плохо растворим в воде, почти не растворим в спирте и растворим при кипячении. соляная кислота, но не подвергается воздействию горячего дистиллированного серная кислота или же азотная кислота. Как и другие соединения хрома, фторид хрома (II) окисляется до оксид хрома (III) в воздухе.[2]
Подготовка и состав
Компаунд получают, пропуская безводный фтороводород над безводным хлорид хрома (II). Реакция протекает при комнатной температуре, но обычно ее нагревают до 100-200 ° C, чтобы гарантировать завершение:[3]
- CrCl2 + 2 HF → CrF2 + 2 HCl
Как и многие дифториды, CrF2 принимает структуру вроде рутил с октаэдрической молекулярной геометрией около Cr (II) и тригональной геометрией на F−. Две из шести связей Cr-F имеют длину 2,43 Å, а четыре короткие - около 2,00 Å.[4]
Смотрите также
внешняя ссылка
Рекомендации
- ^ а б c d е ж Перри, Дейл Л. (2011). Справочник неорганических соединений, второе издание. Бока-Ратон, Флорида: CRC Press. п. 120. ISBN 978-1-43981462-8. Получено 2014-01-10.
- ^ Индекс Мерк, 14 изд. запись 2245
- ^ Райли, под редакцией Георга Брауэра; переведен Scripta Technica, Inc. Редактор переводов Рид Ф. (1963). Справочник по препаративной неорганической химии. Том 1 (2-е изд.). Нью-Йорк, Нью-Йорк: Academic Press. п. 256. ISBN 978-0121266011.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Джек, К. Х .; Мейтленд Р. «Кристаллические структуры и межатомные связи хромовых и хромовых фторидов» Труды Химического общества, Лондон (1957), 232. Дои:10.1039 / PS9570000217
| Этот неорганический сложный –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
