Фторид олова (IV) - Tin(IV) fluoride
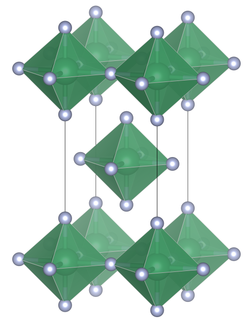 Элементарная ячейка фторида олова (IV) | |
| Имена | |
|---|---|
| Название ИЮПАК фторид олова (IV) | |
| Другие имена фторид олова, тетрафторид олова | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.029.105 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| SnF4 | |
| Молярная масса | 194,704 г / моль |
| Внешность | белое твердое вещество |
| Температура плавления | выше 700 ° C (сублимированные) |
| Структура | |
| Тетрагональный, tI10 | |
| И4 / ммм, № 139 | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фторид олова (IV) это химическое соединение из банка и фтор с химическая формула SnF4 и представляет собой белое твердое вещество с температурой плавления выше 700 ° C.[1]
SnF4 может быть получен реакцией металлического олова с газообразным фтором:[2]
- Sn + 2F2 → SnF4
Однако будет создан пассивирующий слой фторида металла, и в конечном итоге поверхность станет инертной. Альтернативный синтез - реакция SnCl4 с безводным фтороводород:[1]
- SnCl4 + 4HF → SnF4 + 4HCl
С фторидами щелочных металлов (например, KF) образуются гексафторостаннаты (например, K2SnF6), содержащие октаэдрические SnF62− анион. SnF4 ведет себя как Кислота Льюиса и аддукты L2· SnF4 и L · SnF4 были произведены.[2]
Структура
В отличие от другой жести тетрагалогениды, хлорид олова (IV), бромид олова (IV), и иодид олова (IV), которые содержат тетраэдрически координированное олово, фторид олова (IV) содержит плоские слои октаэдрически координированного олова, в которых октаэдры имеют четыре общих угла и есть два концевых, неподеленных атома фтора. транс для другого.[3] Температура плавления SnF4 намного выше (700 ° C), чем другие галогениды олова (IV), которые имеют относительно низкую температуру плавления, (SnCl4 -33,3 ° С; SnBr4, 31 ° С; SnI4, 144 ° С).[1] Структуру также можно противопоставить тетрафторидам более легких членов группы 14, (CF4, SiF4 и GeF4 ), которые в твердом состоянии образуют молекулярные кристаллы.[2]
Смотрите также
Рекомендации
- ^ а б c Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. стр.381. ISBN 0-7506-3365-4.
- ^ а б c Холлеман, А. Ф .; Wiberg, E .; Виберг, Н. (2001). Неорганическая химия, 1-е издание. Академическая пресса. п. 908. ISBN 0-12-352651-5.
- ^ Неорганическая химия [Мягкая обложка], 2-е издание, Housecroft, Sharpe, 2004, Pearson Education ISBN 0130399132, ISBN 978-0130399137
